- 509.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 有机化合物的结构特点
[学习目标] 1.了解有机化合物的成键特点,体会有机化合物的多样性。2.了解甲烷的结构,烷烃的概念、通式、结构特点。3.理解同分异构体的含义,会书写简单烷烃的同分异构体。
一、有机化合物的结构特点
[自主学习]
1.烃
仅由碳和氢两种元素组成的有机化合物,又叫碳氢化合物。CH4是组成最简单的烃。
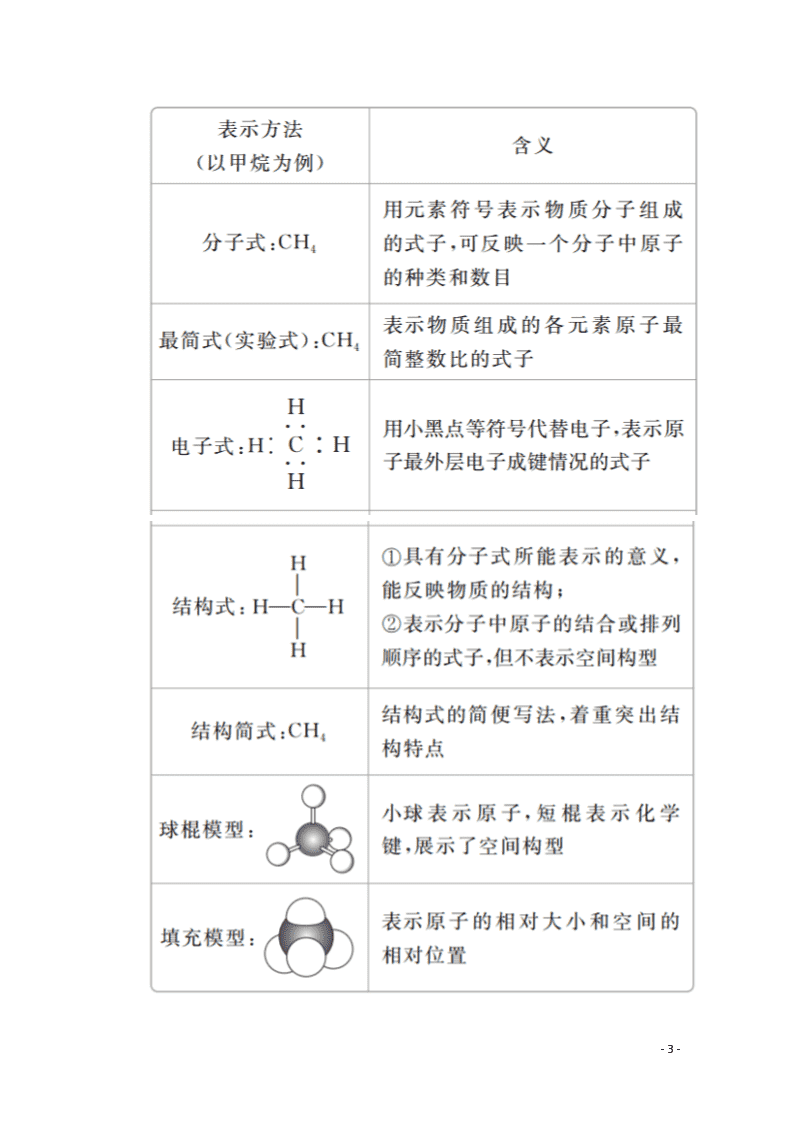
2.甲烷的分子组成和结构
3.有机化合物的结构特点
- 8 -
4.烷烃
(1)几种常见的烷烃
(2)命名——习惯命名法
烷烃可以根据所含碳原子数的多少来命名,小于等于10个碳原子的烷烃以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)命名为甲烷、乙烷、丙烷、丁烷等,大于10个碳原子的烷烃则以碳原子数命名,如十一烷、十二烷等。
1.CH4及其氯代物都是正四面体结构吗?
提示:CH4和CCl4是正四面体结构,而CH3Cl、CH2Cl2和CHCl3不是正四面体结构。
2.含有多个碳原子的烷烃(碳原子个数大于或等于3)的所有碳原子都在一条直线上吗?
提示:碳原子个数大于或等于3的烷烃分子中的碳原子不在一条直线上。这是因为每两个C—C之间的夹角不是180°。
[点拨提升]
1.有机物组成和结构的表示方法
- 8 -
- 8 -
2.烷烃的结构与性质
(1)通式:CnH2n+2(n≥1,且n为整数),符合此通式的烃一定是烷烃。
(2)结构特点:每个碳原子都达到价键饱和,烃分子中的碳原子之间以单键结合呈链状,剩余价键全部与氢原子结合。
(3)物理性质
①随着碳原子个数的增加,熔沸点逐渐升高,密度逐渐增大。
②常温下,碳原子个数≤4的烷烃及新戊烷为气态。
(4)化学性质
①稳定性:通常情况不与强酸、强碱、强氧化剂反应。
②可燃性:CnH2n+2+O2nCO2+(n+1)H2O。
③取代反应:CH3CH3+Cl2CH3CH2Cl+HCl。
[练习与活动]
1.如图是CH4、CCl4、CH3Cl分子的球棍模型图。下列说法正确的是( )
A.CH4、CCl4和CH3Cl都是正四面体结构
B.CH4、CCl4都是正四面体结构
C.CH4和CCl4的化学键完全相同
D.CH4、CCl4的结构相同,性质也相同
答案 B
解析 A项,CH3Cl中C—H键与C—Cl键长度不相同,故不是正四面体结构;C项,CH4中为C—H共价键,CCl4中为C—Cl共价键,二者不同;D项,CH4、CCl4中化学键不同,故性质不同。
2.下列有关烷烃的叙述中,不正确的是( )
A.在烷烃分子中,所有的化学键都为单键
B.所有的烷烃在光照条件下都能与Cl2发生取代反应
C.有的烷烃能燃烧,有的烷烃不能燃烧
D.随着碳原子数的增加,烷烃的熔沸点逐渐升高
答案 C
解析 所有烷烃都能燃烧,生成CO2和H2O。
规律方法
- 8 -
(1)分子式符合CnH2n+2的烃一定为烷径。
(2)含3个或3个以上碳原子的烷烃,其碳原子一定不在同一直线上。
二、同分异构现象和同分异构体
[自主学习]
1.概念
(1)同分异构现象
化合物具有相同的分子式,但具有不同结构的现象,叫做同分异构现象。
(2)同分异构体
具有相同分子式而结构不同的化合物互为同分异构体。
2.规律
一般来说,有机化合物分子中的碳原子越多,它的同分异构体数目就越多。
如丁烷有2种同分异构体,戊烷有3种同分异构体,己烷有5种同分异构体。
3.同分异构现象与有机化合物种类的关系
(1)在有机化合物中,同分异构现象是有机物结构多样性的又一表现。
(2)有机物结构多样性是导致有机化合物种类繁多、数量巨大的主要原因。
同分异构体的相对分子质量都相等,相对分子质量相等的有机物都是同分异构体吗?
提示:不一定。相对分子质量相等的有机物分子式不一定相同,如C2H4O2和C3H8O不是同分异构体。
[点拨提升]
1.同分异构体的正确理解
(1)分子式相同
①同分异构体一定具有相同的组成元素,但具有相同的组成元素的不一定是同分异构体。如CH4、C3H8组成元素均为C、H,显然二者不是同分异构体。
②同分异构体一定具有相同的相对分子质量,但具有相同的相对分子质量的不一定是同分异构体。如C2H4、N2的相对分子质量均为28,但二者不是同分异构体。
③同分异构体中各元素的质量分数一定相同,但元素质量分数相同的不一定是同分异构体。如C2H4与C3H6分子中C、H的质量分数均分别相同,但二者不是同分异构体。
(2)结构不同
①原子或原子团的连接顺序不同;
②原子的空间排列不同。
- 8 -
2.烷烃同分异构体的书写方法——“减碳移位”法
减碳移位法可概括为“两注意,四句话”。
如C6H14的同分异构体的书写:
(1)将分子中全部碳原子连成直链作为主链。
C—C—C—C—C—C
(2)从主链一端取下一个碳原子作为支链(即甲基),依次连在主链碳原子上,此时碳骨架有两种:
注意:甲基不能连在①位和⑤位上,否则会使碳链变长,②位和④位等效,只能用一个,否则重复。
(3)从主链上取下两个碳原子作为一个支链(即乙基)或两个支链(即2个甲基)依次连在主链碳原子上,此时碳骨架结构有两种:
注意:②位或③位上不能连乙基,否则会使主链上有5个碳原子,使主链变长。所以C6H14共有5种同分异构体。
[练习与活动]
3.下列事实中能证明甲烷分子是以碳原子为中心的正四面体结构的是( )
A.CH3Cl只代表一种物质
B.CH2Cl2只代表一种物质
C.CHCl3只代表一种物质
D.CCl4只代表一种物质
答案 B
解析
- 8 -
对于甲烷的正四面体结构,因为其4个顶点的位置完全相同,所以它的一氯代物(CH3Cl)、二氯代物(CH2Cl2)、三氯代物(CHCl3)、四氯代物(CCl4)都只有一种。而如果甲烷是平面正方形结构,虽然4个C—H键都完全相同,但4个顶点的氢原子的位置关系却不同,可能相邻,也可能相间,所以虽然CH3Cl、CHCl3、CCl4都只有一种,但CH2Cl2却有两种,一种是两个氯原子相邻,另一种是两个氯原子相间。由CH2Cl2只有
一种这一点可以判断出CH4为正四面体结构,而不是平面正方形结构。
4.下列物质的一卤代物的同分异构体最多的是( )
A.C4H10 B.
C.新戊烷 D.立方烷()
答案 A
解析 A项C4H10有①CH3CH2CH2CH3,②两种同分异构体,①中有两类等效氢,②中有两类等效氢,即共有4种一卤代物;B项有共有3类等效氢,其一卤代物有3种;C项只有一类等效氢,即有1种一卤代物;D项也只有一类等效氢,其一卤代物只有一种。
规律方法
烃的一元取代产物同分异构体数目的判断——等效氢法
(1)所谓“等效氢”就是烃分子中位置等同的氢原子。
(2)等效氢原子的判断
①连在同一碳原子上的氢原子等效。
②同一个碳原子所连接—CH3上的氢原子等效。如新戊烷分子中四个原子团—CH3上的12个氢原子等效。
③分子中处于对称位置上的氢原子等效。如
- 8 -
分子中的18个氢原子等效。
本课归纳总结
- 8 -
相关文档
- 2020版高中化学 第3章 重要的有机2021-07-055页
- 2019届一轮复习鲁科版第9章重要的2021-07-0512页
- 2018届高考一轮复习鲁科版第9章重2021-07-0518页
- 2020高中化学第三章重要的有机化合2021-07-057页
- 2020高中化学第三章重要的有机化合2021-07-057页
- 2020高中化学第三章重要的有机化合2021-07-056页
- 2020高中化学第三章重要的有机化合2021-07-037页
- 2020版高中化学 第3章 重要的有机2021-07-026页
- 2020高中化学第三章重要的有机化合2021-07-026页
- 2020高中化学第三章重要的有机化合2021-07-025页