- 190.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时跟踪训练(三) 纯碱的生产
一、选择题(本题包括10小题,每小题5分,共50分)
1.我国著名的化工专家侯德榜在20世纪20年代所创立的“侯氏制碱法”誉满全球。“侯氏制碱法”中的碱是指下列的( )
A.NaOH B.K2CO3
C.Na2CO3 D.NaHCO3
2.下列属于侯氏制碱法的优点的是( )
A.氨和二氧化碳由合成氨厂提供
B.母液可回收制氯化铵
C.氯化钠的利用率达96%
D.以上全是
3.下列说法不正确的是( )
A.“联合制碱法”和“氨碱法”的化学反应原理中都有下列化学反应
NH3+CO2+NaCl+H2O===NaHCO3↓+NH4Cl
2NaHCO3Na2CO3+H2O↑+CO2↑
B.“联合制碱法”生产中有氨的循环利用工艺
C.“氨碱法”生产中有氨的循环利用工艺
D.“联合制碱法”和“氨碱法”都有一定的局限性
4.工业上常用氨碱法制取碳酸钠(将氨气和二氧化碳先后通入饱和食盐水而析出小苏打,再经过滤、焙烧而得到纯碱),但却不能用氨碱法制碳酸钾,这是因为在溶液中( )
A.KHCO3溶解度较大
B.KHCO3溶解度较小
C.K2CO3溶解度较大
D.K2CO3溶解度较小
5.下列说法中不正确的是( )
A.用联合制碱法制造纯碱和氯化铵,原料的利用率高,不必考虑环境保护的问题
B.化工生产技术始终是在不断创新中发展,侯氏制碱法也还需要改进
C.社会对纯碱的需求是纯碱生产技术创新发展的原动力
D.纯碱生产技术的再创新需要多门学科、多种技术的协同作用
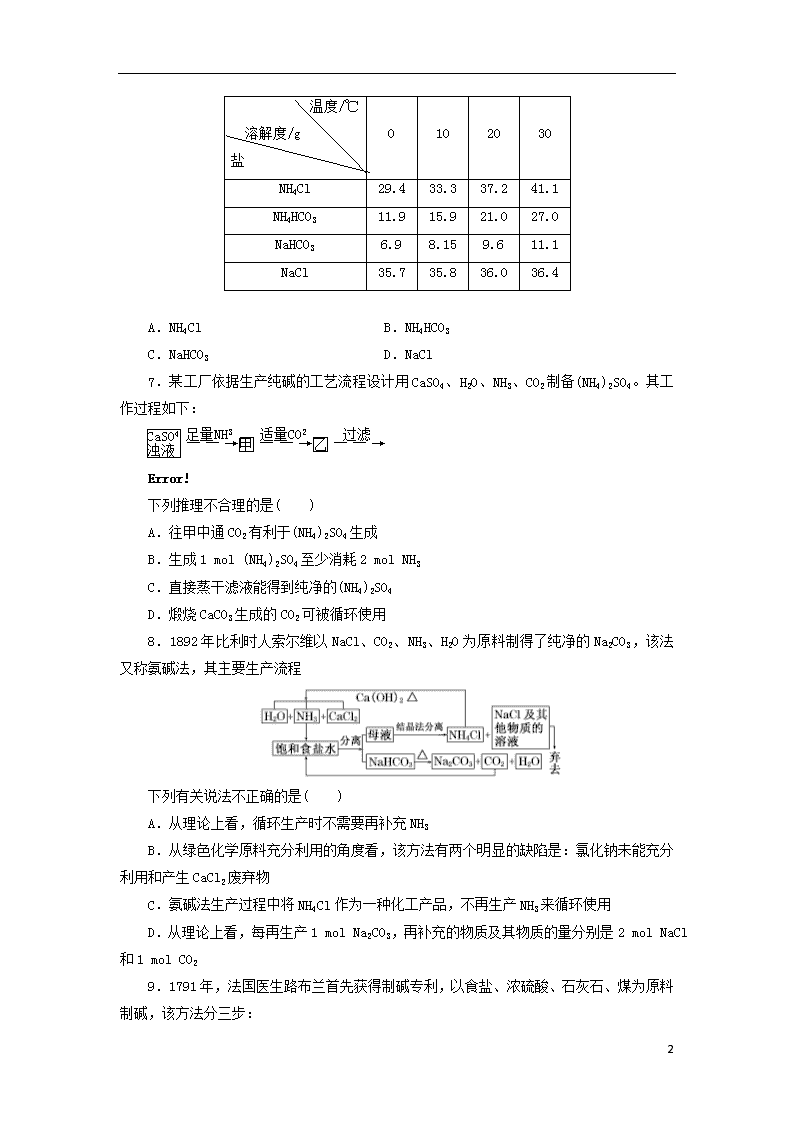
6.工业上将相同物质的量的NaCl、CO2、NH3在30 ℃时配成溶液,此时溶液中无晶体。当降温至某温度时,开始析出晶体,此晶体是( )
8
温度/℃
溶解度/g
盐
0
10
20
30
NH4Cl
29.4
33.3
37.2
41.1
NH4HCO3
11.9
15.9
21.0
27.0
NaHCO3
6.9
8.15
9.6
11.1
NaCl
35.7
35.8
36.0
36.4
A.NH4Cl B.NH4HCO3
C.NaHCO3 D.NaCl
7.某工厂依据生产纯碱的工艺流程设计用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工作过程如下:
下列推理不合理的是( )
A.往甲中通CO2有利于(NH4)2SO4生成
B.生成1 mol (NH4)2SO4至少消耗2 mol NH3
C.直接蒸干滤液能得到纯净的(NH4)2SO4
D.煅烧CaCO3生成的CO2可被循环使用
8.1892年比利时人索尔维以NaCl、CO2、NH3、H2O为原料制得了纯净的Na2CO3,该法又称氨碱法,其主要生产流程
下列有关说法不正确的是( )
A.从理论上看,循环生产时不需要再补充NH3
B.从绿色化学原料充分利用的角度看,该方法有两个明显的缺陷是:氯化钠未能充分利用和产生CaCl2废弃物
C.氨碱法生产过程中将NH4Cl作为一种化工产品,不再生产NH3来循环使用
D.从理论上看,每再生产1 mol Na2CO3,再补充的物质及其物质的量分别是2 mol NaCl和1 mol CO2
9.1791年,法国医生路布兰首先获得制碱专利,以食盐、浓硫酸、石灰石、煤为原料制碱,该方法分三步:
8
①用NaCl与H2SO4反应制Na2SO4:
2NaCl+H2SO4Na2SO4+2HCl↑
②用焦炭还原Na2SO4制Na2S:
Na2SO4+4CNa2S+4CO↑
③用硫化钠与石灰石反应制Na2CO3:
Na2S+CaCO3Na2CO3+CaS
下列说法正确的是( )
A.②③两步都是氧化还原反应
B.只有第②步是氧化还原反应
C.该方法对生产设备基本没有腐蚀
D.该方法对环境污染较小
10.反应NaCl+CO2+NH3+H2O===NaHCO3↓+NH4Cl是“氨碱法”的重要化学反应,以下是对该反应涉及的有关知识的部分见解,其中不正确的是( )
A.该条件下NaHCO3的溶解度较小
B.NaHCO3不是纯碱
C.析出固体后的溶液为NaHCO3的不饱和溶液
D.析出固体后的溶液为NaHCO3的饱和溶液
二、非选择题(本题包括4小题,共50分)
11.(12分)纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:________________________________________________________________________。
(2)写出“联合制碱法”有关反应的化学方程式:
________________________________________________________________________;
________________________________________________________________________。
(3)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=__________________。
12.(12分)侯氏制碱法原理是:将NH3和CO2气体通入饱和食盐水中即可获得NaHCO3和NH4Cl的混合物,然后分离出NaHCO3再加热制得纯碱。其流程如下:
8
参照下表:
物质
CO2
NH3
NaHCO3
NH4Cl
NaCl
溶解度(20 ℃)
V水∶V二氧化碳=1∶1
V水∶V氨气=1∶700
9.6 g
37.2 g
a g
回答下列问题:
(1)气体A、B依次是________。
A.CO2、NH3 B.NH3、CO2
C.任何顺序都可以
(2)写出(Ⅰ)和(Ⅱ)步骤总反应的化学方程式____________________________________
________________________________________________________________________。
由反应原理可知,a________9.6(填“<”、“>”或“=”)。
(3)操作(Ⅲ)的名称是________,化学实验室进行该操作用到的玻璃仪器有________________。
(4)经步骤(Ⅲ)所得液体中含有的盐为(写化学式)________。经过________(填操作名称)后可以得到化肥。
(5)每当通入NH3 44.8 L(标准状况下)时可以得到纯碱100.0 g,则NH3的利用率为________。
13.(12分)根据侯德榜制碱原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35 ℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质后转入蒸发皿中,灼烧2小时,制得Na2CO3固体。四种盐在不同温度下的溶解度表(g/100 g水)
盐
溶解度
温度/℃
NaCl
NH4HCO3
NaHCO3
NH4Cl
8
0
35.7
11.9
6.9
29.4
10
35.8
15.8
8.1
33.3
20
36.0
21.0
9.6
37.2
30
36.3
27.0
11.1
41.4
40
36.6
-①
12.7
45.8
50
37.0
-
14.5
50.4
60
37.3
-
16.4
55.3
100
39.8
-
-
77.3
注:①>35℃ NH4HCO3会分解。请回答:
(1)反应温度控制在30~35 ℃,是因为若高于35 ℃,则____________,若低于30 ℃,则______________;为控制此温度范围,采取的加热方法为_________________________。
(2)加料完毕后,继续保温30分钟,目的是___________________________________。静置后只析出NaHCO3晶体的原因是______________________________________________。
用蒸馏水洗涤NaHCO3晶体的目的是除去____________________________杂质(用化学式表示)。
(3)过滤所得的母液中含有______________________(用化学式表示),需加入________,并做进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
14.(14分)我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
(1)上述生产纯碱的方法称________,副产品的一种用途为________。
(2)沉淀池中发生的化学反应方程式是________________________________________
________________________________________________________________________。
(3)写出上述流程中X物质的化学式是________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________________________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有________________________________________________________________________
________________________________________________________________________。
a.增大NH的浓度,使NH4Cl更多地析出
8
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
答 案
1.选C 本题中的碱指的是纯碱Na2CO3。
2.选D 侯氏制碱法的优点有原料易得,NaCl的利用率高,而且产生的NH4Cl可以作肥料。
3.选B “氨碱法”将NH4Cl和Ca(OH)2再反应,使NH3循环利用;“联合制碱法”是制得纯碱和副产品氯化铵。
4.选A 氨碱法制取Na2CO3的原理是,在精制的食盐水中分别通入NH3、CO2,由于NaHCO3溶解度不大,当Na+、HCO浓度较大时便析出NaHCO3晶体,将过滤得到的NaHCO3煅烧得Na2CO3,由于KHCO3溶解度较大,无法从溶液中析出,故无法利用其分解制取K2CO3。
5.选A 化工生产一般都会产生污染物,要科学地评价纯碱生产技术及其他化工生产技术,环境保护也需考虑。
6.选C 据表中数据可知,随温度的降低,NaHCO3的溶解度始终最小,故首先析出的物质应是NaHCO3。
7.选C 观察流程图可知,甲中已通入了足量的NH3,往甲中通CO2的目的是与NH3反应生成(NH4)2CO3,从而有利于(NH4)2SO4的生成,A、B正确;煅烧生成的CO2可以通入甲中循环使用,D正确。
8.选C 工业制碱的原理涉及反应:NaCl+NH3+CO2+H2O===NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+CO2↑+H2O↑。索尔维法用生成的氯化铵制备氨气,将氯化铵进行了循环利用,所以从理论上讲,是不需要补充氨的。但是在生产过程中,NaCl母液被弃去,氯化铵制备氨气生成了无用的氯化钙,这两点是索尔维法的缺陷。根据反应关系式及原子守恒,从理论上看每生产1 mol Na2CO3,需再补充的物质及其物质的量分别是2 mol NaCl和1 mol CO2。
9.选B 氧化还原反应是有元素化合价变化的反应,第③步反应无化合价变化,不是氧化还原反应,A不正确;该生产中产生HCl,对设备严重腐蚀;第②步反应生成的CO是大气污染物,故C、D不正确。
10.选C 该条件下NaHCO3的溶解度不大,因此析出NaHCO3,析出后应为NaHCO3的饱和溶液。
11.解析:(3)联合制碱法反应的化学方程式为NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,2NaHCO3Na2CO3+H2O↑+CO2↑,总反应可看作是2NH3+2NaCl+CO2+H
8
2O===Na2CO3+2NH4Cl,所以,原子利用率(%)=×100%=×100%。
答案:(1)2NH4Cl+Ca(OH)22NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O+NaCl(饱和)===NaHCO3↓+NH4Cl 2NaHCO3Na2CO3+CO2↑+H2O↑
(3)×100%
12.解析:(1)氨气在水溶液中溶解度大,故侯氏制碱法中先向饱和食盐水中通入NH3,后通入CO2。
(2)由反应原理:饱和食盐水中析出NaHCO3沉淀,故同温下NaCl的溶解度大于NaHCO3的溶解度,a>9.6。
(5)由反应转化关系:NH3~NaCl~Na2CO3,当得到100.0 g纯碱时,消耗NH3为×2=1.887 mol,则NH3的利用率为×100%=94.34%。
答案:(1)B
(2)NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl >
(3)过滤 烧杯、漏斗、玻璃棒
(4)NaHCO3、NH4Cl(NaCl写与不写均可) 结晶
(5)94.34%
13.解析:(1)温度超过35 ℃,NH4HCO3会分解,反应速率受温度的影响,温度低,反应速率慢,此温度下,用水浴加热较为好控制。
(2)反应需要保持一段时间,使其反应充分。NaHCO3晶体表面会附着未反应完的NaCl、NH4HCO3及生成的NH4Cl等,需水洗除去。
(3)加入盐酸可使NaHCO3转化为NaCl,也可使NH4HCO3转化为NH4Cl。
答案:(1)NH4HCO3分解 反应速率降低 水浴加热
(2)使反应充分进行 NaHCO3的溶解度最小
NaCl、NH4Cl、NH4HCO3
(3)NaHCO3、NaCl、NH4Cl、NH4HCO3 HCl
14.解析:(1)、(2)两问题为识记性题目。(3)需要在理解原理的基础上作出回答。(4)原料利用率和基本实验操作的考查。“循环操作”是提高原料利用率、解决环境污染等问题的关键思想。过滤是初中就要求掌握的基本操作。(5)本问题是Cl-
8
的检验,这是中学常见离子的检验。(6)实际是平衡理论的具体应用。
答案:(1)联合制碱法或侯氏制碱法 制化肥或作电解液等(其他合理答案均可)
(2)NH3+CO2+H2O+NaCl===NH4Cl+NaHCO3↓
(3)CO2
(4)Ⅰ 过滤
(5)稀硝酸和硝酸银溶液 (6)ac
8
相关文档
- 高中化学鲁科版选修3课后练习:2-3-22021-07-063页
- 2020高中化学课时跟踪训练12晶体的2021-07-069页
- 高中化学人教版选修四(课件)第三章 2021-07-0639页
- 高中化学选修2化学与技术-第一单元2021-07-0613页
- 2019-2020学年高中化学课时作业232021-07-0611页
- (人教版)2021年最新高中化学必修12021-07-06291页
- 高中化学同步练习 1_1_2 能量最低2021-07-064页
- 高中化学课件必修二《第三章 第三2021-07-0638页
- 高中化学课时作业18煤的综合利用苯2021-07-069页
- 高中化学 第三章 第二节 醛教案 新2021-07-065页