- 1.43 MB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020年全国统一高考化学试卷(江苏卷)
一、选择题
1.打赢蓝色保卫战,提高空气质量。下列物质不属于空气污染物的是()
A.PM2.5 B.O2 C.SO2 D.NO
2.反应8NH3+3Cl2=6NH4Cl+N2可用于氯气管道的检漏。下列表示相关微粒的化学用语正确的是()
A.中子数为9的氮原子:79N
B.N2分子的电子式:
C.Cl2分子的结构式:Cl—Cl
D.Cl-的结构示意图:
3.下列有关物质的性质与用途具有对应关系的是()
A.铝的金属活泼性强,可用于制作铝金属制品
B.氧化铝熔点高,可用作电解冶炼铝的原料
C.氢氧化铝受热分解,可用于中和过多的胃酸
D.明矾溶于水并水解形成胶体,可用于净水
4.常温下,下列各组离子在指定溶液中能大量共存的是()
A.0.1mol⋅L-1氨水溶液:Na+、K+、OH-、NO3-
B.0.1mol⋅L-1盐酸溶液:Na+、K+、SO42-、SiO32-
C.0.1mol⋅L-1KMnO4溶液:NH4+、Na+、NO3-、I-
D.0.1mol⋅L-1AgNO3溶液:NH4+、Mg2+、Cl-、SO42-
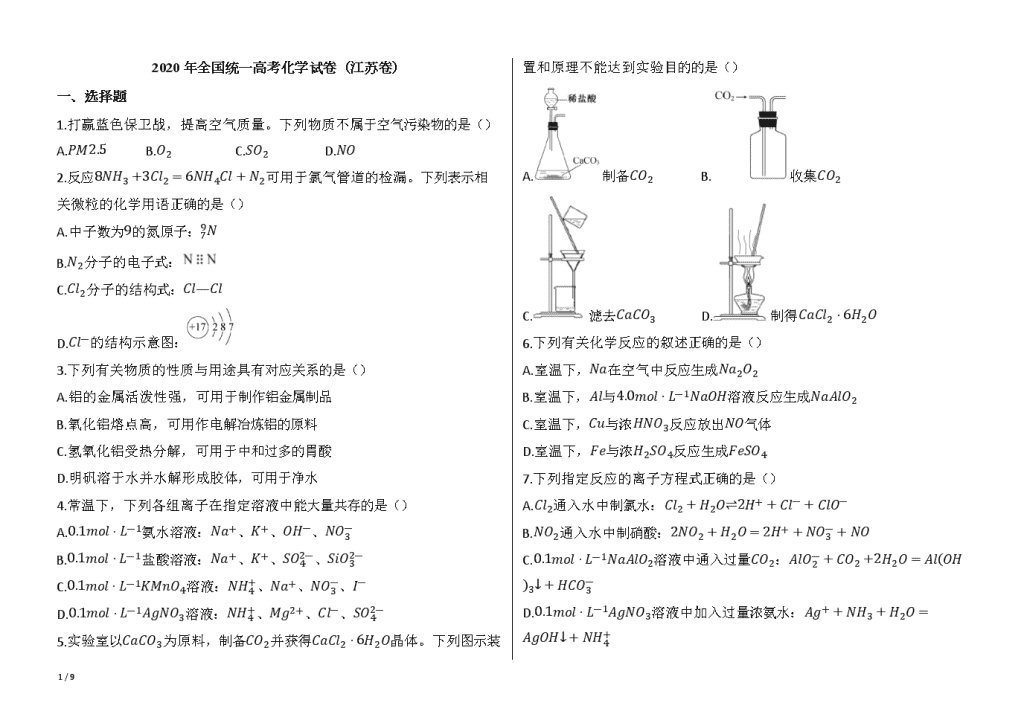
5.实验室以CaCO3为原料,制备CO2并获得CaCl2⋅6H2O晶体。下列图示装置和原理不能达到实验目的的是()
A.制备CO2 B.收集CO2
C.滤去CaCO3 D.制得CaCl2⋅6H2O
6.下列有关化学反应的叙述正确的是()
A.室温下,Na在空气中反应生成Na2O2
B.室温下,Al与4.0mol⋅L-1NaOH溶液反应生成NaAlO2
C.室温下,Cu与浓HNO3反应放出NO气体
D.室温下,Fe与浓H2SO4反应生成FeSO4
7.下列指定反应的离子方程式正确的是()
A.Cl2通入水中制氯水:Cl2+H2O⇌2H++Cl-+ClO-
B.NO2通入水中制硝酸:2NO2+H2O=2H++NO3-+NO
C.0.1mol⋅L-1NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.0.1mol⋅L-1AgNO3溶液中加入过量浓氨水:Ag++NH3+H2O=AgOH↓+NH4+
9 / 9
8.反应SiCl4(g)+2H2(g)====高温Si(s)+4HCl(g)可用于纯硅的制备。下列有关该反应的说法正确的是()
A.该反应ΔH>0、ΔS<0
B.该反应的平衡常数K=c4(HCl)c(SiCl4)×c2(H2)
C.高温下反应每生成1molSi需消耗2×22.4LH2
D.用E表示键能,该反应ΔH=4E(Si-Cl)+2E(H-H)-4E(H-Cl)
9.海水晒盐后精制得到NaCl,氯碱工业电解饱和NaCl溶液得到Cl2和NaOH,以NaCl、NH3、CO2等为原料可得到NaHCO3;向海水晒盐得到的卤水中通Cl2可制溴;从海水中还能提取镁。
下列关于Na、Mg、Cl、Br元素及其化合物的说法正确的是()
A.NaOH的碱性比Mg(OH)2的强
B.Cl2得到电子的能力比Br2的弱
C.原子半径r:r(Br)>r(Cl)>r(Mg)>r(Na)
D.原子的最外层电子数n:n(Na)c(HCO3-)>c(CO32-)>c(OH-)
B.氨水-NH4Cl混合溶液(pH=9.25):c(NH4+)+c(H+)=c(NH3⋅H2O)+c(OH-)
C.CH3COOH-CH3COONa混合溶液(pH=4.76):c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)
D.H2C2O4-NaHC2O4混合溶液(pH=1.68,H2C2O4为二元弱酸):c(H+)+c(H2C2O4)=c(Na+)+c(C2O42-)+c(OH-)
15.CH4与CO2重整生成H2和CO的过程中主要发生下列反应
CH4(g)+CO2(g)=2H2(g)+2CO(g)ΔH=247.1kJ⋅mol-1
H2(g)+CO2(g)=H2O(g)+CO(g)ΔH=41.2kJ⋅mol-1。在恒压、反应物起始物质的量比n(CH4):n(CO2)=1:1条件下,CH4和CO2的平衡转化率随温度变化的曲线如图所示。下列有关说法正确的是()
A.升高温度、增大压强均有利于提高CH4的平衡转化率
B.曲线B表示CH4的平衡转化率随温度的变化
C.相同条件下,改用高效催化剂能使曲线A和曲线B相重叠
D.恒压、800K、n(CH4):n(CO2)=1:1条件下,反应至CH4转化率达到X点的值,改变除温度外的特定条件继续反应,CH4转化率能达到Y点的值
二、解答题
16.吸收工厂烟气中的SO2,能有效减少SO2对空气的污染。氨水、ZnO水悬浊液吸收烟气中SO2后经O2催化氧化,可得到硫酸盐。已知:室温下,ZnSO3
9 / 9
微溶于水,Zn(HSO3)2易溶于水;溶液中H2SO3、HSO3-、SO32-的物质的量分数随pH的分布如图-1所示。
(1)氨水吸收SO2。向氨水中通入少量SO2,主要反应的离子方程式为______________________________;当通入SO2至溶液pH=6时,溶液中浓度最大的阴离子是_______________________(填化学式)。
(2)ZnO水悬浊液吸收SO2。向ZnO水悬浊液中匀速缓慢通入SO2,在开始吸收的40min内SO2吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图-2)。溶液pH几乎不变阶段,主要产物是_____________(填化学式);SO2吸收率迅速降低阶段,主要反应的离子方程式为_________________________________________。
(3)O2催化氧化。其他条件相同时,调节吸收SO2得到溶液的pH在4.5∼6.5范围内,pH越低SO42-生成速率越大,其主要原因是__________________________;随着氧化的进行,溶液的pH将____________(填“增大”“减小”或“不变”)。
17.化合物F是合成某种抗肿瘤药物的重要中间体,其合成路线如下:
(1)A中的含氧官能团名称为硝基、___________和________________。
(2)B的结构简式为_____________。
(3)C→D的反应类型为____________________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式________。
①能与FeCl3溶液发生显色反应。
②能发生水解反应,水解产物之一是α-氨基酸,另一产物分子中不同化学环境的氢原子数目比为1:1且含苯环。
(5)写出以CH3CH2CHO和为原料制备的合成路线流程图
(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
18.次氯酸钠溶液和二氯异氰尿酸钠(C3N3Cl2Na)都是常用的杀菌消毒剂。NaClO可用于制备二氯异氰尿酸钠。
(1)NaClO溶液可由低温下将Cl2缓慢通入NaOH溶液中而制得。制备NaClO的离子方程式为________________________;用于环境杀菌消毒的NaClO
9 / 9
溶液须稀释并及时使用,若在空气中暴露时间过长且见光,将会导致消毒作用减弱,其原因是_______________________________________。
(2)二氯异氰尿酸钠优质品要求有效氯大于60%。通过下列实验检测二氯异氰尿酸钠样品是否达到优质品标准。实验检测原理为C3N3O3Cl2-+H++2H2O=C3H3N3O3+2HClO
HClO+2I-+H+=I2+Cl-+H2OI2+2S2O32-=S4O62-+2I-
准确称取1.1200g样品,用容量瓶配成250.0mL溶液;取25.00mL上述溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min;用0.1000mol⋅L-1Na2S2O3标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗Na2S2O3溶液20.00mL。
①通过计算判断该样品是否为优质品。
(写出计算过程,该样品的有效氯=测定中转化为HCIO的氯元素质量×2样品质量)
②若在检测中加入稀硫酸的量过少,将导致样品的有效氯测定值________(填“偏高”或“偏低”)。
19.实验室由炼钢污泥(简称铁泥,主要成份为铁的氧化物)制备软磁性材料α-Fe2O3其主要实验流程如下:
(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有()
A.适当升高酸浸温度 B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+。“还原”过程中除生成Fe2+外,还会生成____________________(填化学式);检验Fe3+是否还原完全的实验操作是___________________________。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是________________________[Ksp(CaF2)=5.3×10-9,Ka(HF)=6.3×10-4]
(4)沉铁。将提纯后的FeSO4溶液与氨水-NH4HCO3混合溶液反应,生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为_____________________________________。
②设计以FeSO4溶液、氨水-NH4HCO3混合溶液为原料,制备FeCO3的实验方案:_______________________________________________[FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]
20.CO2/HCOOH循环在氢能的贮存/释放、燃料电池等方面具有重要应用。
(1)CO2催化加氢。在密闭容器中,向含有催化剂的KHCO3溶液(CO2与KOH溶液反应制得)中通入H2生成HCOO-,其离子方程式为_________________;其他条件不变,HCO3-转化为HCOO-的转化率随温度的变化如图所示。反应温度在40∘C~80∘C范围内,HCO3-催化加氢的转化率迅速上升,其主要原因是_______________________________。
9 / 9
(2)HCOOH燃料电池。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。
①电池负极电极反应式为__________________;放电过程中需补充的物质A为____________(填化学式)。
②如图所示的HCOOH燃料电池放电的本质是通过HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为_________________________。
(3)HCOOH催化释氢。在催化剂作用下,HCOOH分解生成CO2和H2可能的反应机理如图所示。
①HCOOD催化释氢反应除生成CO2外,还生成__________________(填化学式)。
②研究发现:其他条件不变时,以HCOOK溶液代替HCOOH催化释氢的效果更佳,其具体优点是________________________。
21.以铁、硫酸、柠檬酸、双氧水、氨水等为原料可制备柠檬酸铁铵[(NH4)3Fe(C6H5O7)2]。
(1)Fe基态核外电子排布式为______________________________;[Fe(H2O)6]2+中与Fe2+配位的原子是___________________(填元素符号)。
(2)NH3分子中氮原子的轨道杂化类型是_____________;C、N、O元素的第一电离能由大到小的顺序为__________________________。
(3)与NH4+互为等电子体的一种分子为________(填化学式)。
(4)柠檬酸的结构简式为。1mol柠檬酸分子中碳原子与氧原子形成的σ键的数目为______________mol。
22.羟基乙酸钠易溶于热水,微溶于冷水,不溶于醇、醚等有机溶剂。制备少量羟基乙酸钠的反应为CICH2COOH+2NaOH→HOCH2COONa+NaCI+H2OΔH<0
实验步骤如下:
步骤1:在下图所示装置的反应瓶中,加入40g氯乙酸、50mL水,搅拌。逐步加入40%NaOH溶液,在95∘C继续搅拌反应2小时,反应过程中控制pH约为9。
9 / 9
步骤2:蒸出部分水至液面有薄膜,加少量热水,趁热过滤。滤液冷却至15∘C,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,分离掉活性炭。
步骤4:将去除活性炭后的溶液加到适量乙醇中,冷却至15∘C以下,结晶、过滤、干燥,得羟基乙酸钠。
(1)步骤1中,如图所示的装置中仪器A的名称是____________;逐步加入NaOH溶液的目的是________________________。
(2)步骤2中,蒸馏烧瓶中加入沸石或碎瓷片的目的是_____________。
(3)步骤3中,粗产品溶解于过量水会导致产率_________(填“增大”或“减小”);去除活性炭的操作名称是_____________。
(4)步骤4中,将去除活性炭后的溶液加到适量乙醇中的目的是____________________________________。
9 / 9
参考答案与试题解析
2020年全国统一高考化学试卷(江苏卷)
一、选择题
1.B 2.C 3.D 4.A 5.D 6.B 7.C 8.B
9.A 10.C 11.C 12.C,D 13.B 14.A,D 15.B,D
二、解答题
16.(1)2NH3+H2O+SO2=2NH4++SO32-或2NH3⋅H2O+SO2=2NH4++SO32-+H2O,HSO3-
(2)ZnSO3,ZnSO3+SO2+H2O=Zn2++2HSO3-或ZnO+2SO2+H2O=Zn2++2HSO3-
(3)随着pH降低,HSO3-浓度增大,减小
17.(1)醛基,羟基
(2)
(3)取代反应
(4)
(5)
18.(1)Cl2+2OH-=ClO-+Cl-+H2O,NaClO溶液吸收空气中的CO2后产生HClO,HClO见光分解
(2)①n(S2O32-)=0.1000mol×L-1×0.02000L=2.000×10-3mol
根据物质转换和电子得失守恒关系:C3N3O3CI2-∼2HCIO∼2I2∼4S2O32-
得n(Cl)=0.5n(S2O32-)=1.000×10-3mol
氯元素的质量:
m(Cl)=1.000×10-3mol×35.5g⋅mol-1=0.03550g
该样品的有效氯为:0.03550g1.1200g×25.0mL250.0mL×2×100%=63.39%
该样品的有效氯大于60%,故该样品为优质品,②偏低
19.A,B
(2)H2,取少量清液于试管中,向其中滴加几滴KSCN溶液,若溶液不变为血红色,说明Fe3+已被还原完全,否则未被还原完全
(3)pH偏低形成HF,导致溶液中F-浓度减小,CaF2沉淀不完全
(4)①Fe2++HCO3-+NH3⋅H2O=FeCO3↓+NH4++H2O或Fe2++HCO3-+NH3=FeCO3↓+NH4+,②在搅拌下向FeSO4溶液中缓慢加入氨水-NH4HCO3混合溶液,控制溶液的pH不大于6.5;静置后过滤,所得沉淀用蒸馏水洗涤2-3次;取最后一次洗涤后的滤液,滴加盐酸酸化的BaCl2溶液,不出现白色沉淀
20.(1)HCO3-+H2=====催化剂HCOO-+H2O,温度升高反应速率增大,温度升高催化剂的活性增强
(2)①HCOO-+2OH--2e-=HCO3-+H2O,H2SO4,②2HCOOH+2OH-+O2=2HCO3-+2H2O
9 / 9
(3)①HD,②提高释放氢气的速率,提高释放出氢气的纯度
21.(1)1s22s22p63s23p63d64s2或[Ar]3d64s2,O
(2)sp3,N>O>C
(3)CH4或SiH4
(4)7
22.(1)(回流)冷凝管,防止升温过快、控制反应体系pH
(2)防止暴沸
(3)减小,趁热过滤
(4)提高羟基乙酸钠的析出量(产率)
9 / 9
相关文档
- 高中化学 第三章第三节 羧酸 酯(2)2021-07-063页
- 高中化学第五章化工生产中的重要非2021-07-0643页
- 2020-2021全国高考化学化学键的综2021-07-0620页
- 2020届高考化学一轮复习常见的有机2021-07-0610页
- 2020版高中化学 第二章第3节 氧化2021-07-067页
- 高考化学第一轮复习课件第1讲 重2021-07-067页
- 2020高中化学 专题 硫及其化合物综2021-07-063页
- 全国版2021高考化学一轮复习第22讲2021-07-0652页
- 2020届高考化学一轮复习(山西专用版2021-07-068页
- 2020高中化学 第一章 从实验学化学2021-07-064页