- 610.57 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
座位号
上饶市2019—2020学年度第二学期期末教学质量测试
高一化学试题卷
考试时间:90分钟 分值:100分 命题人:
可能用到的相对原子质量:H-1 C-12 O-16 Fe-56 Cu-64 Pb-207
一、选择题(每小题只有一个正确选项,每小题3分,共48分)
1.抗击新冠肺炎疫情以来,“一次性口罩”成为人们防护的必需品,用于生产下列这款口罩的材料中不属于有机物的是( )
A. 耳带:聚四氢呋喃 B.外层防菌过滤层:聚酯纤维
C.防水透气膜:聚丙烯 D.鼻梁条:镀锌细钢丝
2.下列关于碱金属元素和卤素的说法中,错误的是( )
A.钾与水的反应比钠与水的反应更剧烈
B.随核电荷数的增加,卤素单质的颜色逐渐加深
C.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
D.碱金属元素中,锂原子失去最外层电子的能力最强
3.下列设备工作时,将化学能转化为电能的是( )
A.硅太阳能电池 B.锂离子电池
C.太阳能集热器 D.燃气灶
4.含氯消毒剂是新冠肺炎疫情期间防疫的一种重要消毒剂,下列说法正确的是( )
A.用电子式表示HCl的形成过程 B.次氯酸的结构式 H-O-Cl
C.氯离子含有18NA电子 D.Cl这种核素的原子中有17个中子
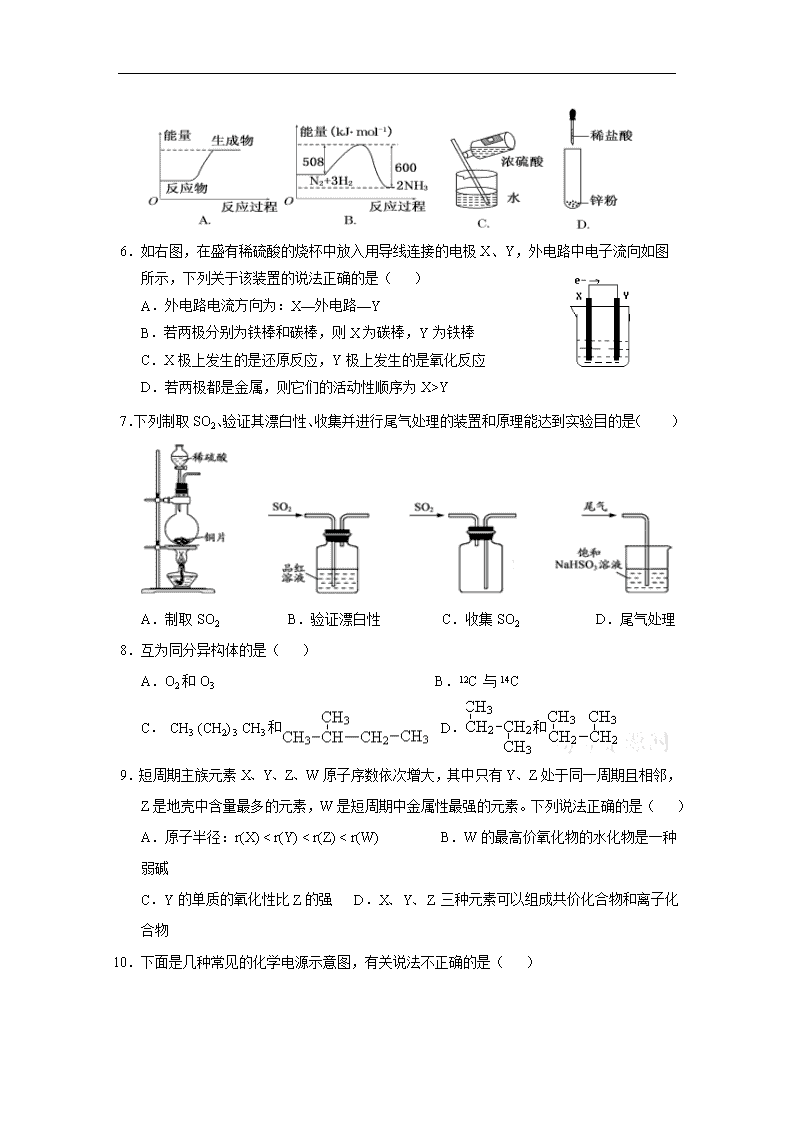
5.下列图示变化为吸热反应的是( )
6.如右图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是( )
A.外电路电流方向为:X—外电路—Y
B.若两极分别为铁棒和碳棒,则X为碳棒,Y为铁棒
C.X极上发生的是还原反应,Y极上发生的是氧化反应
D.若两极都是金属,则它们的活动性顺序为X>Y
7.下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是( )
A.制取SO2 B.验证漂白性 C.收集SO2 D.尾气处理
8.互为同分异构体的是( )
A.O2和O3 B.12C 与14C
C. CH3 (CH2) 3 CH3和 D.和
9.短周期主族元素X、Y、Z、W原子序数依次增大,其中只有Y、Z处于同一周期且相邻,Z是地壳中含量最多的元素,W是短周期中金属性最强的元素。下列说法正确的是( )
A.原子半径:r(X) < r(Y) < r(Z) < r(W) B.W的最高价氧化物的水化物是一种弱碱
C.Y的单质的氧化性比Z的强 D.X、Y、Z 三种元素可以组成共价化合物和离子化合物
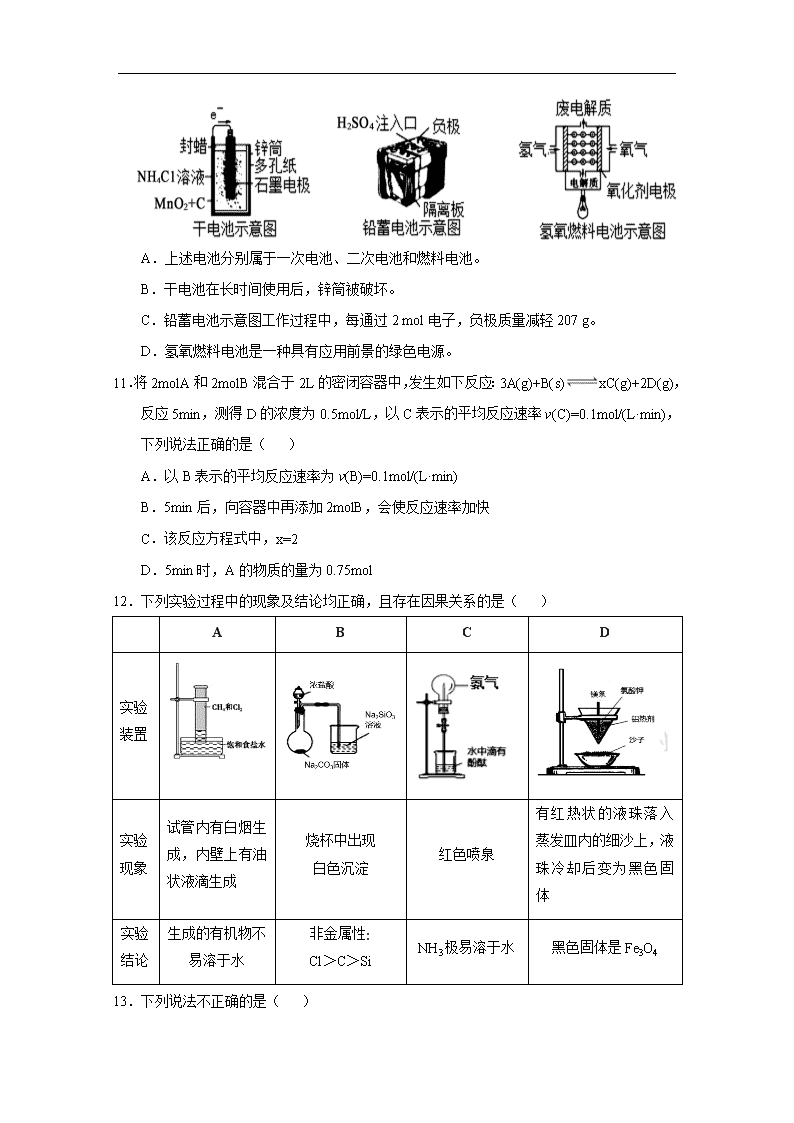
10.下面是几种常见的化学电源示意图,有关说法不正确的是( )
A.上述电池分别属于一次电池、二次电池和燃料电池。
B.干电池在长时间使用后,锌筒被破坏。
C.铅蓄电池示意图工作过程中,每通过2 mol电子,负极质量减轻207 g。
D.氢氧燃料电池是一种具有应用前景的绿色电源。
11.将2molA和2molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(s)xC(g)+2D(g),反应5min,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是( )
A.以B表示的平均反应速率为v(B)=0.1mol/(L·min)
B.5min后,向容器中再添加2molB,会使反应速率加快
C.该反应方程式中,x=2
D.5min时,A的物质的量为0.75mol
12.下列实验过程中的现象及结论均正确,且存在因果关系的是( )
A
B
C
D
实验装置
实验现象
试管内有白烟生成,内壁上有油状液滴生成
烧杯中出现
白色沉淀
红色喷泉
有红热状的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
实验结论
生成的有机物不易溶于水
非金属性:
Cl>C>Si
NH3极易溶于水
黑色固体是Fe3O4
13.下列说法不正确的是( )
A.由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
B.HF的沸点在同族元素的氢化物中出现反常,是因为HF分子间存在氢键
C.F2、Cl2、Br2、I2熔沸点逐渐升高,因为它们的组成结构相似,分子间的范德华力增大
D.碳酸氢铵固体受热分解破坏了离子键、共价键
14.铜与一定量浓硝酸反应,得到硝酸铜溶液和22.4L(标准状况)NO2、N2O4、NO的混合气体,这些气体与16.8L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则消耗铜的质量为( )
A.96 g B.64g C.48g D.32g
15.W、X、Y、Z是同周期主族元素,Y的最外层电子数是X次外层电子数的3倍,四种元素组成的盐是一种新型的锂离子电池电解质(结构如图,箭头指向表示共同电子对由W提供)。下列说法不正确的是( )
A.W的非金属性比Y的强
B.在该物质中X原子满足8电子稳定结构
C.该物质中含有离子键和共价键
D.Z的氧化物都易溶于水
16.最新报道:科学家首次用 X射线激光技术观察到 CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应 B.CO和O生成了具有极性共价键的CO2
C.在该过程中,CO断键形成C和O D.状态Ⅰ→状态Ⅲ表示 CO与 O2反应的过程
二、填空题(共5小题,每空2分,共52分 )
17.(12分)随着原子序数的递増,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如下图所示。请根据判断出的元素回答下列问题
(1)e在元素周期表中的位置是 。
(2)比较d、f常见离子的半径大小: (用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱: 。
(3)写出x与z形成的常见四原子共价化合物的电子式 。
(4)物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且x元素与y元素的质量比为1:12,A的相对分子质量为78,A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为 。
(5)写出f元素的单质和e元素最高价氧化物对应的水化物之间发生的离子反应方程式
。
18.(10分)化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min
1
2
3
4
5
氢气体积/mL(标准状况)
100
240
464
576
620
①2~3min时间段反应速率最大,原因是 。
②求3~4min时间段以盐酸的浓度变化来表示的该反应速率 (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是 (填字母)。
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.Na2SO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
①该反应的化学方程式是 。
②该反应达到平衡状态的标志是 (填字母)。
A.Y的体积分数在混合气体中保持不变 B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变 D.容器内气体的总质量保持不变
E.生成1molY的同时消耗2molZ
19.(10分)燃料电池是一种具有应用前景的绿色电源。下图为燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。请回答下列问题:
(1)若该燃料电池为氢氧燃料电池。
①a极通入的物质为 ,电解质溶液中的OH-移向 极(填“负”或“正”)。
②写出此氢氧燃料电池工作时,负极的电极反应式: 。
(2)若该燃料电池为甲烷燃料电池。已知电池的总反应为CH4+2O2+2OH-===CO+3H2O
①下列有关说法正确的是___________(填字母代号)。
A. 燃料电池将电能转变为化学能
B.负极的电极反应式为CH4+10OH-– 8e-===CO+7H2O
C.正极的电极反应式为O2+4H++4e-===2H2O
D.通入甲烷的电极发生还原反应
②当消耗甲烷11.2L(标准状况下)时,假设电池的能量转化效率为80%,则导线中转移的电子的物质的量为__________mol.
20.(10分)某中药主要含二硫化亚铁(FeS2),某学习小组欲用下图所示装置进行实验,测定其铁、硫元素的质量分数。
(1)装置中,A为高温灼烧装置
,B为气体吸收装置,C为检测尾气中是否含有SO2的传感器。取mg该中药样品于装置A中,经充分反应,使硫元素全部转化为SO2和SO3,在B中得到白色沉淀,传感器(装置C)未检测到SO2。
①装置B中的H2O2反应时表现出了 性。
②欲计算硫元素的质量分数,需测量的数据是B中沉淀的质量。B中得到白色沉淀化学式为 。
(2)为测定铁元素的质量分数,继续实验。
a.将A装置中的剩余固体用足量盐酸酸浸,有少量H2产生。充分反应后过滤,得到黄色滤液;
b.向滤液中滴加Na2SO3溶液,至恰好完全反应,SO被氧化为SO;
c.用滴定法测定Fe2+的量,消耗20 mL 0.1 mol/LK2Cr2O7溶液。
① a中滤液显黄色的阳离子是 。
② b中反应的离子方程式是 。
③已知:c中发生反应:6Fe2++Cr2O72-+14H+===6Fe3++2Cr3++7H2O,则样品中铁元素质量分数的数学表达式是 。
21.(10分)海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图。
(1)步骤①中除去粗盐中杂质(Mg2+、SO、Ca2+),加入的药品顺序正确的是__________。
A.NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸
C.NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤后加盐酸
D.BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤后加盐酸
(2)步骤⑤中已获得Br2,步骤⑥中又用SO2的水溶液将Br2
吸收,其目的是______________
_____________________________。
(3)写出步骤⑥中发生反应的离子方程式:___________________________。
(4)把溴吹入到SO2的水溶液的气体X最可能用下面的_________(填序号)。
A.乙烯 B.空气 C.氩气 D.CO2
(5)由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性强弱的顺序是_________________
_______________________________。
上饶市2019—2020学年度第二学期期末教学质量测试
高一化学参考答案
一、选择题(每小题只有一个正确选项,每小题3分,共48分)
1-5 DDBBA 6-10 DBCDC 11-16 CCAADB
二、填空题( 共5小题,每空2分,共52分 )
17.(12分)(1)第三周期第ⅠA族 (2)O2->Al3+ HClO4>H2SO4 (3)
(4) (写浓硫酸和加热也得分)
(5)2Al+2H2O+2OH-===2AlO2-+3H2↑
18. (10分)
(1) ①因该反应是放热反应,此时温度高且盐酸浓度较大,所以反应速率较快 ②0.025mol·L-1·min-1 (2)C
(3)①3X(g)+Y(g)2Z(g) ② AC
19.(10分)
(1)①氢气 (或H2) 负 ② H2 + 2OH-–2e-=== 2H2O
(2)B 3.2
20.(10分)
(1)① 氧化性 ② BaSO4
(2)① Fe3+ ② 2Fe3+ + SO + H2O==2Fe2++SO +2H+ ③ % (或 ×100%)
21.(10分)(1)B、C、D (未答全只得1分)
(2) 提高溴的富集程度
(3) Br2+SO2+2H2O===4H++2Br-+SO
(4) B
(5) SO2 >Br-> Cl-
相关文档
- 2017-2018学年江西省上饶市横峰中2021-07-069页
- 2017-2018学年江西省上饶市广丰一2021-07-067页
- 江西省上饶市上饶中学2019-2020学2021-07-0618页
- 【化学】江西省上饶市横峰中学20202021-07-0621页
- 2018-2019学年江西省上饶市玉山县2021-07-066页
- 2018-2019学年江西省上饶市玉山县2021-07-066页
- 化学卷·2018届江西省上饶市四校高2021-07-0515页
- 2018-2019学年江西省上饶市玉山县2021-07-057页
- 江西省上饶市上饶中学2019-2020学2021-07-0520页
- 2018-2019学年江西省上饶市民校考2021-07-058页