- 136.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
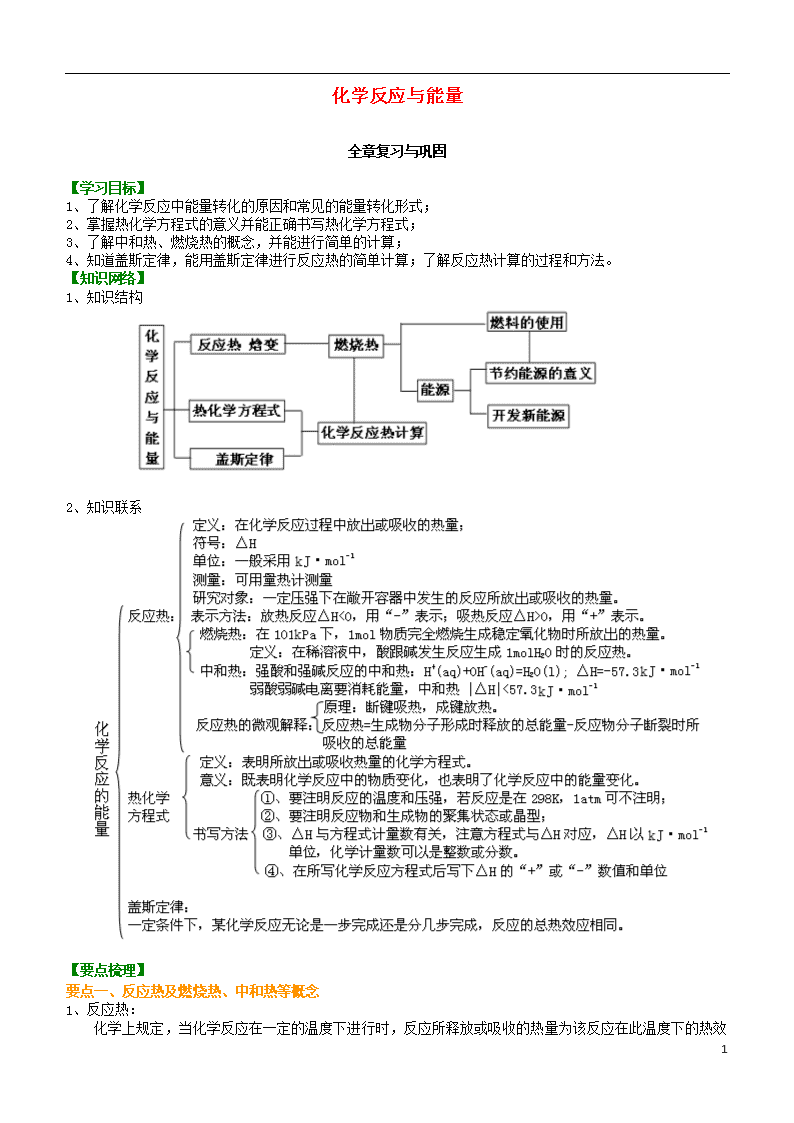
化学反应与能量
全章复习与巩固
【学习目标】
1、了解化学反应中能量转化的原因和常见的能量转化形式;
2、掌握热化学方程式的意义并能正确书写热化学方程式;
3、了解中和热、燃烧热的概念,并能进行简单的计算;
4、知道盖斯定律,能用盖斯定律进行反应热的简单计算;了解反应热计算的过程和方法。
【知识网络】
1、知识结构
2、知识联系
【要点梳理】
要点一、反应热及燃烧热、中和热等概念
1、反应热:
化学上规定,当化学反应在一定的温度
6
下进行时,反应所释放或吸收的热量为该反应在此温度下的热效应。
2、燃烧热
(1)概念:在101kPa时,1mol物质燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。燃烧热的单位一般用kJ/mol表示。
(2)表示的意义:例如C的燃烧热为393.5kJ/mol,表示在101kPa时,1molC完全燃烧放出393.5kJ的热量。
要点诠释:① 规定是在101 kPa压强下测出热量。书中提供的燃烧热数据都是在101kPa下测定出来的。因为压强不同,反应热有所不同。
② 规定可燃物的物质的量为1mol(这样才有可比性)。因此,表示可燃物的燃烧热的热化学方程式中,可燃物的化学计量数为1,其他物质的化学计量数常出现分数。例如,C8H18的燃烧热为5518kJ/mol,用热化学方程式表示则为
C8H18(l)+O2(g)= 8CO2(g)+9H2O(l) △H=-5518kJ/mol
③ 规定生成物为稳定的氧化物.例如C→ CO2、H →H2O(l)、S →SO2等。
C(s)+O2(g)=CO(g) △H=-110.5kJ/mol
C(s)+O2(g)=CO2(g) △H=-393.5kJ/mol
C的燃烧热为393.5kJ/mol而不是110.5kJ/mol。
④ 叙述燃烧热时,用正值,在热化学方程式中用△H表示时取负值。
例如,CH4的燃烧热为890.3kJ/mol,而△H=-890.3kJ/mol。必须以1mol可燃物燃烧为标准。
3、中和热
(1)概念:在稀溶液中,酸跟碱发生中和反应而生成1mol H2O,这时的反应热叫中和热。
(2)中和热的表示:H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol。
要点诠释:① 这里的稀溶液一般要求酸溶液中的c(H+)≤1mol/L,碱溶液中的c(OH-)≤1mol/L。这是因浓酸溶液和浓碱溶液相互稀释时会放出热量。
②强酸与强碱的中和反应其实质是H+和OH-反应(即与酸、碱的种类无关),通过许多次实验测定,1molH+和1molOH-反应生成1molH2O时,放出热量57.3kJ。其热化学方程式为
H+(aq)+OH-(aq)=H2O(l) △H=-57.3kJ/mol
因此,所有中和反应的△H都相同,都为-57.3kJ/mol。
③ 中和热是以生成1molH2O为基准,因为表示中和热的热化学方程式中,水的化学计量数为1,其酸、碱或盐的化学计量数可以为分数;中和反应对象为稀溶液;强酸与强碱中和时生成1mol H2O均放热57.3kJ,弱酸或弱碱电离要吸收热量,所以它们参加中和反应时的中和热小于57.3kJ/mol。
4、中和热的测定
(1)主要仪器:大烧杯(500mL)、温度计、量筒(50mL)两个、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个小孔)、环形玻璃搅拌棒。
(2)实验步骤:
①组装仪器如图6-1所示。
②分别量取50mL 0.50 mol/L的盐酸和50mL
0.55mol/L NaOH溶液,记录起始温度t1。
③混合反应并准确量取混合液最高温度,记录终止温度t2。
④重复实验二次,取平均值。
⑤计算△H=
(3)可能的误差
①未及时测出最高温度——其值偏小
②使用一个量筒且未洗干净——其值偏小
③烧杯过大——其值偏小
要点二、化学反应的焓变
6
1、焓的定义
物质所具有的能量是性质,符号为H。用焓变(△H)来描述与反应热有关的能量变化。
△H=H(生成物)-H(反应物)
△H为生成物的总焓与反应物的总焓之差,称为化学反应的焓变。
注意:△H >0,表示吸热;△H <0,表示放热;单位:J/mol或kJ/mol
2、反应热与焓变的关系
热化学研究表明,对于等压条件下进行的化学反应,如果反应中物质的能量变化只转化成热能,而没有转化为电能、光能等其他形式的能,则该反应的反应热就等于反应前后物质的焓的改变。数学表达式:QP=∆H,其中:QP表示在压强不变的条件下化学反应的反应热。
要点三、热化学方程式及其书写
1、概念:能表示参加反应物质的量和反应热之间的关系的化学方程式。
2、意义:既表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
要点诠释:(1).热化学方程式必须标出能量变化。
(2).热化学方程式中必须标明反应物和生成物的聚集状态,因为反应热除跟物质的量有关外,还与反应物和生成物的聚集状态有关。
(3).热化学方程式中各物质的化学计量数只表示物质的量,因此可以用分数,但要注意反应热也发生相应变化。
3、书写注意事项:
(1)要注明反应物和生成物的聚集状态(若为同素异形体,要注明名称),因为物质呈现哪一种聚集状态,与它们所具有的能量有关,即反应物的物质相同,状态不同,△H也不同。
(2)要注明反应温度和压强。因为△H的大小和反应的温度、压强有关,如不注明,即表示在101kPa和25°C。
(3)热化学方程式中的化学计量数不表示分子个数,而是表示物质的量,故化学计量数可以是整数,也可以是分数。相同物质的化学反应,当化学计量数改变时,其△H也同等倍数的改变。
(4)△H的表示:在热化学方程式中△H的“+”“-”一定要注明,“+”代表吸热,“-”代表放热。△H的单位是:kJ/mol或J/mol。
要点四、焓变的计算――盖斯定律及其应用
1、盖斯定律的涵义:化学反应不管是一步完成还是几步完成,其反应热是相同的,也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体的反应进行的途径无关。如果一个反应可以分几步进行,则各分步反应的反应热和该反应一步完成的反应热相同,这就是盖斯定律。
2、盖斯定律的应用:盖斯定律在科学研究中具有重要意义。因为有些反应进行的很慢,有些反应不容易直接发生,有些反应的产品不纯(有副反应发生),这给测定反应热造成了困难。此时如果应用盖斯定律,就可以间接的把它们的反应热计算出来。
3、反应热计算
根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:
(1)热化学方程式中化学计量数之比等于各物质的物质的量之比,还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。当两个热化学方程式相加(减)时,反应热同时相加(减),得到一个新的热化学方程式。
【典型例题】
类型一、热化学基本概念
例1 下列物质加入水中,显著地放热的是
A. 固体NaOH B. 生石灰
C. 尿素颗粒 D. 固体NH4NO3
6
【答案】AB
【解析】解此题的关键是看清放热两字,注意此题所研究的不一定是放热的化学反应,放热过程也可。
举一反三:
【变式1】“碘受热升华,破坏的是分子间作用力,未破坏I-I共价键,因此未发生吸热反应”的说法是否正确?
【答案】化学上把有热量放出的化学反应叫做放热反应,把吸收热量的化学反应叫做吸热反应。而碘升华属物理变化未发生化学反应,因此上述说法正确。
【变式2】下列说法正确的是
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热;
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热;
C. 燃烧热或中和热是反应热的种类之一;
D. 在稀溶液中,1mol CH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ。
【答案】C
【解析】本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题。
类型二、热化学方程式
例2 在一定的条件下,当64g SO2气体被氧化成SO3气体时,共放出热量98.3kJ。据此,下列热化学方程式正确的是
A.
B.
C.
D.
【思路点拨】本题考查热化学方程式的书写,注意题目中给出的量出放出热量的对应关系。
【答案】C
【解析】此题旨在考查△H与物质的量的关系,及书写热化学反应方程式的注意事项。1mol SO2完全氧化为SO3气体时放出热量为98.3kJ/mol,即△H为负值。
【总结升华】热化学方程式的正确书写是学好热化学版块的基本功。书写时注意物质的状态、化学计量数、反应热数值的关系,并且要求准确理解热化学方程式的含义。
举一反三:
【变式1】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。
已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g) △H1=+81.5kJ·mol-1
Al(OH)3(s)=Al2O3(s)+H2O(g) △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_____________
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是____________,原因是_____________。
③常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是______(填代号),理由是_____________。
【解析】①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。
②Mg(OH)2 Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1;Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1 等质量的Mg(OH)2比Al(OH)3吸热多。
③C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。
6
【总结升华】热化学方程式的书写常见错误
①未标明物质的聚集状态
②没有配平
③反应热计算错误
④反应热的值与方程式中的化学计量数不匹配
⑤反应热没有单位
⑥反应热没有带上“+”号或“—”号。
类型三、反应热的有关计算
例3 下列各组热化学方程式中,化学反应的△H前者大于后者的是
①C(s)+O2(g)=CO2(g) △H1 C(s)+1/2O2(g)=CO(g) △H2
②S(s)+O2(g)=SO2(g) △H3 S(g)+O2(g)=SO2(g) △H4
③H2(s)+1/2O2(g)=H2O(g) △H5 2H2(g)+O2(g)=2H2O(l) △H6
④CaCO3(s)=CaO(s)+CO2(g) △H7 CaO(s)+H2O(l)=Ca(OH)2(s) △H8
A ① B ④ C ②③④ D ①②③
【思路点拨】本题考查化学反应的焓变,解题时注意物质的状态、化学计量数的差别,以及由此引起的焓变差值。
【答案】C
【解析】放热反应△H<0,吸热反应△H>0。①两反应均为放热反应,CO转化成CO2放热,△H1<△H2,②两反应均为放热反应,同一物质的能量高低为:E(s)<E(l)<E(g), S(s) 转化成 S(g)吸热,△H3 > △H4, ③两反应均为放热反应,相同物质的反应,当化学计量数不同时,其△H值不同,△H5>△H6 ,④前为吸热反应后为放热反应,△H7>△H8。
【总结升华】常见的吸热反应:(1)电离过程;(2)水解反应;(3)大多数的分解反应;(4)特例:二氧化碳与碳生成一氧化碳;氢气与碘蒸气生成碘化氢;氮气与氧气生成一氧化氮;碳与水蒸气生成一氧化碳和氢气。
举一反三:
【变式1】在同温同压下,下列各组热化学方程式中,热效应ΔH1>ΔH2的是( )
A.2H2(g)+O2(g)=2H2O(g) ΔH1 2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(g)+O2(g)=SO2(g) ΔH1 S(s)+O2(g)=SO2(g) ΔH2
C.C(s)+ O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Br2(g)=2HBr(g) ΔH1 H2(g)+ Br2(l)=2HBr(g) ΔH2
【答案】AC
【解析】通过盖斯定律将两个的热化学方程式联系在一起做差值计算,根据ΔH1-ΔH2不等式结果来比较ΔH1、ΔH2的大小关系。
【变式2】已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) △H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
A. +519.4kJ·mol-1 B. +259.7kJ·mol-1
C. -259.7kJ·mol-1 D. -519.4kJ·mol-1
【答案】C
【解析】命题立意:考查盖斯定律。反应的焓值由盖斯定律直接求出。即(△H1-△H2)/2=-259.7 kJ·mol-1。注意本题中两负数相减易出错,此外系数除以2时,焓值也要除以2
【变式3】根据热化学方程式(在101kPa时):,分析下列说法中不正确的是( )。
A. S的燃烧热为297.23kJ/mol
B. 放出热量大于297.23kJ
C. 放出热量小于297.23kJ
D. 形成1mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量
【答案】C
6
【解析】根据题给燃烧热的热化学方程式可知A、D正确。若想确定B与C,需将题设热化学方程式拆分为:
,即放出热量的数值小于297.23kJ。
6
相关文档
- 2018届高考二轮复习人教版专题六化2021-07-0657页
- 2019年高考化学二轮复习化学反应与2021-07-0632页
- 2020届高考化学二轮复习化学反应与2021-07-0634页
- 高中化学第一章化学反应与能量3化2021-07-064页
- 高中化学第六章化学反应与能量测评2021-07-0610页
- 2节化学反应与能量转化第2课时化学2021-07-067页
- 2020_2021学年新教材高中化学第1章2021-07-0656页
- 第二章化学键化学反应规律第二节化2021-07-065页
- 2019届一轮复习人教版第17讲化学反2021-07-0621页
- 2018届二轮复习化学反应与能量变化2021-07-0632页