- 390.00 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
非选择必考题标准练(三)
满分:58分
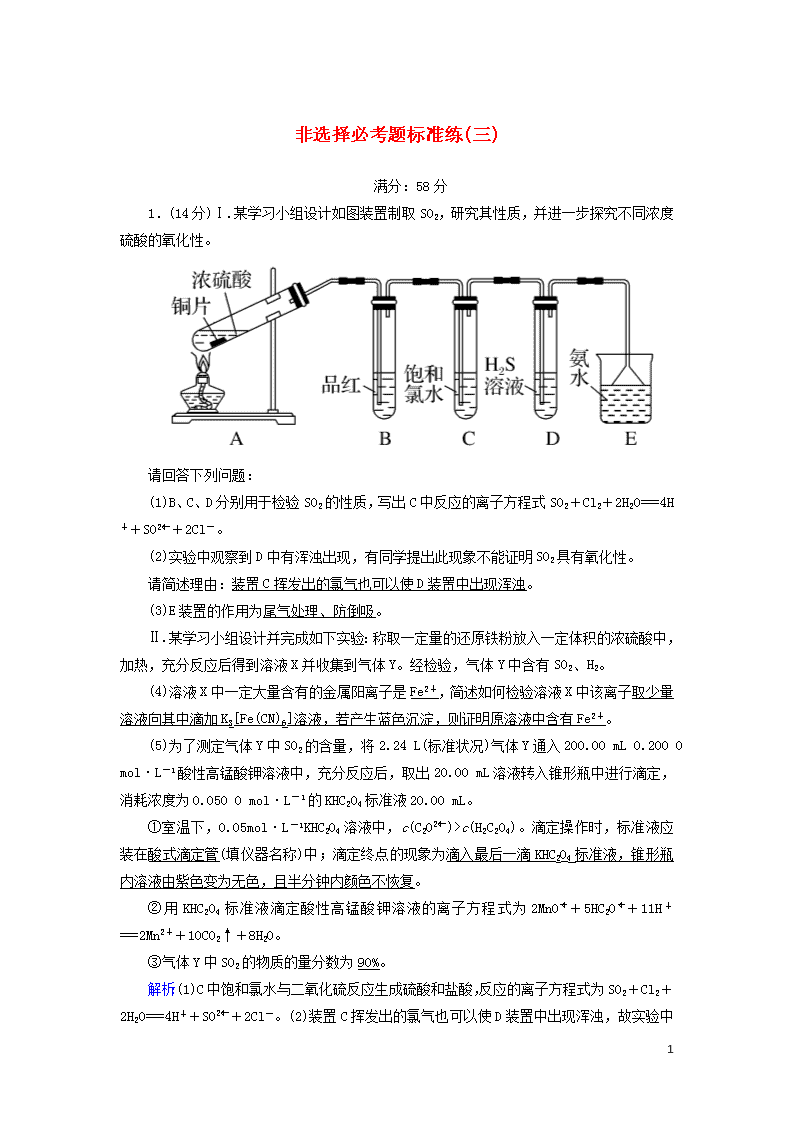
1.(14分)Ⅰ.某学习小组设计如图装置制取SO2,研究其性质,并进一步探究不同浓度硫酸的氧化性。
请回答下列问题:
(1)B、C、D分别用于检验SO2的性质,写出C中反应的离子方程式SO2+Cl2+2H2O===4H++SO+2Cl-。
(2)实验中观察到D中有浑浊出现,有同学提出此现象不能证明SO2具有氧化性。
请简述理由:装置C挥发出的氯气也可以使D装置中出现浑浊。
(3)E装置的作用为尾气处理、防倒吸。
Ⅱ.某学习小组设计并完成如下实验:称取一定量的还原铁粉放入一定体积的浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。经检验,气体Y中含有SO2、H2。
(4)溶液X中一定大量含有的金属阳离子是Fe2+,简述如何检验溶液X中该离子取少量溶液向其中滴加K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明原溶液中含有Fe2+。
(5)为了测定气体Y中SO2的含量,将2.24 L(标准状况)气体Y通入200.00 mL 0.200 0 mol·L-1酸性高锰酸钾溶液中,充分反应后,取出20.00 mL溶液转入锥形瓶中进行滴定,消耗浓度为0.050 0 mol·L-1的KHC2O4标准液20.00 mL。
①室温下,0.05mol·L-1KHC2O4溶液中,c(C2O)>c(H2C2O4)。滴定操作时,标准液应装在酸式滴定管(填仪器名称)中;滴定终点的现象为滴入最后一滴KHC2O4标准液,锥形瓶内溶液由紫色变为无色,且半分钟内颜色不恢复。
②用KHC2O4标准液滴定酸性高锰酸钾溶液的离子方程式为2MnO+5HC2O+11H+===2Mn2++10CO2↑+8H2O。
③气体Y中SO2的物质的量分数为90%。
解析:(1)C中饱和氯水与二氧化硫反应生成硫酸和盐酸,反应的离子方程式为SO2+Cl2+2H2O===4H++SO+2Cl-
8
。(2)装置C挥发出的氯气也可以使D装置中出现浑浊,故实验中观察到D中有浑浊出现,不能证明SO2具有氧化性。(3)二氧化硫是污染气体,不能直接排放到空气中,利用氨水吸收,E装置的作用为尾气处理、防倒吸。(4)随着反应的进行,硫酸浓度降低,产生的气体含有氢气,则一定发生铁与稀硫酸反应生成硫酸亚铁和氢气的反应,铁也可与溶液中的Fe3+反应生成Fe2+,故溶液X中一定大量含有的金属阳离子是Fe2+,检验溶液X中Fe2+的方法是取少量溶液向其中滴加K3[Fe(CN)6]溶液,若产生蓝色沉淀,则证明原溶液中含有Fe2+。(5)①标准溶液KHC2O4溶液中,c(C2O)>c(H2C2O4),说明HC2O的电离程度大于其水解程度,则溶液呈酸性。滴定操作时,标准液应装在酸式滴定管中;滴定终点的现象为滴入最后一滴KHC2O4标准液,锥形瓶内溶液由紫色变为无色,且半分钟内不恢复原来颜色。②KHC2O4与酸性高锰酸钾反应的离子方程式为2MnO+5HC2O+11H+===2Mn2++10CO2↑+8H2O。③根据反应2MnO+5SO2+2H2O===2Mn2++5SO+4H+、2MnO+5HC2O+11H+===2Mn2++10CO2↑+8H2O可知,二氧化硫消耗的高锰酸钾的物质的量为0.2 L×0.200 0 mol·L-1-×10×0.050 0 mol·L-1×0.02 L=0.036 mol;气体Y中SO2的物质的量分数为×100%=90%。
2.(14分)纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。
(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为CuFeS2+Cu+2H+===Cu2S+Fe2++H2S↑。
(2)从辉铜矿中浸取铜元素时,可用FeCl3溶液作浸取剂。
8
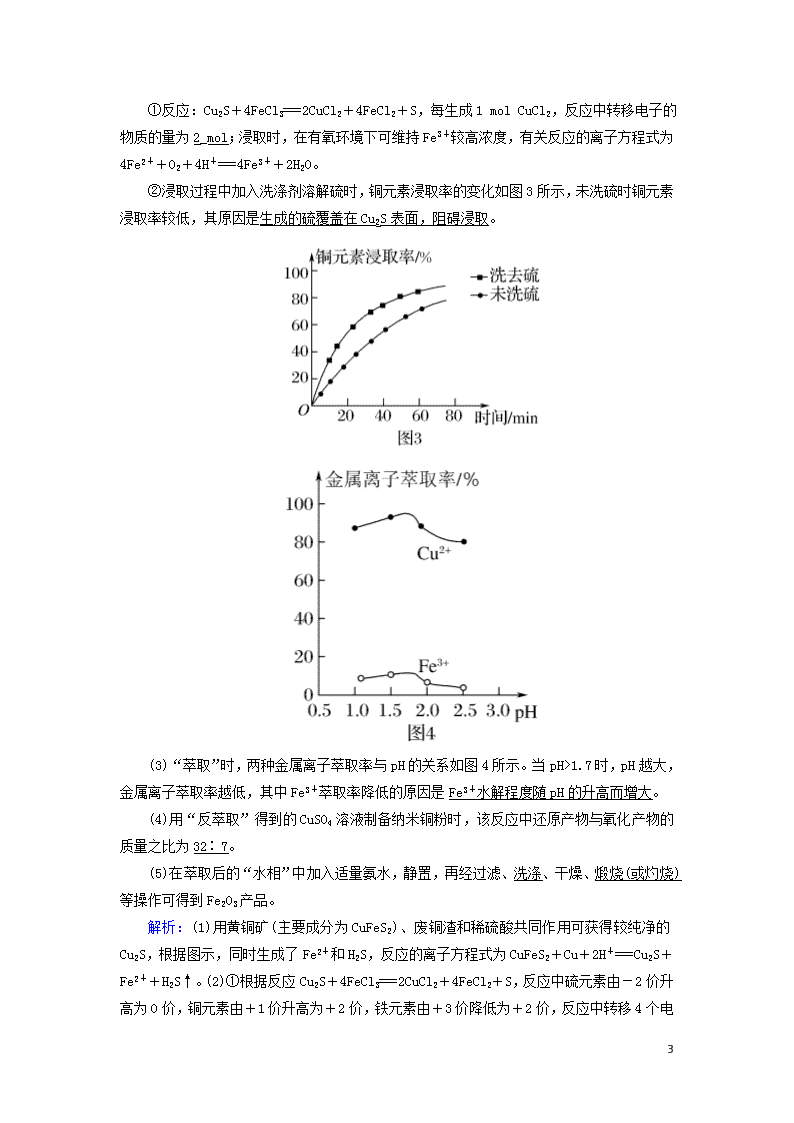
①反应:Cu2S+4FeCl3===2CuCl2+4FeCl2+S,每生成1 mol CuCl2,反应中转移电子的物质的量为2_mol;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O。
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是生成的硫覆盖在Cu2S表面,阻碍浸取。
(3)“萃取”时,两种金属离子萃取率与pH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是Fe3+水解程度随pH的升高而增大。
(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为32∶7。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、洗涤、干燥、煅烧(或灼烧)等操作可得到Fe2O3产品。
解析:(1)用黄铜矿(主要成分为CuFeS2)、废铜渣和稀硫酸共同作用可获得较纯净的Cu2S,根据图示,同时生成了Fe2+和H2S,反应的离子方程式为CuFeS2+Cu+2H+===Cu2S+Fe2++H2S↑。(2)①根据反应Cu2S+4FeCl3===2CuCl2+4FeCl2
8
+S,反应中硫元素由-2价升高为0价,铜元素由+1价升高为+2价,铁元素由+3价降低为+2价,反应中转移4个电子,则每生成1 mol CuCl2,反应中转移电子2 mol。浸取时,在有氧环境下可维持Fe3+较高浓度,是因为氧气能够氧化Fe2+,反应的离子方程式为4Fe2++O2+4H+===4Fe3++2H2O。②浸取过程中加入洗涤剂溶解硫时,如果未洗硫,生成的硫覆盖在Cu2S表面,阻碍浸取,会使铜元素浸取率较低。(3)Fe3+的水解程度随着pH的升高而增大,导致溶液中Fe3+浓度降低,萃取率降低。(4)在碱性条件下,Cu2+与N2H4反应生成氮气和铜,反应的离子方程式为2Cu2++N2H4+4OH-===2Cu+N2↑+4H2O,反应中铜元素化合价降低被还原,铜为还原产物,氮元素化合价升高被氧化,氮气为氧化产物,还原产物与氧化产物的质量之比为=。(5)萃取后的“水相”中含有Fe3+,加入氨水,反应生成氢氧化铁沉淀,煅烧可得到Fe2O3,方法为在萃取后的“水相”中加入适量氨水,静置,过滤,洗涤,干燥,煅烧可得到Fe2O3产品。
3.(15分)Ⅰ.废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为S2O+2H2O+Mn2+===4H++2SO+MnO2↓。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:
实验过程中应将温度控制在80_℃(80_℃~85_℃区间均可)。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为吸附胶体粒子形成沉淀。
8
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图2所示。A包含物质的化学式为N2和H2O。
(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图3所示。
①吸收初期(图中A点以前)反应的化学方程式为2Na2CO3+SO2+H2O===2NaHCO3+Na2SO3。
②C点高于B点的原因是根据钠元素守恒,NaHSO3的物质的量是Na2CO3的2倍,所以NaHSO3的质量大,浓度就大。
Ⅱ.研究发现,NOx和SO2是雾霾的主要成分。
已知:N2(g)+O2(g)===2NO(g)
ΔH=+1 805 kJ·mol-1 ①
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ·mol-1 ②
2C(s)+O2(g)===2CO(g) ΔH=-221.0 kJ·mol-1 ③
(4)某反应的平衡常数表达式K=,请写出此反应的热化学方程式:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-2 371 kJ·mol-1。
(5)向绝热恒容密闭容器中充入等物质的量的NO和CO进行反应,能判断反应已达到化学平衡状态的是acd(填序号)。
a.容器中的压强不变
b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持不变
d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
(6)2SO3(g)2SO2(g)+O2(g),将一定量的SO3放入恒容密闭容器中,测得其平衡转化率随温度变化如图4所示。图中a点对应温度下,已知SO3的起始压强为p0
8
,该温度下反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
解析:Ⅰ.(1)①过硫酸铵与Mn2+反应生成MnO2,S2O被还原为SO,反应的离子方程式为S2O+2H2O+Mn2+===4H++2SO+MnO2↓。②图象分析可以知道80 ℃左右、Fe2+、Mn2+氧化程度已经很大,升温变化不大,实验过程中应将温度控制在80 ℃(80 ℃~85 ℃区间均可),Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为吸附胶体粒子形成沉淀。(2)图示反应可以生成A的反应为[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++A+H+,根据原子守恒判断A为N2和H2O。(3)①由图可以知道,初期反应(图中A点以前)Na2CO3浓度降低,NaHCO3浓度升高,则碳酸钠与二氧化硫反应生成碳酸氢钠与亚硫酸钠,反应的化学方程式为2Na2CO3+SO2+H2O===2NaHCO3+Na2SO3。②根据钠元素守恒,NaHSO3的物质的量是Na2CO3的2倍,所以NaHSO3的质量大,浓度就大。
Ⅱ.(4)根据平衡常数表达式K=,可知此反应的化学方程式为2NO+2CON2+2CO2,然后再根据盖斯定律:反应②×2-③-①,可得ΔH=-2 371 kJ·mol-1;所以该反应的热化学方程式为2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH=-2 371 kJ·mol-1。(5)反应2NO+2CON2+2CO2为反应前后气体的物质的量改变的反应,当容器中的压强不变时气体的物质的量不变,说明反应达到化学平衡状态,a正确。化学反应速率和化学计量数成正比,应为v正(CO)=2v逆(N2),b错误。反应前后气体的总质量不变,气体的总物质的量在发生变化,当气体的总物质的量不再发生变化,气体的平均相对分子质量为定值,反应到化学平衡状态,c正确。该反应为放热反应,当温度不再发生改变,平衡常数保持不变,达到平衡状态,d正确。NO和CO按照物质的量1∶1投料,两种物质按1∶1反应,任何时候剩余物质的量都是1∶1,无法判定反应是否达到化学平衡状态,e错误。正确选项acd。
(6)设起始SO3为a mol,根据题给信息有
2SO3(g)2SO2(g)+O2(g),
起始量 a 0 0
8
变化量 0.4a 0.4a 0.2a
平衡量 0.6a 0.4a 0.2a
反应达到平衡后,气体的压强为=,p平衡=1.2p0;SO3物质的量分数:=;SO2物质的量分数:=;O2物质的量分数:=;该温度下反应的平衡常数Kp==。
4.(15分)目前,广泛推广使用的磷酸铁锂电池的工作原理为LiFePO4+CLixC+Li1-xFePO4。
回答下列问题:
(1)LiFePO4中基态亚铁离子的价层电子排布图为。基态碳原子s能级、p能级上电子数之比为2∶1。
(2)在元素周期表中,氮元素分别与磷、氧相邻,在N、O、P中,第一电离能最大的是N(填元素符号),判断依据是N和P位于同主族,N的原子半径小于P,N的第一电离能大于P;N和O位于同周期,N原子的2p能级达到半充满的稳定状态,N的第一电离能大于O;NH3的键角略大于PH3,从原子结构角度说明原因:N的原子半径小于P,氢氮键之间排斥力大于氢磷键。
(3)卤素与磷可形成多种磷化物。例如,PCl3、PBr3等。PCl3中磷的杂化类型为sp3;PBr3的空间构型为三角锥形。与PO互为等电子体的分子有CCl4、SiCl4、CBr4、SiF4等(任写一种)(填一种即可)。
(4)电池反应中C常以足球烯(C60)的形式参与,足球烯的结构如图Ⅰ所示,1 mol足球烯含30NA个π键。
(5)锂、铁单质晶胞分别如图Ⅱ、图Ⅲ所示,铁、锂晶胞的配位数之比为3∶2
8
。图Ⅱ晶胞的堆积方式是体心立方堆积(填名称)。
(6)金刚石晶胞如图Ⅳ所示。已知金刚石的密度为ρ g·cm-3,NA代表阿伏加德罗常数的值。金刚石中C—C键的键长为××1010pm(用代数式表示)。
解析:(1)LiFePO4中含亚铁离子,Fe2+的价层电子排布式为3d6,由此可得其价层电子排布图。基态碳原子的核外电子排布式为1s22s22p2。
(2)N和P位于同主族,N的原子半径小于P,所以,N的第一电离能大于磷;N和O位于同周期,N的2p能级达到半充满的稳定状态,O的2p能级上有4个电子,所以N的第一电离能大于O,故这三种元素中N的第一电离能最大。N的原子半径小于P,NH3分子中H—N键之间的排斥力大于PH3中H—P键,所以NH3分子的键角大于PH3。
(3)PCl3分子中P原子的价层电子对数为4,其杂化类型为sp3。PBr3分子中P的价层电子对数为4,有1个孤电子对,其空间构型呈三角锥形。与PO互为等电子体的分子有CCl4、CBr4、CI4、SiF4、SiCl4、SiBr4等。(4)足球烯中每个碳原子形成两个单键、一个双键,每个键为两个碳原子共有,一个双键中含一个σ键和一个π键,则每个碳原子净摊1/2个π键,1个C60含30个π键。(5)图Ⅱ、图Ⅲ晶胞中配位数分别为8、12,配位数之比为2∶3。图Ⅱ晶胞的堆积方式为体心立方堆积。(6)设金刚石的晶胞参数为a cm,一个金刚石晶胞含8个碳原子,由ρ=得,a=2×。设碳碳键键长为R,其等于体对角线长度的1/4,则有(4R)2=3a2 cm2,R=a cm=××1010 pm。
8