- 220.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
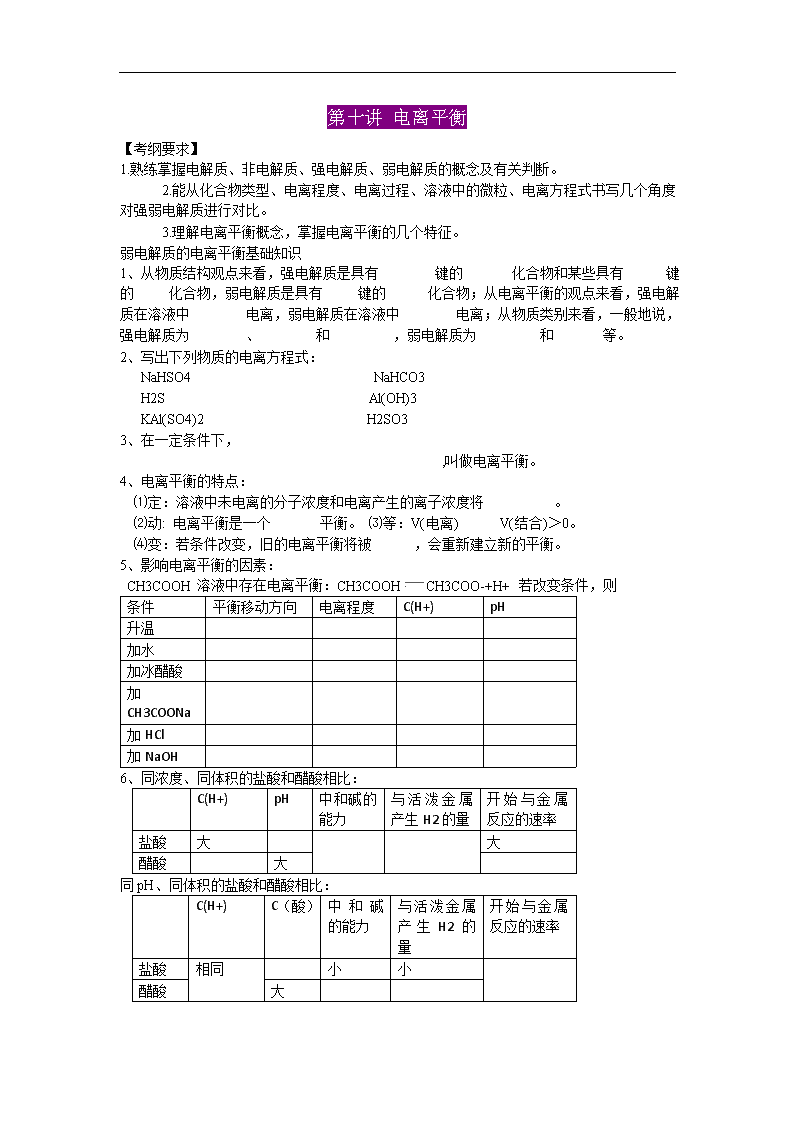
第十讲 电离平衡
【考纲要求】
1.熟练掌握电解质、非电解质、强电解质、弱电解质的概念及有关判断。
2.能从化合物类型、电离程度、电离过程、溶液中的微粒、电离方程式书写几个角度
对强弱电解质进行对比。
3.理解电离平衡概念,掌握电离平衡的几个特征。
弱电解质的电离平衡基础知识
1、从物质结构观点来看,强电解质是具有 键的 化合物和某些具有 键
的 化合物,弱电解质是具有 键的 化合物;从电离平衡的观点来看,强电解
质在溶液中 电离,弱电解质在溶液中 电离;从物质类别来看,一般地说,
强电解质为 、 和 ,弱电解质为 和 等。
2、写出下列物质的电离方程式:
NaHSO4 NaHCO3
H2S Al(OH)3
KAl(SO4)2 H2SO3
3、在一定条件下,
,叫做电离平衡。
4、电离平衡的特点:
⑴定:溶液中未电离的分子浓度和电离产生的离子浓度将 。
⑵动: 电离平衡是一个 平衡。 ⑶等:V(电离) V(结合)>0。
⑷变:若条件改变,旧的电离平衡将被 ,会重新建立新的平衡。
5、影响电离平衡的因素:
CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ 若改变条件,则
条件 平衡移动方向 电离程度 C(H+) pH
升温
加水
加冰醋酸
加
CH3COONa
加 HCl
加 NaOH
6、同浓度、同体积的盐酸和醋酸相比:
C(H+) pH 中和碱的
能力
与 活 泼 金 属
产生 H2 的量
开 始 与 金 属
反应的速率
盐酸 大 大
醋酸 大
同 pH、同体积的盐酸和醋酸相比:
C(H+) C(酸) 中 和 碱
的能力
与 活泼 金 属
产生 H2 的量
开始与金属
反应的速率
盐酸 相同 小 小
醋酸 大
电离平衡巩固练习
第Ⅰ卷 (选择题 共 60 分)
一、选择题(本题包括 5 小题,每小题 4 分,共 20 分。每小题只有一个选项符合题意)
1.根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高
速公路关闭,航班停飞,雾属于下列分散系中的( )
A.溶液 B.悬浊液 C.乳浊液 D.胶体
2.为维持人体内电解质平衡,下列离子在人体大量出汗后应及时补充的是( )
A.
2Mg B. 2Ca C. Na D. 3Fe
3.常温下,将甲酸和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中( )
A. )()( NacHCOOc
B. )()( NacHCOOc
C. )()( NacHCOOc
D.无法确定 )( HCOOc 与 )( Nac 的关系
4.在同一温度下,弱电解质溶液 a,弱电解质溶液 b,金属导体 c 的导电能力相同。若升高
温度后,它们的导电能力是( )
A.a>b>c B.a=b=c C.c>a>b D.b>c>a
5.等物质的量浓度的下列溶液中,
4NH 离子的浓度最大的是( )
A. ClNH 4 B. 34 HCONH C. 44 HSONH D. 34 NONH
二、选择题(本题包括 10 小题,每小题 4 分,共 40 分。每小题有一个或两个选项符合题意。
若正确答案只包括一个选项,多选时,该题为 0 分;若正确答案包括两个选项,只选一个且
正确的给 2 分,选两个都正确的给 4 分,但只要选错一个,该小题就为 0 分)
6.从下列现象可以判断某酸是强酸的是( )
A.加热该酸至沸腾也不分解
B.该酸可以分解石灰石放出 2CO
C.该酸可以把 3)(OHAl 沉淀溶解
D.该酸浓度为 11.0 Lmol 时的 pH 为 1
7.常温下,某溶液中,由水电离出的氢离子的物质的量浓度为 11410 Lmol ,该离子中可
能大量共存的离子组是( )
A. 2Ba 、 Na 、
2
4SO 、 Cl B. 2S 、 Na 、
3HCO 、 K
C.
2Mg 、 2Fe 、
2
4SO 、 Cl D.
4NH 、 Na 、
2
3SO 、 Cl
8.下列现象或应用不能用胶体知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.牛油与 NaOH 溶液共煮,向反应后所得的溶液中加入食盐,则有固体析出
C.氯化铝溶液中加入小苏打溶液会产生白色沉淀和气体
D.水泥治金厂常用高压电除去工厂烟尘,减少对空气污染
9.实验测得常温下 11.0 Lmol 某一元酸(HA)溶液的 pH 不等于 1, 11.0 Lmol 某一元
碱(BOH)溶液里
1210
)(
)(
OHc
Hc
,将这两种溶液等体积混合后,所得溶液里各离子的物
质的量浓度由大到小顺序是( )
A. )()()()( HcOHcAcBc
B. )()()()( OHcHcBcAc
C. )()()()( OHcHcAcBc
D. )()()()( OHcHcAcBc
10.以下是几种酸碱指示剂变色的 pH 范围:①甲基橙 3.1~4.4 ②甲基红 4.4~6.2 ③酚
酞 8.2~10,现用 NaOHLmol 11000.0 溶液滴定浓度相近的甲酸时,上述指示剂( )
A.都可以用 B.只能用③
C.可以用①或② D.可以用②或③
11.下列离子方程式书写正确的是( )
A.醋酸除水垢 OHCOCaCOOCHCaCOHCOOCH 222333 )(22
B.盐酸除铁锈 OHFeFeOH 2
22
C.硫酸除铜绿 OHCOCuCOOHCuH 22
2
322 32)(4
D.(稀)硝酸除银镜 OHNOAgNOHAg 2232
12.用水稀释 11.0 Lmol 氨水时,溶液中随着水量的增加而减小的是( )
A. )(
)(
23 OHNHc
OHc
B. )(
)( 23
OH
OHNHc
C. )( Hc 和 )( OHc 的乘积 D. )( OHc 的物质的量
13.将 20 mL
14.0 Lmol 硝酸铵溶液跟 50 mL
11.0 Lmol 氢氧化钡溶液混合,则混合溶
液中各离子浓度的大小顺序是( )
A. )()()()( 2
43
BacNHcOHcNOc
B. )()()()( 4
2
3
NHcOHcBacNOc
C. )()()()( 43
2 NHcOHcNOcBac
D. )()()()( 4
2
3
OHcNHcBacNOc
14.某溶液中含有
3HCO 、
2
3SO 、
2
3CO 、
COOCH 3 等 4 种阴离子,若向其中加入足
量的 22ONa 后,溶液中离子浓度变化最小的是( )
A.
COOCH 3 B.
2
3SO C.
2
3CO D.
3HCO
15.用已知浓度的 NaOH 溶液测定某 42 SOH 溶液的浓度,如 11-1 图,从下表中选出正确选
项( )
锥形瓶中溶液 滴定管中溶液 选用指示剂 选用滴定管
A 碱 酸 石蕊 (乙)
B 酸 碱 酚酞 (甲)
C 碱 酸 甲基橙 (甲)
D 酸 碱 酚酞 (乙)
第Ⅱ卷 (非选择题 共 90 分)
三、(本题包括 2 小题,共 18 分)
16.(6 分)下面 a~e 是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标出仪器使用温度的是________________(填写编号);
(2)能够用以精确量取液体体积的是_____________(填写编号);
(3)称取 10.5g 固体样品(1g 以下使用游码)时,将样品放在了天平的右盘,则所称样品
的实际质量为__________________g。
17.(12 分)化学实验员给某学生提供下列药品和必要的实验仪器,要求学生设计实验证明
乙酸是弱酸,药品是冰醋酸、蒸馏水和 pH 试纸。此同学思考后认为:
(1)设计的理论依据是__________________________________________;
(2)实验简要步骤是______________________________________________________
_____________________________________________________________;
(3)需记录的现象和数据是_______________________________________;
( 4 ) 推 断 与 分 析 , 由 于 __________________________________________ ; 说 明
_________________________________________________,所以乙酸是弱酸。
四、(本题包括 3 小题,共 26 分)
18.(8 分)在盛有碳酸钠浓溶液的试管中逐滴加入稀盐酸,充分振荡,直到不再产生 2CO 气
体为止,则在此过程中,溶液里
3HCO 离子浓度的变化趋势可能是___________________
A.逐渐增大 B.逐渐减小
C.先逐渐增大,而后逐渐减小 D.先逐渐减小,而后逐渐增大
试用方程式和简要文字表述理由:
_______________________________________________________________________________
__________________________________________
19.(8 分)泡沫式灭火器内盛放 342 )(SOAl 溶液(约 11 Lmol )、 3NaHCO 溶液(约
11 Lmol )及起泡剂。使用时发生的化学方程式是______________________________,
342 )(SOAl 溶液和 3NaHCO 溶液的体积比约是_______________。若用等体积等物质的量
浓 度 的 32CONa 溶 液 代 替 3NaHCO 溶 液 , 在 使 用 时 喷 不 出 泡 沫 , 这 是 因 为
_________________。泡沫灭火器玻璃筒里盛放 342 )(SOAl 溶液,铁筒里存放 3NaHCO 溶
液,不能把 342 )(SOAl 溶液盛放在铁筒里的原因是______________________________。
20.(10 分)25℃时,若体积为 aV 、pH=a 的某一元强酸与体积为 bV 、pH=b 的某一元强碱
混合,恰好中和,且已知 ba VV 和 a=0.5b,请填写下列空白:
(1)a 值可否等于 3(填“可”或“否”)______________,其理由是__________________
____________________________。
(2)a 值可否等于 5(填“可”或“否”)___________,其理由是_____________________
__________________________________________。
(3)试确定 a 的取值范围_________________________________。
五、(本题包括 2 小题,共 20 分)
21.(12 分)取体积相同(0.025L)的两份 NaOHLmol 110.0 溶液,把其中的一份放在空
气中一段时间后,溶液的 pH_________________(填“增大”、“减小”或“不变”),其原因
是____________________________________________。
用已知浓度的硫酸溶液中和上述两份溶液,若中和第一份(在空气中放置一段时间)所消耗
硫酸溶液的体积为 AV ,另一份消耗硫酸溶液的体积为 BV ,则:
(1)以甲基橙为指示剂时, AV 与 BV 的关系是____________________________;
(2)以酚酞为指示剂时, AV 与 BV 的关系是____________________________。
22.(8 分)有 A、B、C、D 四种无色溶液,它们分别是 COONaCH 3 溶液、 ClNH 4 溶液、
盐酸和 42 SONa 溶液中的一种。
(1)已知 A、B 的溶液中水的电离程度相同,A、C 溶液和 pH 相同。A 是____________溶
液,B 是______________溶液,C 是_______________溶液。
(2)若 B 溶液中 )( OHc 与 C 溶液中的 )( Hc 相同,现将 B 的溶液稀释 10 倍后溶液的
pH 值用 BpH 表示,C 溶液的 pH 值用 CpH 表示,则 CB pHpH __________________(填
大于或等于某个数)。
六、(本题包括 2 小题,共 26 分)
23.(9 分)有一种 pH 为 12 的 NaOH 溶液 100 mL,要使它的 pH 降到 11,
(1)如果加入蒸馏水,应加____________mL;(溶液总体积允许相加。下同)
(2)如果加入 pH=10 的 NaOH 溶液,应加______________mL;
(3)如果加入 11.0 Lmol 的盐酸,应加__________________mL。
24.(17 分)实验室为测定某工业废水中含酚(以苯酚计)量,进行如下操作:
(1)分别称取 334.3 gKBrO 和 KBrg90.11 ,混合后置于烧杯中,加蒸馏水使其溶解。用
________________(填仪器名称不同)引流注入_____________,……最后用___________
滴加蒸馏水定容,配成 1L 溶液。
(2)称取_____________ OHOSNag 2322 5 ,用同样方法准确配制
11.01 LmolL 的标准
溶液。
(3)准确量取 100mL 含酚(以苯酚计)水样,准确滴加 KBrKBrO 3 混合液 15.00mL 并
加适量盐酸将水样酸化。此时两种钾盐反应生成 2Br ,立即跟苯酚反应生成沉淀。
(4)上述反应完成后,再加入约 1 g KI,放置 5 min,然后用_____________作指示剂,再
用 322 OSNa 标 准 溶 液 滴 定 至 蓝 色 恰 好 消 失 为 止 ( 反 应 为 :
6422322 2 OSNaNaIIOSNa ),用去 32280.10 OSNamL 溶液。
(5)求水中酚的含量(
1 Lmg )是否符合国家有关废水允许排放的标准?
(国家标准为酸的含量≤
15.0 Lmg )
弱电解质的电离平衡基础知识答案
1、从物质结构观点来看,强电解质是具有 离子 键的 离子化合物和某些具有共价 键的共
价 化合物,弱电解质是具有 共价 键
的共价 化合物;从电离平衡的观点来看,强电解质在溶液中 全部 电离,弱电解质
在溶液中部分 电离;从物质类别来看,一般地说,强电解质为强酸 、 强碱 和 大部分盐,
弱电解质为 弱酸 和弱碱 等。
2、写出下列物质的电离方程式:
NaHSO4 = Na++ H++ SO42- NaHCO3 = Na++ HCO3—
H2S H++ HS- Al(OH)3 Al3++ 3OH-
KAl(SO4)2 = K++ Al3++ 2SO42- H2SO3 H++ HS03-
3、在一定条件下, 当电解质分子电离成离子的速率和离子重新结合成分子速率相等时,电
离过程就达到了平衡状态 ,叫做电离平衡。
4、电离平衡的特点:
⑴定:溶液中未电离的分子浓度和电离产生的离子浓度将 保持不变 。
⑵动: 电离平衡是一个 动态 平衡。 ⑶等:V(电离) = V(结合)>0。
⑷变:若条件改变,旧的电离平衡将被 破坏 ,会重新建立新的平衡。
5、影响电离平衡的因素:
CH3COOH 溶液中存在电离平衡:CH3COOH CH3COO-+H+ 若改变条件,则
条件 平衡移动方向 电离程度 C(H+) pH
升温 正 增大 增大 减小
加水 正 增大 减小 增大
加冰醋酸 正 减小 增大 减小
加
CH3COONa
逆 减小 减小 增大
加 HCl 逆 减小 增大 减小
加 NaOH 正 增大 减小 增大
6、同浓度、同体积的盐酸和醋酸相比:
C(H+) pH 中和碱的
能力
与 活 泼 金 属
产生 H2 的量
开 始 与 金 属
反应的速率
盐酸 大 小 相同 相同 大
醋酸 小 大 小
同 pH、同体积的盐酸和醋酸相比:
C(H+) C(酸) 中 和 碱
的能力
与 活泼 金 属
产生 H2 的量
开始与金属
反应的速率
盐酸 相同 小 小 小 相同
醋酸 大 大 大
巩固练习参考答案
1.D 雾是由小水珠(直径 m79 10~10
)分散于空气中形成的,属于胶体。
2.C 人体出汗时会损失 NaCl,需补充 Na 。
3 . C 据 电 荷 守 恒 )()()()( NacHcOHcHCOOc , 7pH ,
)()( HcOHc ,则 )()( NacHCOOc 。
4.A 温度升高,弱电解质的电离程度增大,导电能力增强;强电解质因已完全电离,导
电能力变化不大;而金属的导电能力减弱。
5.C 在 44 HSONH 溶液中,
2
4444 SOHNHHSONH , H 的存在抑制了
4NH 的
水解。
6.D 酸性强弱要看电离 H 的程度,D 项中酸浓度为 11.0 Lmol 时的 pH 为 1,说明酸中
的 H 全部电离,酸为强酸。注意 B、C 不成立,如醋酸可溶解 3CaCO 、 3)(OHAl 。
7.C
11410)( LmolHc 水 ,溶液可为强酸,
1
4
1
)(
10)(
Lmol
OHc
Hc
水 或强碱
1
14
1
)(
10)(
Lmol
Hc
OHc
水 ,而 C 项在碱性环境下可大量共存。
8.C “血液透析”即为渗析,B 项为胶体的盐析,D 项为胶体的电泳。
9 . A HA 为 弱 酸 , 在 BOH 溶 液 里
1210
)(
)(
OHc
Hc
,
12
2
14
10
)]([
10
OHc ,
11.0)( LmolOHc ,BOH 为强碱。酸碱恰好反应,生成的 BA 发生水解。
10.B 达到滴定终点恰好生成 HCOONa,溶液因水解显碱性。
11.C A 项醋酸为弱酸应写化学式;B 项铁锈为 32OFe ;D 项稀硝酸生成 NO 。
12.B 由于电离平衡 ,因稀释而向正反应方向移动,因而在
同等稀释的前提下, OHNH 23 的浓度将进一步减小,由 OHNH 23 电离出来的 OH 浓
度会有一定程度的增加,即在溶液中 ))(()( 23
OHcOHNHc 。若再逐渐稀释下去,直
到氨水的碱性逐渐减弱而接近极限的状态下,氨水的浓度会一直减弱下去,但 OH 离子的
浓度会逐渐接近并保持一个常量: 1710 Lmol 。因此,将 OHNHLmol 23
11.0
水稀释,
分数 )(
)( 23
OHc
OHNHc
永远是分母大于分子,即其值随着水量的增加而减小。
13.B 由于 342 NONH + HoNHNOBaOHBa 3232 2)( )( 2)(OHBa 过量,
故 )()( 4
NHcOHc ;
14.A 加入 22ONa 后, OHCOOHHCO 2
2
33
,而
2
3SO 会被氧化。
15.CD 石蕊因变色不明显,不能作指示剂;注意:甲为酸式滴定管,乙为碱式滴定管。
16.(1)abc (2)c (3)9.5
17.(1)弱电解质溶液稀释 10a 倍, pH 改变小于 a (2)将一定浓度的酸稀释到一定量
(如 100 倍体积)后,测定稀释前后溶液的 pH (3)稀释的倍数,稀释前后溶液的 pH
(4)溶液稀释 100 倍体积后,溶液的 pH 的改变小于 2;稀释过程中酸的电离程度增大
18 . C ; 先 加 稀 盐 酸 , 发 生 反 应
3
2
3 HCOCOH , 故
3HCO 浓 度 增 大 后 发 生
3223 , HCOOHCOHHCO 浓度减小
19. 24233342 63)(26)( COSONaOHAlNaHCOSOAl ;1:6; 342 )(SOAl 的
量 偏 少 , 产 生 2CO 气 体 减 少 ; 342 )(SOAl 水 解 后 溶 液 显 酸 性 , 会 腐 蚀 金 属 铁
OHAl 2
3 3 HOHAl 3)( 3 ,
2
22 HFeFeH
20.(1)否;若 a=3,则 b=6,溶液显酸性,与题意不符,故 3a
(2)否;若 a=5,则
1510)( LmolaHc ,即 b=10,
1410)( LmolOHc b ,
1)(:)(:
abba HcOHcVV 不符合题意,故 5a
( 3 ) 3
14
2
7 a
解 析 :
110
)(
)(
)(
)(
)( )14(
6
ba
a
b
a
b
b
a
Hc
Hc
Hc
Hc
OHc
V
V
, 所 以
0)14( ba ,而 ba 5.0
即 3
14,143 aa
。又 2
7,72 aab
,所以 3
14
2
7 a
21.减小;因为 NaOH 溶液露置于空气中,与空气中 2CO 反应,使 NaOH 减少,溶液的 pH
减小 (1) BA VV (2) BA VV
22.(1) ClNH 4 ; COONaCH 3 ;盐酸 (2) 13>pHpH CB
23.(1)900 (2)1000 (3)81.8
24.(1)玻璃棒;容量瓶;胶头滴管(2)24.8 (4)淀粉
(5)设 KBrmLKBrO 300.15 混合液遇酸反应后生成 2Br 的物质的量为 xmol
OHKClBrHClKBrKBrO 223 363 65
1 3
1000
15
167
34.3
x )(109 4 molx
设过量的 2Br 的物质的量为 ymol ,由 32222 OSNaIBr
知:
)(104.51080.101.02
1 43 moly
则与苯酚反应的溴的物质的量 )(106.3104.5109 444 mol
设 100mL 废水中苯酚的物质的量为 zmol
由
知:
)(102.1106.33
1 44 molz
废水中苯酚的含量为
11
34
5.0)(8.1121.0
1094102.1
LmgLmg
可知,超过国家标准,不能排放。
相关文档
- 人教版高二化学3-1-1 电离平衡(第一2021-07-063页
- 2021高考化学一轮复习专题8第1讲弱2021-07-0613页
- 化学第三章水溶液中的离子平衡第12021-07-066页
- 2021高考化学一轮复习课时达标作业2021-07-069页
- 备战2021 高考化学 考点42 弱电解2021-07-0626页
- 2021届一轮复习苏教版8-1 弱电解2021-07-0613页
- 2020届高考化学二轮复习弱电解质的2021-07-0617页
- 2019届一轮复习苏教版弱电解质的电2021-07-0628页
- 2020届高考化学一轮复习(浙江)水的电2021-07-069页
- 2021高考化学一轮复习专题八弱电解2021-07-0625页