- 435.39 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时规范练19 化学反应的热效应
一、选择题(本题共8小题,每小题7分,共56分。每小题只有一个选项符合题目要求)
1.已知2SO2(g)+O2(g)2SO3(g) ΔH=-196.64 kJ·mol-1。下列说法正确的是( )
A.1 mol S(s)在纯氧中燃烧放出的热量大于在空气中燃烧放出的热量
B.1 mol SO2和0.5 mol O2储存的能量之和大于1 mol SO3
C.1 L SO2(g)完全反应生成1 L SO3(g),放出98.32 kJ热量
D.使用催化剂,可以减少上述反应放出的热量
2.(2018甘肃天水一中高三检测)下列说法正确的是( )
A.在25 ℃、101 kPa,1 mol S(s)和2 mol S(s)的燃烧热相等
B.1 mol H2SO4(浓)与1 mol Ba(OH)2完全中和所放出的热量为中和热
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应
D.101 kPa时,1 mol H2燃烧所放出的热量为氢气的燃烧热
3.已知热化学方程式:
C(金刚石,s)+O2(g)CO2(g) ΔH1 ①
C(石墨,s)+O2(g)CO2(g) ΔH2 ②
C(石墨,s)C(金刚石,s) ΔH3=+1.9 kJ·mol-1③
下列说法正确的是( )
A.金刚石比石墨稳定
B.石墨转化成金刚石的反应是吸热反应
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
4.下列热化学方程式正确的是( )
选项
已知条件
热化学方程式
A
H2的燃烧热为a kJ·mol-1
H2+Cl22HCl ΔH=-a kJ·mol-1
B
1 mol SO2、0.5 mol O2完全反应后,放出热量98.3 kJ
2SO2(g)+O2(g)2SO3(g)
ΔH=-98.3 kJ·mol-1
C
H+(aq)+OH-(aq)H2O(l) ΔH=-57.3 kJ·mol-1
H2SO4(aq)+Ba(OH)2(aq)BaSO4(s)+2H2O(l) ΔH=-114.6 kJ·mol-1
D
31 g白磷比31 g红磷能量多b kJ
P4(白磷,s)4P(红磷,s) ΔH=-4b kJ·mol-1
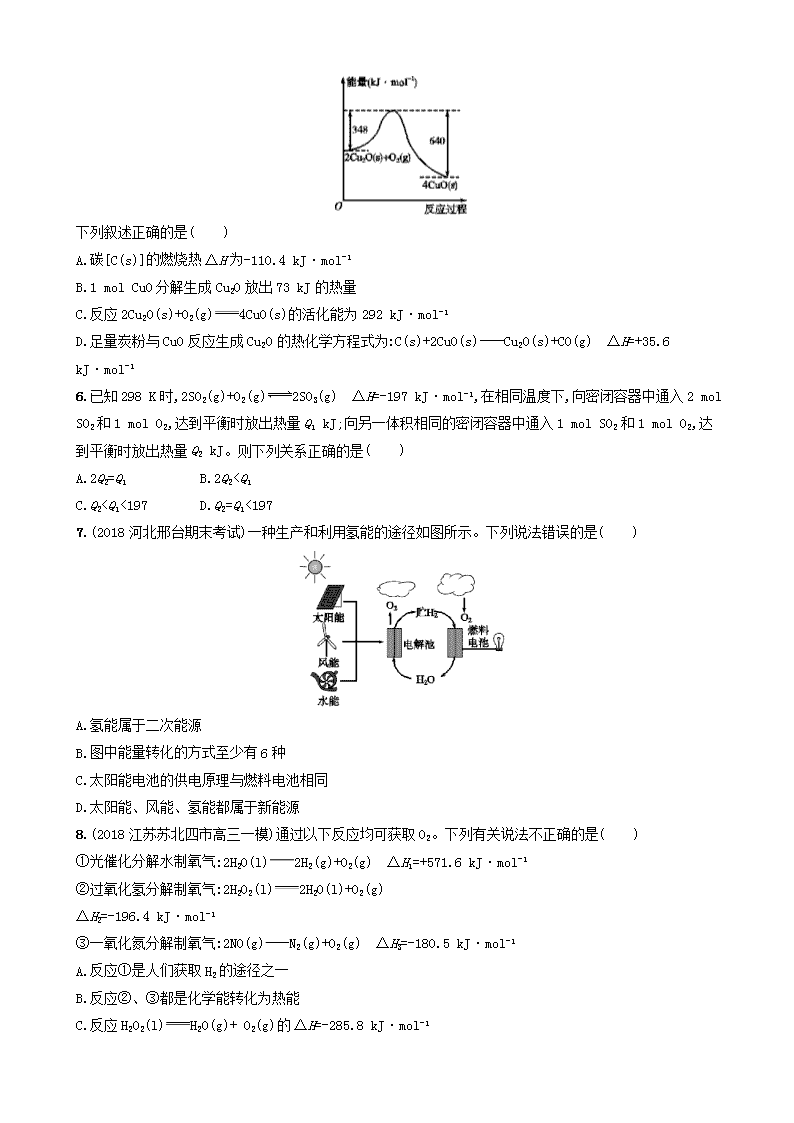
5.(2018山东潍坊高三期中)已知:1 g C(s)燃烧生成一氧化碳放出9.2 kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。
下列叙述正确的是( )
A.碳[C(s)]的燃烧热ΔH为-110.4 kJ·mol-1
B.1 mol CuO分解生成Cu2O放出73 kJ的热量
C.反应2Cu2O(s)+O2(g)4CuO(s)的活化能为292 kJ·mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为:C(s)+2CuO(s)Cu2O(s)+CO(g) ΔH=+35.6 kJ·mol-1
6.已知298 K时,2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,在相同温度下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时放出热量Q1 kJ;向另一体积相同的密闭容器中通入1 mol SO2和1 mol O2,达到平衡时放出热量Q2 kJ。则下列关系正确的是( )
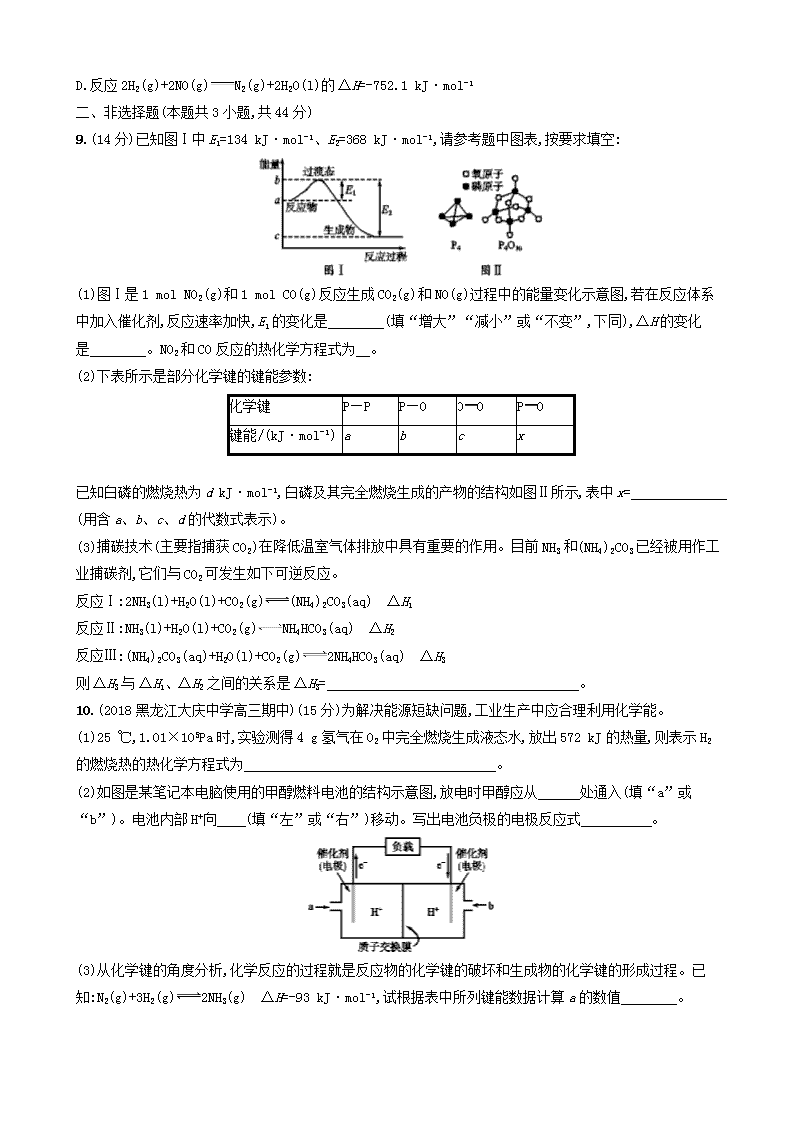
A.2Q2=Q1 B.2Q2E2,则该反应为 (填“吸热”或“放热”)反应。
②已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2与H2反应生成NH3的热化学方程式为 。
(2)N2H4和H2O2混合可作火箭推进剂,已知:16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量;2H2O2(l)O2(g)+2H2O(l) ΔH=-196.4 kJ·mol-1。反应N2H4(g)+O2(g)N2(g)+2H2O(l)的ΔH= kJ·mol-1。N2H4和H2O2反应生成N2(g)和H2O(l)的热化学方程式为 。
(3)实验室用50 mL 0.50 mol·L-1盐酸与50 mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反应过程中所放出的热量可计算中和热。该装置有一处明显的错误,该处错误是缺少一种玻璃仪器,该仪器的名称为 ;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择 mol·L-1的溶液进行实验。
(4)“嫦娥二号”卫星使用液态四氧化二氮和液态偏二甲肼(C2H8N2)作推进剂。N2O4与偏二甲肼反应的产物只有CO2(g)、H2O(g)和N2(g),并放出大量的热,已知10.0 g液态偏二甲肼与液态四氧化二氮完全燃烧可放出425 kJ热量,该反应的热化学方程式为 。
(5)已知:①H2(g)H2(l) ΔH=-0.92 kJ·mol-1
②O2(g)O2(l) ΔH=-6.84 kJ·mol-1
③H2O(l)H2O(g) ΔH=+44.0 kJ·mol-1
④H2(g)+ O2(g)H2O(l) ΔH=-285.8 kJ·mol-1
请写出液氢与液氧反应生成气态水的热化学方程式: 。
课时规范练19 化学反应的热效应
1.B 1 mol S(s)在纯氧和空气中完全燃烧放出的总能量相同,在纯氧中燃烧反应剧烈,发出蓝紫色火焰,在空气中燃烧发出淡蓝色火焰,因此S(s)在纯氧中燃烧时转化为其他形式的能量(如光能)多,热能减少,A错;热化学方程式中化学计量数表示参加反应的物质的物质的量,C错;使用催化剂只改变反应的速率,但不改变反应的焓变,D错。
2.A 燃烧热指25 ℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,因此S的燃烧热相等,故A项正确;中和热是稀强酸与稀强碱溶液发生中和反应生成1 mol H2O时放出的热量,浓硫酸稀释会放出热量,且反应生成BaSO4沉淀也会放出热量,故B项错误;所有的燃烧都是放热反应,故C项错误;燃烧热要求生成稳定的氧化物,即101 kPa时1 mol氢气燃烧产生的H2O是液态时,放出的热量才是燃烧热,故D项错误。
3.B 石墨转化为金刚石吸热,说明石墨的总能量低于金刚石,所以石墨比金刚石稳定性强,A项错误;石墨转化成金刚石的反应是吸热反应,B项正确;根据盖斯定律可知②-①即得到ΔH3=ΔH2-ΔH1>0,C项错误;ΔH1<ΔH2,D项错误。
4.D 选项A中符合已知条件的应是H2和O2反应,A错误;根据方程式中的化学计量数,ΔH应为-196.6 kJ·mol-1,B错误;选项C中由于生成了BaSO4沉淀,则放出的热量大于114.6 kJ,C错误。
5.D 因1 g C(s)燃烧全部生成CO时放出热量9.2 kJ,则12 g C(s)燃烧生成一氧化碳放热110.4 kJ,而燃烧热指的是1 mol纯物质完全燃烧生成稳定的氧化物时所放出的热量,A项错误;根据图像可知,由CuO分解生成Cu2O需要吸收热量,B项错误;反应2Cu2O(s)+O2(g)4CuO(s)的活化能为348 kJ·mol-1,C项错误;依据图像书写热化学方程式①2Cu2O(s)+O2(g)4CuO(s) ΔH=-292 kJ·mol-1;再根据1 g C(s)燃烧全部生成CO时放出热量9.2 kJ,可得热化学方程式为:②2C(s)+O2(g)2CO(g) ΔH=-220.8 kJ·mol-1,根据盖斯定律,②-①得4CuO(s)+2C(s)2CO(g)+2Cu2O(s) ΔH=+71.2 kJ·mol-1,则2CuO(s)+C(s)CO(g)+Cu2O(s) ΔH=+35.6 kJ·mol-1, D项正确。
6.C 根据反应的热化学方程式:2SO2(g)+O2(g)2SO3(g) ΔH=-197 kJ·mol-1,可知在题给条件下反应生成2 mol SO3气体放热197 kJ。向容器中加入2 mol SO2和1 mol O2反应生成SO3的量小于2 mol,所以Q1<197,1 mol SO2和1 mol O2相当于在2 mol SO2和1 mol O2达平衡的基础上,减少反应物的浓度,平衡逆向移动,即Q2E2,则ΔH=E2-E1<0,该反应为放热反应。②ΔH=反应物的总键能-生成物的总键能,已知拆开1 mol H—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则N2(g)+3H2(g)2NH3(g) ΔH=946 kJ·mol-1+3×436 kJ·mol-1
-2×3×391 kJ·mol-1=-92 kJ·mol-1。(2)16 g液态N2H4和足量氧气反应生成N2(g)和H2O(l),放出310.6 kJ的热量,故N2H4(l)和足量氧气反应的热化学方程式为N2H4(l)+O2(g)N2(g)+2H2O(l) ΔH=-621.2 kJ·mol-1。已知:N2H4(l)+O2(g)N2(g)+2H2O(l) ΔH=-621.2 kJ·mol-1 a,2H2O2(l)2H2O(l)+O2(g) ΔH=-196.4 kJ·mol-1 b,根据盖斯定律,由a+b得:N2H4(l)+2H2O2(l)N2(g)+4H2O(l) ΔH=-817.6 kJ·mol-1。(3)由题图可知该装置缺少的仪器是环形玻璃搅拌棒,应加入过量的氢氧化钠溶液以保证盐酸反应完全,故应选择0.55 mol·L-1的溶液进行实验。(4)N2O4与偏二甲肼反应的产物为CO2、N2和气态水,1 mol C2H8N2(l)与N2O4完全燃烧放出的热量为×60 g=2 550.0 kJ。热化学方程式为C2H8N2(l)+2N2O4(l)2CO2(g)+4H2O(g)+3N2(g) ΔH=-2 550.0 kJ·mol-1。(5)根据盖斯定律,由④+③-①-②×得:H2(l)+ O2(l)H2O(g) ΔH=-237.46 kJ·mol-1。
相关文档
- 2020鲁科版高考化学复习规范练 (392021-07-068页
- 2020鲁科版高考化学复习规范练 (7)2021-07-068页
- 2020鲁科版高考化学复习规范练 (362021-07-0610页
- 2020鲁科版高考化学复习规范练 (172021-07-067页
- 2020鲁科版高考化学复习规范练 (112021-07-068页
- 2020鲁科版高考化学复习规范练 (302021-07-067页
- 2020鲁科版高考化学复习规范练 (212021-07-068页
- 2020鲁科版高考化学复习规范练 (2)2021-07-068页
- 2020鲁科版高考化学复习规范练 (122021-07-063页
- 2020鲁科版高考化学复习规范练 (232021-07-058页