- 419.90 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题能力训练6 电化学基础
(时间:45分钟 满分:100分)
一、选择题(共7小题,每小题8分,共56分。每小题只有1个选项符合题意)
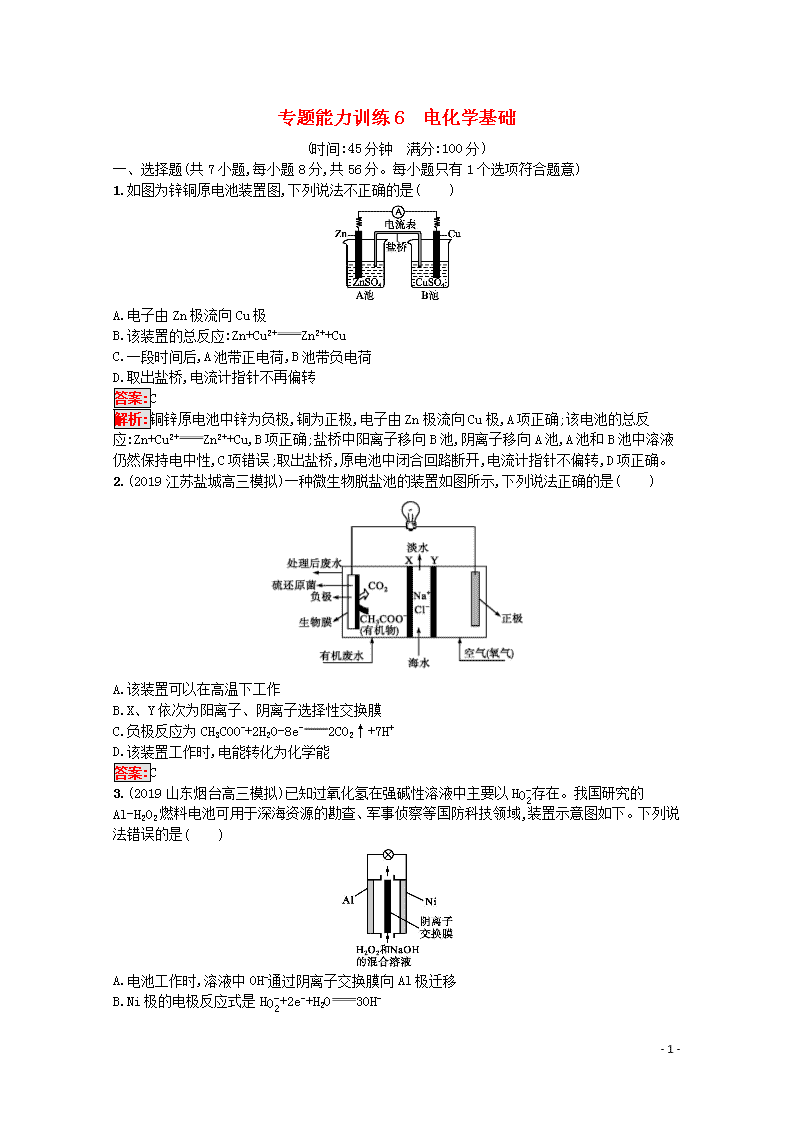
1.如图为锌铜原电池装置图,下列说法不正确的是( )
A.电子由Zn极流向Cu极
B.该装置的总反应:Zn+Cu2+Zn2++Cu
C.一段时间后,A池带正电荷,B池带负电荷
D.取出盐桥,电流计指针不再偏转
答案:C
解析:铜锌原电池中锌为负极,铜为正极,电子由Zn极流向Cu极,A项正确;该电池的总反应:Zn+Cu2+Zn2++Cu,B项正确;盐桥中阳离子移向B池,阴离子移向A池,A池和B池中溶液仍然保持电中性,C项错误;取出盐桥,原电池中闭合回路断开,电流计指针不偏转,D项正确。
2.(2019江苏盐城高三模拟)一种微生物脱盐池的装置如图所示,下列说法正确的是( )
A.该装置可以在高温下工作
B.X、Y依次为阳离子、阴离子选择性交换膜
C.负极反应为CH3COO-+2H2O-8e-2CO2↑+7H+
D.该装置工作时,电能转化为化学能
答案:C
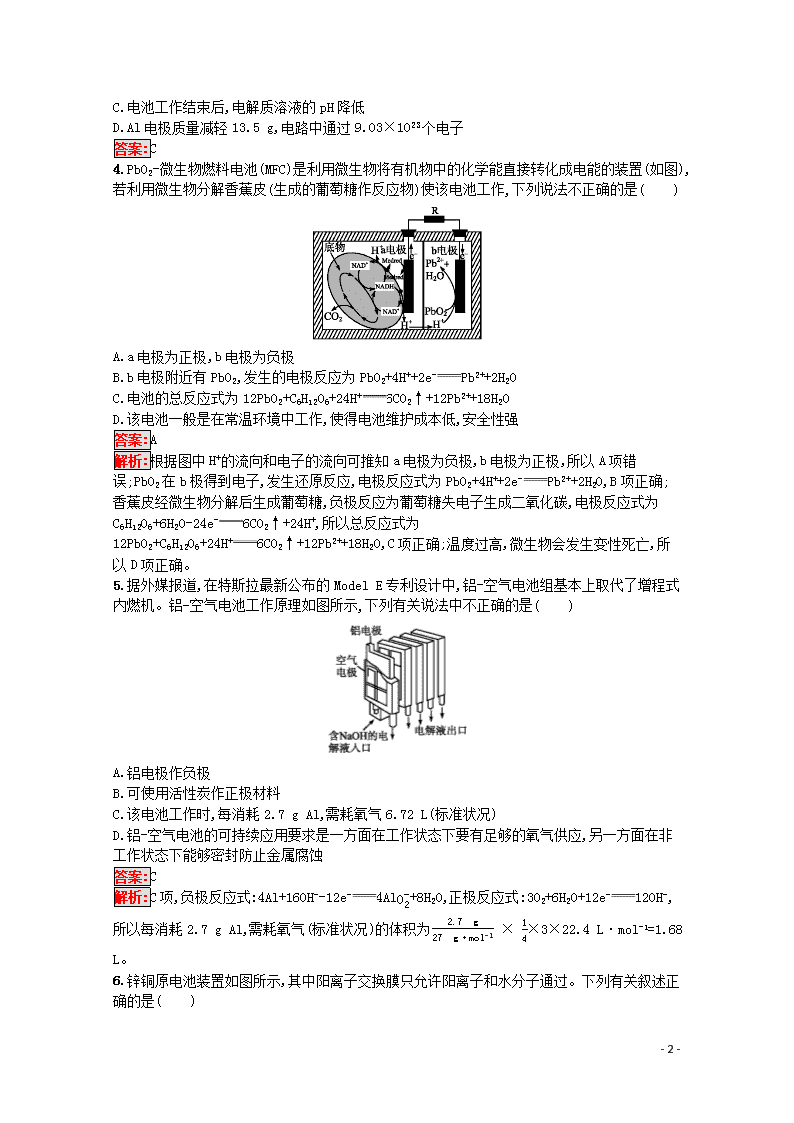
3.(2019山东烟台高三模拟)已知过氧化氢在强碱性溶液中主要以HO2-存在。我国研究的Al-H2O2燃料电池可用于深海资源的勘查、军事侦察等国防科技领域,装置示意图如下。下列说法错误的是( )
A.电池工作时,溶液中OH-通过阴离子交换膜向Al极迁移
B.Ni极的电极反应式是HO2-+2e-+H2O3OH-
- 5 -
C.电池工作结束后,电解质溶液的pH降低
D.Al电极质量减轻13.5 g,电路中通过9.03×1023个电子
答案:C
4.PbO2-微生物燃料电池(MFC)是利用微生物将有机物中的化学能直接转化成电能的装置(如图),若利用微生物分解香蕉皮(生成的葡萄糖作反应物)使该电池工作,下列说法不正确的是( )
A.a电极为正极,b电极为负极
B.b电极附近有PbO2,发生的电极反应为PbO2+4H++2e-Pb2++2H2O
C.电池的总反应式为12PbO2+C6H12O6+24H+6CO2↑+12Pb2++18H2O
D.该电池一般是在常温环境中工作,使得电池维护成本低,安全性强
答案:A
解析:根据图中H+的流向和电子的流向可推知a电极为负极,b电极为正极,所以A项错误;PbO2在b极得到电子,发生还原反应,电极反应式为PbO2+4H++2e-Pb2++2H2O,B项正确;香蕉皮经微生物分解后生成葡萄糖,负极反应为葡萄糖失电子生成二氧化碳,电极反应式为C6H12O6+6H2O-24e-6CO2↑+24H+,所以总反应式为12PbO2+C6H12O6+24H+6CO2↑+12Pb2++18H2O,C项正确;温度过高,微生物会发生变性死亡,所以D项正确。
5.据外媒报道,在特斯拉最新公布的Model E专利设计中,铝-空气电池组基本上取代了增程式内燃机。铝-空气电池工作原理如图所示,下列有关说法中不正确的是( )
A.铝电极作负极
B.可使用活性炭作正极材料
C.该电池工作时,每消耗2.7 g Al,需耗氧气6.72 L(标准状况)
D.铝-空气电池的可持续应用要求是一方面在工作状态下要有足够的氧气供应,另一方面在非工作状态下能够密封防止金属腐蚀
答案:C
解析:C项,负极反应式:4Al+16OH--12e-4AlO2-+8H2O,正极反应式:3O2+6H2O+12e-12OH-,所以每消耗2.7 g Al,需耗氧气(标准状况)的体积为2.7 g27 g·mol-1×14×3×22.4 L·mol-1=1.68 L。
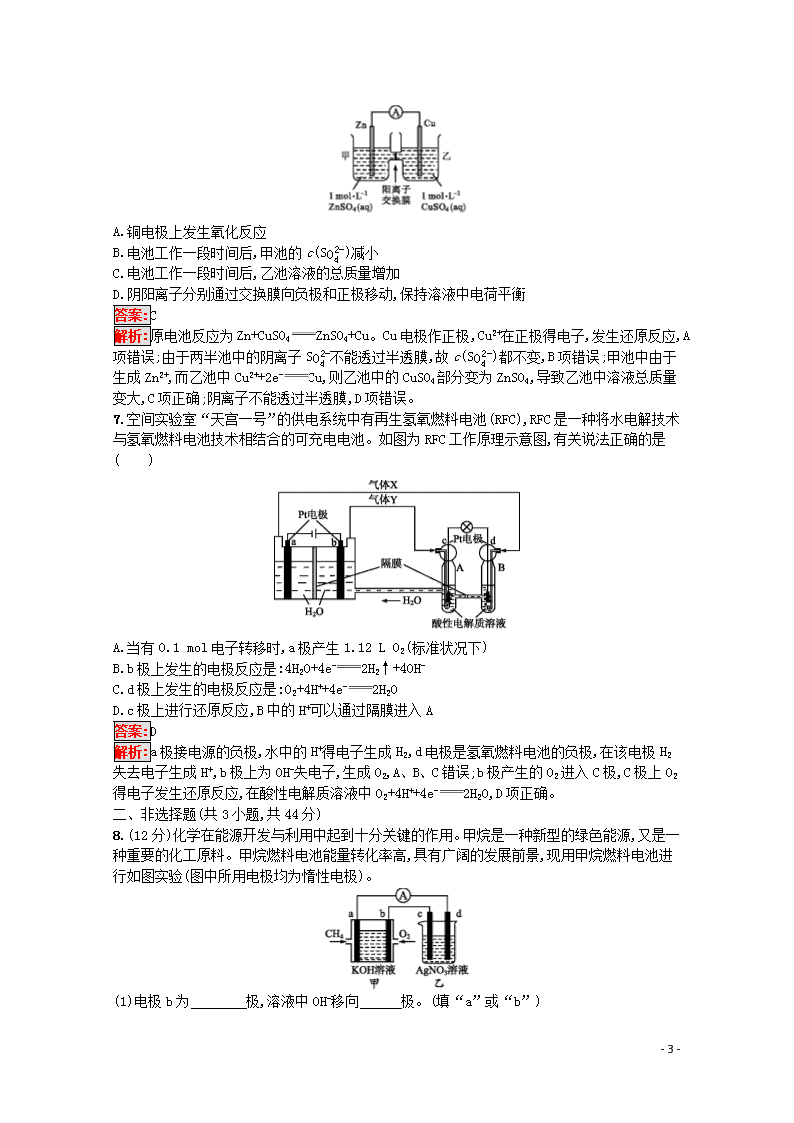
6.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过。下列有关叙述正确的是( )
- 5 -
A.铜电极上发生氧化反应
B.电池工作一段时间后,甲池的c(SO42-)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
答案:C
解析:原电池反应为Zn+CuSO4ZnSO4+Cu。Cu电极作正极,Cu2+在正极得电子,发生还原反应,A项错误;由于两半池中的阴离子SO42-不能透过半透膜,故c(SO42-)都不变,B项错误;甲池中由于生成Zn2+,而乙池中Cu2++2e-Cu,则乙池中的CuSO4部分变为ZnSO4,导致乙池中溶液总质量变大,C项正确;阴离子不能透过半透膜,D项错误。
7.空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。如图为RFC工作原理示意图,有关说法正确的是( )
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e-2H2↑+4OH-
C.d极上发生的电极反应是:O2+4H++4e-2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
答案:D
解析:a极接电源的负极,水中的H+得电子生成H2,d电极是氢氧燃料电池的负极,在该电极H2失去电子生成H+,b极上为OH-失电子,生成O2,A、B、C错误;b极产生的O2进入C极,C极上O2得电子发生还原反应,在酸性电解质溶液中O2+4H++4e-2H2O,D项正确。
二、非选择题(共3小题,共44分)
8.(12分)化学在能源开发与利用中起到十分关键的作用。甲烷是一种新型的绿色能源,又是一种重要的化工原料。甲烷燃料电池能量转化率高,具有广阔的发展前景,现用甲烷燃料电池进行如图实验(图中所用电极均为惰性电极)。
(1)电极b为 极,溶液中OH-移向 极。(填“a”或“b”)
- 5 -
(2)电极a处所发生的电极反应式为: 。
(3)乙装置中所发生的总反应方程式为: 。
(4)若图乙装置中盛有100 mL 0.2 mol·L-1 AgNO3溶液,当甲烷燃料电池中消耗氧气56 mL(标准状况下)时,则此时图乙装置中溶液的pH= (溶液体积变化忽略不计),d极增重 g。
答案:(1)正 a
(2)CH4+10OH--8e-CO32-+7H2O
(3)4AgNO3+2H2O4Ag+O2↑+4HNO3
(4)1 1.08
解析:(1)氧气在b电极发生还原反应,b是正极;原电池中阴离子移向负极,故溶液中OH-移向a电极。
(2)电极a上发生氧化反应,电极反应式为CH4+10OH--8e-CO32-+7H2O。
(3)用惰性电极电解硝酸银溶液,发生的总反应方程式为4AgNO3+2H2O4Ag +O2↑+4HNO3。
(4)消耗氧气56 mL(标准状况下)时,转移电子0.01 mol,根据电子守恒,乙池生成n(H+)=0.01 mol,c(H+)=0.1 mol·L-1,pH=1;d电极生成0.01 mol的银,质量为1.08 g。
9.(14分)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示:
回答下列问题:
(1)甲烷燃料电池负极的电极反应式为 。
(2)闭合K开关后,a、b电极上均有气体产生,其中b电极上得到的是 ,电解氯化钠溶液的化学方程式为 。
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为 (已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C,列式表示即可),最多能产生的氯气体积为 L(标准状况)。
(4)若如图所示U形管中氯化钠溶液的体积为800 mL。闭合K后,每个电池甲烷用量为0.224 L(标准状况),且反应完全。若产生的气体全部逸出,电解后溶液混合均匀,电解后U形管中溶液的pH为 。
答案:(1)CH4+10OH--8e-CO32-+7H2O
(2)H2 2NaCl+2H2O2NaOH+H2↑+Cl2↑
(3)1 L22.4 L·mol-1×8×6.02×1023 mol-1×1.60×10-19 C 4
(4)13
10.(18分)人类活动产生的CO2长期积累会威胁生态环境,其减排问题受到全世界的关注。
- 5 -
(1)将煤燃烧产生的二氧化碳回收利用,可达到降低碳排放的目的。图1是通过光电转化原理以廉价原料制备新产品的示意图。写出图示转化过程的化学反应方程式: 。连接催化剂a、b的导线上电子流动方向是 (填“a→b”或“b→a”)。
图1
图2
(2)高温电解技术可将释放的CO2转化为具有工业利用价值的产品。反应的化学方程式为CO2+H2OCO+H2+O2,其工作原理如图2所示,电极b上放出的气体X为 ,与电极b相连的Y极为外接电源的 (填“正”或“负”)极。
(3)工业上常用高浓度的K2CO3溶液吸收CO2得KHCO3溶液,再利用电解法使K2CO3溶液再生,其装置如图3所示,在阳极区附近发生的反应包括 和H++HCO3-CO2↑+H2O。
图3
答案:(1)2CO2+2H2O2HCOOH+O2 a→b
(2)O2 正
(3)4OH--4e-2H2O+O2↑
解析:(1)根据图1可知反应物是CO2和H2O,生成物是HCOOH和O2,然后配平得:2CO2+2H2O2HCOOH+O2,反应过程中H2O失去电子生成O2和H+,CO2得到电子后与H+结合转化为HCOOH,所以电子流动方向是a→b。
(2)根据图2可知电极a上,CO2和H2O得到电子生成CO和H2,电极a是阴极,所以电极b应该是阳极,连接外接电源的正极,电极反应是2O2--4e-O2↑。
(3)右侧为阳极区,生成物是O2和CO2,电极反应是4OH--4e-2H2O+O2↑和H++HCO3-CO2↑+H2O。
- 5 -
相关文档
- 天津专用2020高考化学二轮复习专题2021-07-075页
- 天津专用2020高考化学二轮复习专题2021-07-067页
- 天津专用2020高考化学二轮复习专题2021-07-067页
- 广西专用2020版高考化学二轮复习专2021-07-066页
- 广西专用2020版高考化学二轮复习专2021-07-056页
- 广西专用2020版高考化学二轮复习专2021-07-056页
- 天津专用2020高考化学二轮复习专题2021-07-036页
- 广西专用2020版高考化学二轮复习专2021-07-035页
- 天津专用2020高考化学二轮复习专题2021-07-035页
- 天津专用2020高考化学二轮复习专题2021-07-025页