- 923.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应速率和化学平衡状态
【学识静思一】
化学反应速率的概念及表示方法
1. 概念:化学反应速率是用来衡量化学反应进行快慢程度的物理量,通常用单位时间内
或 来表示。
说明:应注意这里所说的化学反应速率指的是平均反应速率,而不是瞬时反应速率。
一定温度下,锌粒在1 mol·L-1稀盐酸中的反应速率与反应时间的关系如右图所示,图像中的A点的斜
率就是在反应时间t1时刻的瞬时反应速率。
2. 数学表达式:如对于反应aA+bB cC+dD,v(A)= 。
单位:mol·L-1·s-1或mol·L-1·min-1或mol·L-1·h-1。
3. 关系:在同一个化学反应中,用不同物质表示该反应的化学反应速率时,数值可能不相同。对于反
应aA+bB cC+dD,用各物质表示的反应速率分别为v(A)、v(B)、v(C)、v(D),则v(A)∶v(B)∶v(C)∶
v(D)= 。
4. 同一反应在不同阶段的反应速率的变化
同一反应在不同反应阶段的反应速率一般是不同的,主要原因:反应物浓度的不断变化;而且反应所
引起的热量变化对反应速率也有较大影响。
5. 转化率:α= ×100%
有关反应过程中化学反应速率的计算
1. 反应速率计算的“三段式”模板
以反应4NH3(g)+3O2(g) 2N2(g)+6H2O(g)为例说明:
现向一容积不变的2 L密闭容器中充入4 mol NH3和3 mol O2,4 min后,测得生成的H2O占混合气体体积的
40%,则下列表示此段时间内该反应的平均速率不正确的是( )
A. v(N2)=0.125 mol·L-1·min-1 B. v(H2O)=0.375 mol·L-1·min-1
C. v(O2)=0.225 mol·L-1·min-1 D. v(NH3)=0.250 mol·L-1·min-1
【解析】 设4 min时,生成6x mol H2O(g),则
4NH3(g)+3O2(g) 2N2(g)+6H2O(g) n(总)
起始量/mol: 4 3 0 0 7
变化量/mol: 4x 3x 2x 6x
4 min量/mol: 4-4x 3-3x 2x 6x 7+x
据题意,则有: =0.4,解得x=0.5,
-反应物起始浓度 反应物反应后浓度
反应物起始浓度
6
7
x
x+
则4 min内H2O的变化浓度为Δc(H2O)= =1.5 mol·L-1,
v(H2O)= =0.375 mol·L-1·min-1,
再由各物质表示的速率之比等于各物质的化学计量数之比,可得各物质表示的反应速率分别为
v(N2)=0.125 mol·L-1·min-1, v(NH3)=0.250 mol·L-1·min-1,v(O2)=0.187 5 mol·L-1·min-1。
【答案】 C
2. 从图像中获取计算的数据
纵坐标可以是物质的量,也可以是物质的量浓度,横坐标是时间。
例如:某温度时,在定容(VL)容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如右下图所示。根据
图像可进行如下计算:
(1)求某物质的平均速率、转化率,如:
v(X)= mol·L-1·s-1,
Y的转化率= ×100%。
(2)确定化学方程式中的化学计量数之比,如:X、Y、Z三种物质的化学计量数之比为(n1-n3)∶(n2-n3)∶n2。
(3)在计算的时候还要注意两点:
①反应系统的体积是否为1 L,若不是1 L,在物质由物质的量转化为物质的量浓度的时候,要以c=n/V进行
转化;
②注意单位要一致,特别要看清楚时间是s还是min。
【冷静归纳】
1.化学反应速率大小的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,
而要进行一定的转化。
(1)看单位是否统一,若不统一,换算成相同的单位。
(2)换算成同一物质表示的速率,再比较数值的大小。
(3)比较化学反应速率与化学计量数的比值,即对于一般反应 aA+bB===cC+dD,比较
vA
a 与
vB
b ,若
vA
a
>
vB
b ,则 A 表示的反应速率比 B 的大。
2.对于较为复杂的关于反应速率的题目常采用以下步骤和模板计算
(1)写出有关反应的化学方程式。
(2)找出各物质的起始量、转化量、某时刻量。
(3)根据已知条件列方程式计算。
3
2
mol
L
-11.5
4
mol L
min
⋅
1 3
3
-
·
n n
V t
2 3
2
-n n
n
例如:反应 mA + nB pC
起始浓度(mol·L-1) a b c
转化浓度(mol·L-1) x
nx
m
px
m
某时刻浓度(mol·L-1) a-x b-
nx
m c+
px
m
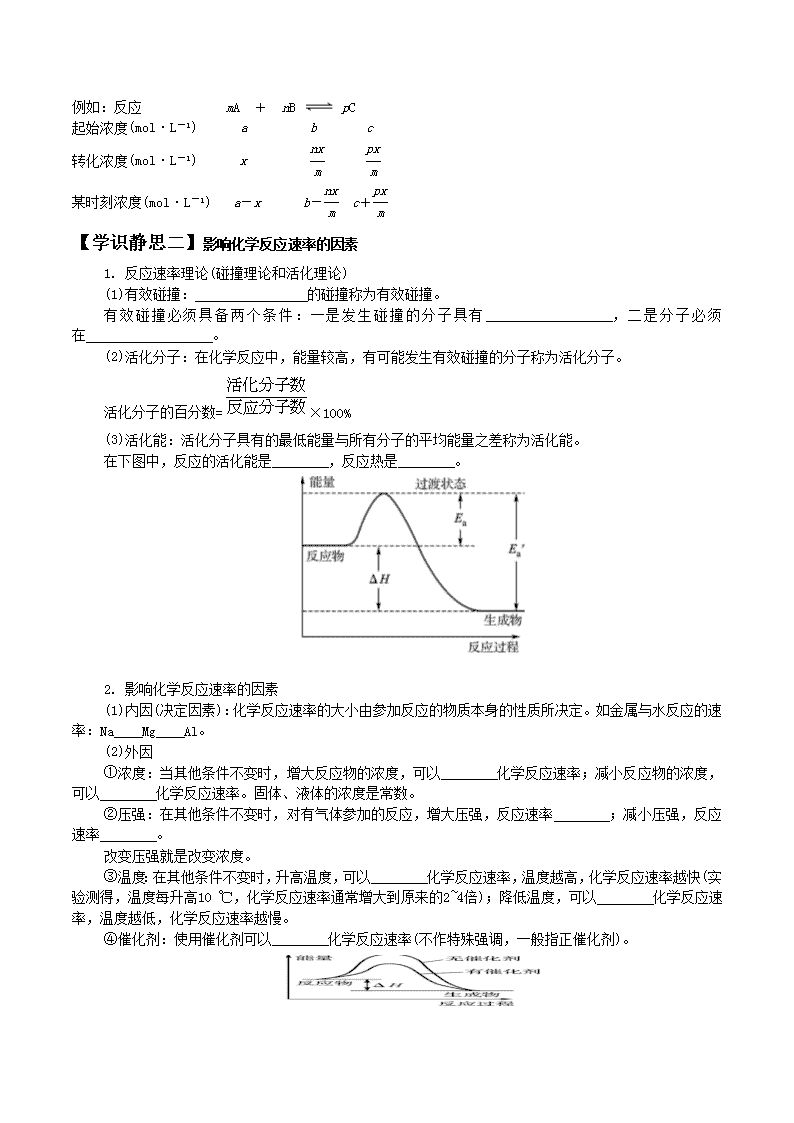
【学识静思二】影响化学反应速率的因素
1. 反应速率理论(碰撞理论和活化理论)
(1)有效碰撞: 的碰撞称为有效碰撞。
有 效 碰 撞 必 须 具 备 两 个 条 件 : 一 是 发 生 碰 撞 的 分 子 具 有 , 二 是 分 子 必 须
在 。
(2)活化分子:在化学反应中,能量较高,有可能发生有效碰撞的分子称为活化分子。
活化分子的百分数= ×100%
(3)活化能:活化分子具有的最低能量与所有分子的平均能量之差称为活化能。
在下图中,反应的活化能是 ,反应热是 。
2. 影响化学反应速率的因素
(1)内因(决定因素):化学反应速率的大小由参加反应的物质本身的性质所决定。如金属与水反应的速
率:Na Mg Al。
(2)外因
①浓度:当其他条件不变时,增大反应物的浓度,可以 化学反应速率;减小反应物的浓度,
可以 化学反应速率。固体、液体的浓度是常数。
②压强:在其他条件不变时,对有气体参加的反应,增大压强,反应速率 ;减小压强,反应
速率 。
改变压强就是改变浓度。
③温度:在其他条件不变时,升高温度,可以 化学反应速率,温度越高,化学反应速率越快(实
验测得,温度每升高10 ℃,化学反应速率通常增大到原来的2~4倍);降低温度,可以 化学反应速
率,温度越低,化学反应速率越慢。
④催化剂:使用催化剂可以 化学反应速率(不作特殊强调,一般指正催化剂)。
活化分子数
反应分子数
⑤反应物颗粒的大小即增大反应物之间的接触面积、构成微小原电池等也能影响反应速率。
【初试规窍】
1.按要求填空
(1)形状大小相同的铁、铝分别与等浓度的盐酸反应生成氢气的速率:铁______铝(填“大于”、“小于”或
“等于”)。
(2)对于 Zn+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不
变”)
①升高温度:________;
②增大盐酸浓度:__________;
③增大锌的质量:__________;
④保持浓度不变增加盐酸体积:____________;
⑤把锌片改成锌粉:____________;
⑥滴入几滴 CuSO4 溶液:____________;
⑦加入 NaCl 固体:____________;
⑧加入 CH3COONa 固体:____________;
⑨加入一定体积的 Na2SO4 溶液:____________。
(3)若把(2)中的稀盐酸改成“稀硝酸”或“浓硫酸”是否还产生 H2,为什么?
2.一定温度下,反应 N2(g)+3H2(g) 2NH3(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。
(填“增大”、“减小”或“不变”)
(1)缩小体积使压强增大:__________;
(2)恒容充入 N2:__________;
(3)恒容充入 He:__________;
(4)恒压充入 He:__________。
3.正误判断,正确的划“√”,错误的划“×”
(1)催化剂能降低反应所需的活化能,ΔH 也会发生变化
(2)温度、催化剂能改变活化分子的百分数
(3)对于反应 A+B C,改变容器体积,化学反应速率一定发生变化
(4)改变温度,使用催化剂,反应速率一定改变
(5)由于固体物质的浓度视为常数,所以固体反应物改变,化学反应速率一定不会发生变化
答案 1 (1)小于
(2)①增大 ②增大 ③不变 ④不变 ⑤增大 ⑥增大⑦不变 ⑧减小 ⑨减小
(3)不会产生 H2,Fe 和稀硝酸反应生成 NO;常温下,Fe 在浓硫酸中钝化。
答案 2 (1)增大 (2)增大 (3)不变 (4)减小 3.(×)(√)(×)(√)(×)
【冷静归纳】
气体反应体系中充入惰性气体(不参与反应)时对反应速率的影响
(1)恒容:充入“惰性气体”―→总压增大―→物质浓度不变(活化分子浓度不变)―→反应速率不变。
(2)恒压:充入“惰性气体”―→体积增大―→物质浓度减小(活化分子浓度减小)―→反应速率减小。
【学识静思三】可逆反应与化学平衡状态
1.可逆反应
(1)定义
在_______下既可以向正反应方向进行,同时又可以向逆反应方向进行的化学反应。
(2)特点
①二同:a.相同条件下;b.正、逆反应同时进行。
②一小:反应物与生成物同时存在;任一组分的转化率都_____(填“大于”或“小于”)100%。
任一组分的浓度都不为零。可逆反应不能进行到底。
2.化学平衡状态
(1)概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的物质的质量或浓度
保持不变的状态。
(2)化学平衡的建立
正反应为什么逐渐减少:
逆反应为什么逐渐增加:
达到平衡时反应物和生成物浓度都不为零。
3.借助速率—时间图像,判断化学平衡移动
1).概念
可逆反应达到平衡状态以后,若反应条件(如温度、压强、浓度等)发生了变化,平衡混合物中各组分的浓度
也会随之改变,从而在一段时间后达到新的平衡状态。这种由原平衡状态向新平衡状态的变化过程,叫做
化学平衡的移动。
2).化学平衡移动与化学反应速率的关系
(1)v 正>v 逆:平衡向__________移动。(2)v 正=v 逆:反应达到平衡状态,________平衡移动。
(3)v 正p+q
反应物 A 和 B 的转化率均增大
有多种反应物
的可逆反应
mA(g)+nB(g)
pC(g)+
qD(g)
同等倍数地增
大反应物 A、B
的量
恒温恒容条
件下
m+n< p+q 反应物 A 和 B 的转化率均减小
m+n=p+q 反应物 A 和 B 的转化率均不变
恒温恒压条件下 反应物转化率不变
m>n+p
反应物 A 的转化率
增大
m0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③
增加 CO 浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高 COCl2 转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
2.某温度下,在密闭容器中 SO2、O2、SO3 三种气态物质建立化学平衡后,改变条件对反应 2SO2(g)+O2(g)
2SO3(g) ΔH<0 的正、逆反应速率的影响如图所示:
(1)加催化剂对反应速率影响的图像是________(填序号,下同),平衡________移动。
(2)升高温度对反应速率影响的图像是__________,平衡向________方向移动。
(3)增大反应容器体积对反应速率影响的图像是________,平衡向________方向移动。
(4)增大 O2 的浓度对反应速率影响的图像是__________,平衡向________方向移动。
题组二
3.一定条件下,向一容积固定的密闭容器中通入 2 mol SO2 和 1 mol O2,发生 2SO2+O2 2SO3 Δ
H<0,一段时间后达到平衡,SO2、O2、SO3 的物质的量分别为 a mol、b mol、c mol,按要求回答下列问题。
(1)平衡后,通入 2molSO2,则 SO2 的转化率________,O2 的转化率________。(填“增大”“减小”或“不
变”,下同)
(2)平衡后,通入 2 mol SO2,1 mol O2,则 SO2 的转化率________,O2 的转化率________,SO2 的百分含量
________,O2 的百分含量__________,SO3 的百分含量__________。
(3)平衡后,通入 a mol SO2,b mol O2,c mol SO3,则 SO2 的转化率________,O2 的转化率________,SO2
的百分含量________,O2 的百分含量________,SO3 的百分含量________。
(4)平衡后,通入 2 mol SO3,则平衡向________(填“正反应”或“逆反应”)移动,SO2 的百分含量
________,O2 的百分含量________,SO3 的百分含量________。
(5)平衡后,升温,则 SO2 转化率________,O2 的转化率________,SO2 的百分含量________,O2 的百分含
量________,SO3 的百分含量________。
4.对于以下三个反应,从正反开始进行达到平衡后,保持温度、体积不变,按要求回答下列问题。
(1)PCl5(g) PCl3(g)+Cl2(g)
再充入 PCl5(g)平衡向________方向移动,达到平衡后,PCl 5(g)的转化率________,PCl 5(g)的百分含量
______。
(2)2HI(g) I2(g)+H2(g)
再充入 HI(g)平衡向________方向移动,达到平衡后,HI 的分解率________,HI 的百分含量________。
(3)2NO2(g) N2O4(g)
再充入 NO2(g),平衡向________方向移动,达到平衡后,NO 2(g)的转化率________,NO 2(g)的百分含量
________。
5.将等物质的量的 N2、H2 气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:N2(g)+3H2(g)
2NH3(g) ΔH<0。当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较
正确的是( )
改变条件 新平衡与原平衡比较
A 增大压强 N2 的浓度一定变小
B 升高温度 N2 的转化率变小
C 充入一定量 H2 H2 的转化率不变,N2 的转化率变大
D 使用适当催化剂 NH3 的体积分数增大
6.在一体积可变的密闭容器中,加入一定量的 X、Y,发生反应 mX(g) nY(g) ΔH=Q kJ·mol-1。反
应达到平衡时,Y 的物质的量浓度与温度、气体体积的关系如下表所示:
c(Y)/mol·L-1 温度/℃气体体积/L 1 2 4
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是( )
A.m>n B.Q<0 C.温度不变,压强增大,Y 的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
答案 1 B 答案 2 (1)C 不 (2)A 逆反应 (3)D 逆反应 (4)B 正反应
答案 3 (1)减小 增大 (2)增大 增大 减小 减小 增大 (3)增大 增大 减小 减小 增大 (4)
逆反应 减小 减小 增大 (5)减小 减小 增大 增大 减小
答案 4(1) 正反应 减小 增大 (2) 正反应 不变 不变 (3) 正反应 增大 减小
答案 5 B 答案 6 C
【学识静思四】等效平衡
1.含义和原理
在一定条件下(恒温恒容或恒温恒压),对同一可逆反应体系,______时加入物质的物质的量不同,而达到化
学平衡时,同种物质的百分含量________。
同一可逆反应,当外界条件一定时,反应无论从正反应开始,还是从逆反应开始,都能达到相同的平衡。
其中平衡混合物中各物质的含量________。
由于化学平衡状态与条件有关,而与建立平衡的______无关。因而,同一可逆反应,从不同的状态开始,
只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
2.规律
等效类型 ① ② ③
条件 恒温、恒容 恒温、恒容 恒温、恒压
反应的特点 任何可逆反应
反应前后气体分子数
相等
任何可逆反应
起始投料
换算为化学方程式同一
边物质,其“量”相同
换算为化学方程式同
一边物质,其“量”
符合同一比例
换算为化学方程式同
一边物质,其“量”
符合同一比例
质量分数
(w%)
相同 相同 相同
浓度(c) 相同 成比例 相同(气体)
平
衡
特
点 物质的量(n) 相同 成比例 成比例
3.等效平衡主要是比较起始状态
【冷静归纳】
构建恒温恒容平衡思维模式
1.新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
先平衡后加压模式
2.构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)
新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。先平衡后合并模式
【初试规窍】
1.在恒温恒容条件下,可逆反应:2A(g)+B(g) 3C(g)+D(g) ΔH=-Q1 kJ·mol-1(Q1>0),起始物质
的量如下表所示:
序号 A B C D
① 2 mol 1 mol 0 0
② 4 mol 2 mol 0 0
③ 1 mol 0.5 mol 1.5 mol 0.5 mol
④ 0 1 mol 3 mol 1 mol
⑤ 0 0 3 mol 1 mol
(1)上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
(2) 达 到 平 衡 后 , ① 放 出 的 热 量 为 Q2 kJ , ⑤ 吸 收 的 热 量 为 Q3 kJ , 则 Q1 、 Q2 、 Q3 的 定 量 关 系 为
________________。
2.在恒温恒容条件下,可逆反应:2A(g)+B(g) 3C(g)+D(s)起始物质的量如下表所示:
序号 A B C D
① 2 mol 1 mol 0 0
② 4 mol 2 mol 0 0
③ 1 mol 0.5 mol 1.5 mol 0.5 mol
④ 0 1 mol 3 mol 1 mol
⑤ 0 0 3 mol 1 mol
上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
3.在恒温恒压条件下,可逆反应 2A(g)+B(g) 3C(g)+D(g)起始物质的量如下表所示:
序号 A B C D
① 2 mol 1 mol 0 0
② 4 mol 2 mol 0 0
③ 1 mol 0.5 mol 1.5 mol 0.5 mol
④ 0 1 mol 3 mol 1 mol
⑤ 0 0 3 mol 1 mol
(1)上述反应达到平衡后,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
(2)达到平衡后,①放出的热量为 Q1 kJ,②放出的热量为 Q2 kJ,则 Q1 和 Q2 的定量关系为________。
答案 1 (1)①③⑤互为等效平衡。表现在达到平衡后物质的量、质量、体积、物质的量浓度、各组分百分
含量(物质的量分数、质量分数、体积分数)相同。 (2)Q2+Q3=Q1
答案 2 ①②③⑤互为等效平衡。表现在达到平衡后各组分百分含量(物质的量分数、质量分数、体积分数)
相同。
答案 3 (1)①②③⑤互为等效平衡。表现在达到平衡后物质的量浓度、各组分百分含量(物质的量分数、质
量分数、体积分数)相同。(2)Q2=2Q1
【组题试练】
题组一 1.对于以下三个反应,从正反应开始进行达到平衡后,保持温度、体积不变,按要求回答下列问
题。
(1)PCl5(g) PCl3(g)+Cl2(g)
再充入 PCl5(g)平衡向________方向移动,达到平衡后,PCl 5(g)的转化率________,PCl 5(g)的百分含量
______。
(2)2HI(g) I2(g)+H2(g)
再充入 HI(g)平衡向________方向移动,达到平衡后,HI 的分解率________,HI 的百分含量________。
(3)2NO2(g) N2O4(g)
再充入 NO2(g),平衡向________方向移动,达到平衡后,NO 2(g)的转化率________,NO 2(g)的百分含量
________。
题组二 2.恒温恒压下,在一个容积可变的密闭容器中发生反应:A(g)+B(g) C(g),若开始时通入 1 mol
A 和 1 mol B,达到平衡时生成 a mol C。则下列说法错误的是( )
A.若开始时通入 3 mol A 和 3 mol B,达到平衡时,生成的 C 的物质的量为 3a mol
B.若开始时通入 4 mol A、4 mol B 和 2 mol C,达到平衡时,B 的物质的量一定大于 4 mol
C.若开始时通入 2 mol A、2 mol B 和 1 mol C,达到平衡时,再通入 3 mol C,则再次达到平衡后,C 的物
质的量分数为 a
2-a
D.若在原平衡体系中,再通入 1 mol A 和 1 mol B,混合气体的平均相对分子质量不变
题组三 3.有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入 2 mol N2、3 mol
H2,反应 N2(g)+3H2(g) 2NH3(g)达到平衡时生成 NH3 的物质的量为 m mol。
(1)相同温度下,在乙中加入 4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,
生成 NH3 的物质的量为________mol(从下列各项中选择,只填字母,下同);若乙的容积与甲的容积始终相
等,乙中反应达到平衡时,生成 NH3 的物质的量为________mol。
A.小于 m B.等于 m
C.在 m~2m 之间 D.等于 2m E.大于 2m
(2)相同温度下,保持乙的容积为甲的一半,并加入 1 mol NH3,要使乙中反应达到平衡时,各物质的体积分
数与上述甲容器中达到平衡时相同,则起始时应加入______mol N2 和________mol H2。
4.工业合成氨反应为:N2(g)+3H2(g) 2NH3(g),对其研究如下:
(1)已知 H—H 键能为 436 kJ·mol-1,N—H 键能为 391 kJ·mol-1, 键的键能是 945.6 kJ·mol-
1,则上述反应的 ΔH= 。
(2)上述反应的平衡常数 K 的表达式为______________________________。若反应方程式改写为:
1
2N2(g)+3
2H2(g) NH3(g),在该温度下的平衡常数 K1= (用 K 表示)。
(3)在 773 K 时,分别将 2 mol N2 和 6 mol H2 充入一个固定容积为 1 L 的密闭容器中,随着反应的进行,
气体混合物中 n(H2)、n(NH3)与反应时间 t 的关系如下表:
t/min 0 5 10 15 20 25 30
n(H2)/mol 6.00 4.50 3.60 3.30 3.03 3.00 3.00
n(NH3)/mol 0 1.00 1.60 1.80 1.98 2.00 2.00
①该温度下,若向同容积的另一容器中投入的 N2、H2、NH3 的浓度分别为 3 mol·L-1、3 mol·L-1、3 mol·L
-1,则此时 v 正 v 逆(填“大于”、“小于”或“等于”)。
②由上述表中的实验数据计算得到“浓度—时间”的关系可用下图中的曲线表示,表示 c(N 2)—t 的曲线
是 。在此温度下,若起始充入 4 mol N2 和 12 mol H2,则反应刚达到平衡时,表示 c(H2)—t 的
曲线上相应的点为____________________________________。
答案 1(1) 正反应 减小 增大(2) 正反应 不变 不变(3) 正反应 增大 减小
答案 2 B 答案 3 (1)D E (2)0.5 0
答案 4 (1)-92.4 kJ·mol-1(2)K= c2(NH3)
c(N2)·c3(H2) K
1
2
或 K(3)①大于 ②乙 B
【实践出真知】
一、 单项选择题
1. (2015·上海卷改编)已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下
列说法正确的是( )
A. 加入催化剂,减小了反应的热效应 B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的化学方程式:H2O2 H2O+O2 D. 反应物的总能量高于生成物的总能量
2. (2014·安徽卷)臭氧是理想的烟气脱硝剂,其脱硝反应为2NO2(g)+O3(g) N2O5(g)+O2(g),反应在恒容
密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A B C D
升高温度,平衡
常数减小
0~2 s 内 , 反 应 速 率 为
v(NO2)=0.2 mol·L-1
t1时仅加入催化剂,
平衡正向移动
达到平衡时,仅改变
x,则x为c(O2)
2. (2015·四川卷)一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g) 2CO(g)。平
衡时,体系中气体体积分数与温度的关系如下图所示。
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法正确的是 ( )
A. 550 ℃时,若充入惰性气体,v正、v逆均减小,平衡不移动
B. 650 ℃时,反应达平衡后CO2的转化率为25.0%
C. T ℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925 ℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0p总
4. (2014·上海卷)只改变一个影响因素,平衡常数K与化学平衡移动的关系叙述错误的是( )
A. K值不变,平衡可能移动 B. K值变化,平衡一定移动
C. 平衡移动,K值可能不变 D. 平衡移动,K值一定变化
5. (2014·重庆卷)在恒容密闭容器中通入X并发生反应:2X(g) Y(g),温度T1、T2下X的物质的量浓度c(X)
随时间t变化的曲线如右图所示,下列叙述正确的是( )
A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,v(Y)= mol·L-1·min-1
C. M点的正反应速率v2大于N点的逆反应速率v1
D. M点时再加入一定量的X,平衡后X的转化率减小
6. (2015·天津卷)某温度下,在2 L的密闭容器中,加入 1 mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1 mol Z(g),再次达到平
衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A. m=2 B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1∶1 D. 第二次平衡时,Z的浓度为0.4 mol·L-1
7. (2015·广东模拟)可逆反应2M(g)+N(g) 2X(g),根据表中的数据可判断选项中图像错误的是( )
p1(MPa) p2(MPa)
400 ℃ 99.6% 99.7%
500 ℃ 96.9% 97.8%
A B C D
8. (2015·河南模拟)已知可逆反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1,若反应物
的起始物质的量相同,下列关于该反应的示意图不正确的是 ( )
A B
1
-a b
t
C D
9. 在密闭容器中进行反应:X(g)+3Y(g) 2Z(g),有关下列图像的说法不正确的是( )
图1 图2 图3 图4
A. 依据图1可判断该反应的正反应为放热反应
B. 在图2中,虚线可表示使用了催化剂
C. 若正反应的ΔH<0,图3可表示升高温度使平衡向逆反应方向移动
D. 由图4中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
二、 非选择题
10. (2015·河南周口质检)焦炭与CO、H2均是重要的能源,也是重要的化工原料。
(1) 已知C、H2、CO的燃烧热(ΔH)分别为-393.5 kJ·mol-1、-285.8 kJ·mol-1、-283 kJ·mol-1,又知水的
汽化热为+44 kJ·mol-1。
①焦炭与水蒸气反应生成CO、H2的热化学方程式为 。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7kJ时,则此时H2O(g)的转化率为 。
(2) 将焦炭与水蒸气置于容积为2 L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物
质的量随时间的变化曲线如右下图所示。
①第一个平衡时段的平衡常数是 ,若反应进行到2 min时,改变了温度,使曲线发生如右图所示
的变化,则温度变化为 (填“升温”或“降温”)。
②反应至5min时,若也只改变了某一个条件,使曲线发生如右图所示的变化,该条件可能是 (填字
母)。
a. 增加了C b. 增加了水蒸气 c. 降低了温度 d. 增大了压强
(3) 假设(2)中反应在第2 min时,将容器容积压缩至1 L,请在右图中绘制出能反映H2O、CO的物质的量变化
趋势的图像。
11.(2015·河南郑州模拟)二氧化锰是化学工业中常用的氧化剂和有机合成中的催化剂,其主要制备方法是
碳酸锰热分解,反应原理为2MnCO3+O2 2MnO2+2CO2。经研究发现该反应过程为①MnCO3 MnO+CO2↑、②
2MnO+O2 2MnO2。
回答下列问题:
(1) 某温度下该平衡体系的压强为p,CO2、O2的物质的量分别为n1和n2,用平衡分压代替平衡浓度,写出碳
酸锰热分解反应的平衡常数表达式K= (分压=总压×物质的量分数);K与反应①、②的平衡常数K1、
K2关系为 。
(2) 反应②在低温下能自发进行,则其ΔH (填“>”、“<”或“=”)0。
(3)某科研小组对碳酸锰热分解法制二氧化锰的条件(焙烧温度和气氛)进行了研究,获得如下三幅图。该制
备反应合适的焙烧温度为 ,合适的含水量气氛条件为 。
图1 在不同气氛中焙烧的反应效果 图2 反应温度与转化率的关系
图3 水分含量与转化率的关系
(4) 制备过程中会有副产物CO2产生,研究CO2的利用对促进低碳社会的构建具有重要意义。
①将CO2合成甲烷是碳减排的措施之一。
已知:CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41 kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73 kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171 kJ·mol-1
写出CO2与H2反应生成CH4和H2O的热化学方程式: 。
②以CO2为原料还可以合成多种物质。工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成,其反应的化学方
程式为 。当氨碳比 =3时,达平衡时CO2的转化率为60%,则NH3的平
衡转化率为 。
12. (2015·江西四校联考)合成氨实验中,在体积为3 L的恒容密闭容器中,投入4 mol N2和9 mol H2在一定条
件下合成氨,平衡时仅改变温度测得的数据如下表所示。
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能
量。
(1) T1 (填“>”、“<”或“=”)T2。
(2) 在T2 K时,经过10 min达到化学平衡状态,则0~10 min内H2的平均速率v(H2)= ,平衡时N2的
转化率α(N2)= 。
(3) 下列图像分别代表焓变(ΔH)、混合气体平均相对分子质量( )、N2体积分数[φ(N2)]和气体密度(ρ)
与反应时间的关系,其中正确且能表明该可逆反应达到平衡状态的是 (填字母)。
A B C D
【课后检测答案】
1. D 2.A 3.B 4.D 5. C 6. D 7.C 【解析】 根据表中数据可知同一压强下温度越高M的转化率越低,
则正反应为放热反应;根据化学方程式可知同一温度下压强越大M的转化率越高,则A、B正确;增大压强平
衡将向正反应方向移动,有v正>v逆,C错误;升高温度平衡将向逆反应方向移动,D正确。
8. C 9. D
10. (1) ①C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1 ②73%
(2) ①0.017 升温 ②b
3
2
(NH )
(CO )
n
n
M
(3)
【解析】
(2) ①根据图像可知,第一个平衡时段n(H2O)=1.2 mol,n(CO)=0.2 mol,根据方程式计算知n(H2)=0.2
mol,K= ≈0.017;观察图像知,2 min时改变条件后相同时间内H2O的消耗量和CO的生成量均增多,
表明反应速率加快,故升高温度。②改变条件的一瞬间,只有H2O的浓度增大而CO的浓度保持不变,故改变
的条件为增加水蒸气。
(3) 压缩容器容积的一瞬间,H2O、CO的物质的量没有变化,但随着压强增大,平衡将逆向移动,H2O的物质
的量增大而CO的物质的量减小,题目只要求能表示出变化的趋势,故不必考虑平衡时CO、H2O的物质的量具
体是多少。
11. (1) K= ·K2 (2) <
(3) 350 ℃ 含水量30%
(4) ①CO2(g)+4H2(g) CH4(g)+2H2O(g)
ΔH=-162 kJ·mol-1
②2NH3+CO2 CO(NH2)2+H2O 40%
【解析】 (1)根据题意和题给化学方程式知,p(CO2)= ,p(O2)= ,代入碳酸锰分解反应的平
衡常数表达式K= = ;K1=p(CO2),K2= ,K与K1、K2的关系为K= ·K2。
(2) 当ΔH-TΔS<0时反应自发进行,反应②为气体物质的量减少的反应,ΔS<0,且在低温下能自发进行,
则其ΔH<0。
(3) 根据图1知,在湿空气中反应速率快,碳酸锰的转化率高;根据图2知,反应在350 ℃时碳酸锰的转化率
最高;根据图3知,水分含量为30%时碳酸锰的转化率最高。
(4) ①将三个反应依次编号为①②③,②+③-①×2即可得到目标反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)
0.1 0.1
0.6
×
2
1
1 2 2
n
( )
p
n n n+ 2
1K
1
1 2
n p
n n+
2
1 2
n p
n n+
2
2
2
( )
( )
p CO
p O
2
1
1 2 2( )
pn
n n n+ 2
1
( )p O 2
1K
ΔH=(-73 kJ·mol-1 )+(-171 kJ·mol-1 )-(-41 kJ·mol-1)×2=-162 kJ·mol-1。
②设NH3的物质的量为3 mol,CO2的物质的量为1 mol,则达平衡时CO2转化了0.6 mol。
2NH3 +CO2 CO(NH2)2+H2O
起始/mol: 3 1 0 0
转化/mol: 1.2 0.6 0.6 0.6
则氨的平衡转化率为 ×100%=40%。
12. (1) < (2) 0.1 mol·L-1·min-1 25% (3) BC
【解析】 (1) T2到T1变化时,氨气的物质的量增大,说明平衡正向移动,而正反应是放热反应,所以是降
低温度,则T1
相关文档
- 2021届高考化学一轮复习化学反应速2021-07-0815页
- 2019届一轮复习化学实验常用仪器和2021-07-0816页
- 2020届高考化学一轮复习化学反应速2021-07-086页
- 2020届高考化学一轮复习化学资源的2021-07-0815页
- 2020届高考化学一轮复习化学计量在2021-07-0811页
- 2020届高考化学一轮复习化学反应与2021-07-088页
- 2020届高考化学一轮复习化学反应中2021-07-089页
- 2020届高考化学一轮复习化学实验常2021-07-0828页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-088页
- 2020届高考化学一轮复习化学反应与2021-07-0821页