- 1.07 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年高考一轮复习 化学工艺流程
教材版本 全国通用 课时说明(建议) 2 课时
知识点 化学工艺流程
复习目标
1、对中学化学基础知识进行正确的复述、再现、辨认,并能融会贯通。
2、将实际问题分解,通过运用相关知识,采用分析、综合的方法,解决简单化学问题。
3、将分析和解决的过程及成果,能够正确地运用化学术语及文字等进行表达,并做出
合理的解释。
4、从提供的新信息中,准确地提取实质性内容,并与已有知识整合,重组为新知识块。
复习重点
1、了解工艺流程题型特点。
2、理解工艺流程解题思路。
3、理解化学反应原理在工艺流程中的综合运用。
4、掌握常见的工艺流程考查内容。
复习难点 工艺流程解题策略
一、自我诊断 知己知彼
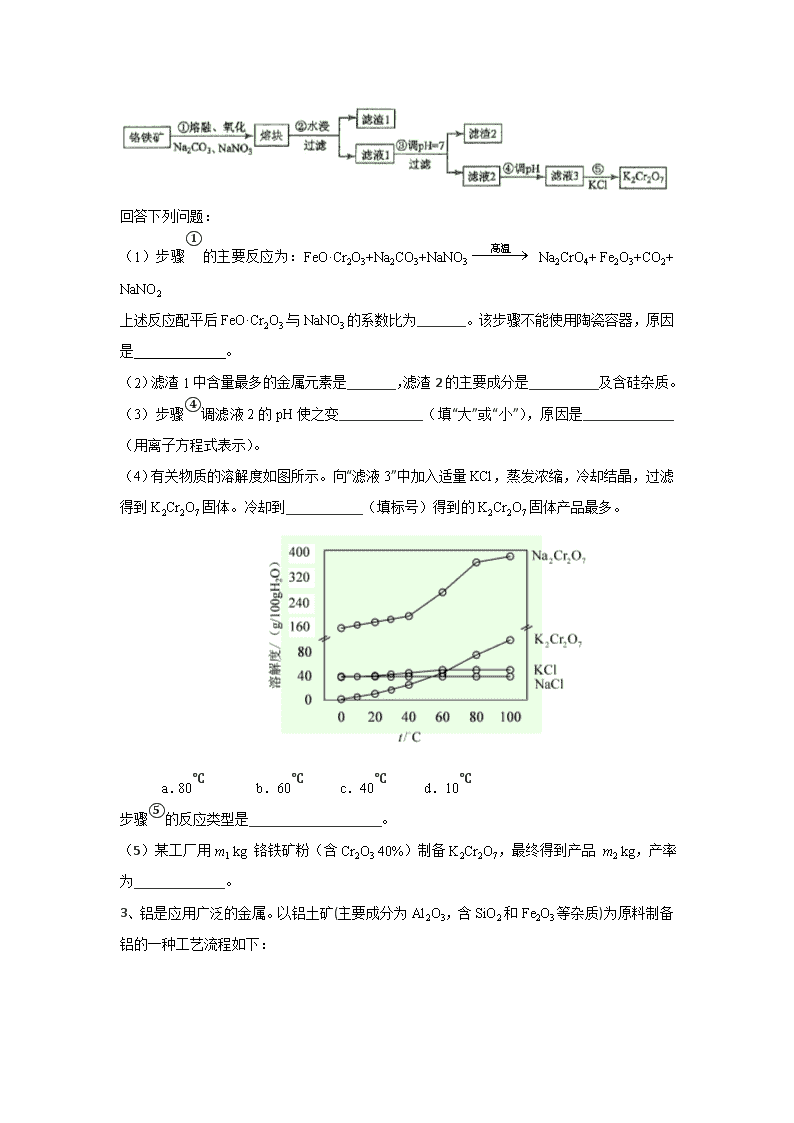
1、以工业生产硼砂所得废渣硼镁泥为原料制取 MgSO4·7H2O 的过程如图所示:
硼镁泥的主要成分如下表:
MgO SiO2 FeO、Fe2O3 CaO Al2O3 B2O3
30%~40% 20%~25% 5%~15% 2%~3% 1%~2% 1%~2%
回答下列问题:
(1)“酸解”时应该加入的酸是_______,“滤渣 1”中主要含有_________(写化学式)。
(2)“除杂”时加入次氯酸钙、氧化镁的作用分别是 、 。
(3)判断“除杂”基本完成的检验方法是 。
(4)分离滤渣 3 应趁热过滤的原因是 。
2、重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为 FeO·Cr2O3,
还含有硅、铝等杂质。制备流程如图所示:
酸解 过滤 除杂 过滤 浓缩过滤 浓缩结晶 MgSO4·7H2O硼镁泥
浸渣 1 滤 渣
2
Ca(ClO)2、MgO 滤 渣
3
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr 2O3+Na2CO3+NaNO3 Na2CrO4+ Fe2O3+CO2+
NaNO2
上述反应配平后 FeO·Cr2O3 与 NaNO3 的系数比为_______。该步骤不能使用陶瓷容器,原因
是 。
(2)滤渣 1 中含量最多的金属元素是_______,滤渣 2 的主要成分是__________及含硅杂质。
(3)步骤④调滤液 2 的 pH 使之变____________(填“大”或“小”),原因是_____________
(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液 3”中加入适量 KCl,蒸发浓缩,冷却结晶,过滤
得到 K2Cr2O7 固体。冷却到___________(填标号)得到的 K2Cr2O7 固体产品最多。
a.80℃
b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用 m1 kg 铬铁矿粉(含 Cr2O3 40%)制备 K2Cr2O7,最终得到产品 m2 kg,产率
为_____________。
3、铝是应用广泛的金属。以铝土矿(主要成分为 Al2O3,含 SiO2 和 Fe2O3 等杂质)为原料制备
铝的一种工艺流程如下:
→高温
0
40
80
120
160
200
240
0 20 40 60 80 100
2 2 7Na Cr O
2 2 7K Cr O
KCl
NaCl
/ Ct
160
240
320
400
0
溶
解
度
/
(
g
/
1
0
0
g
H
2
O
)
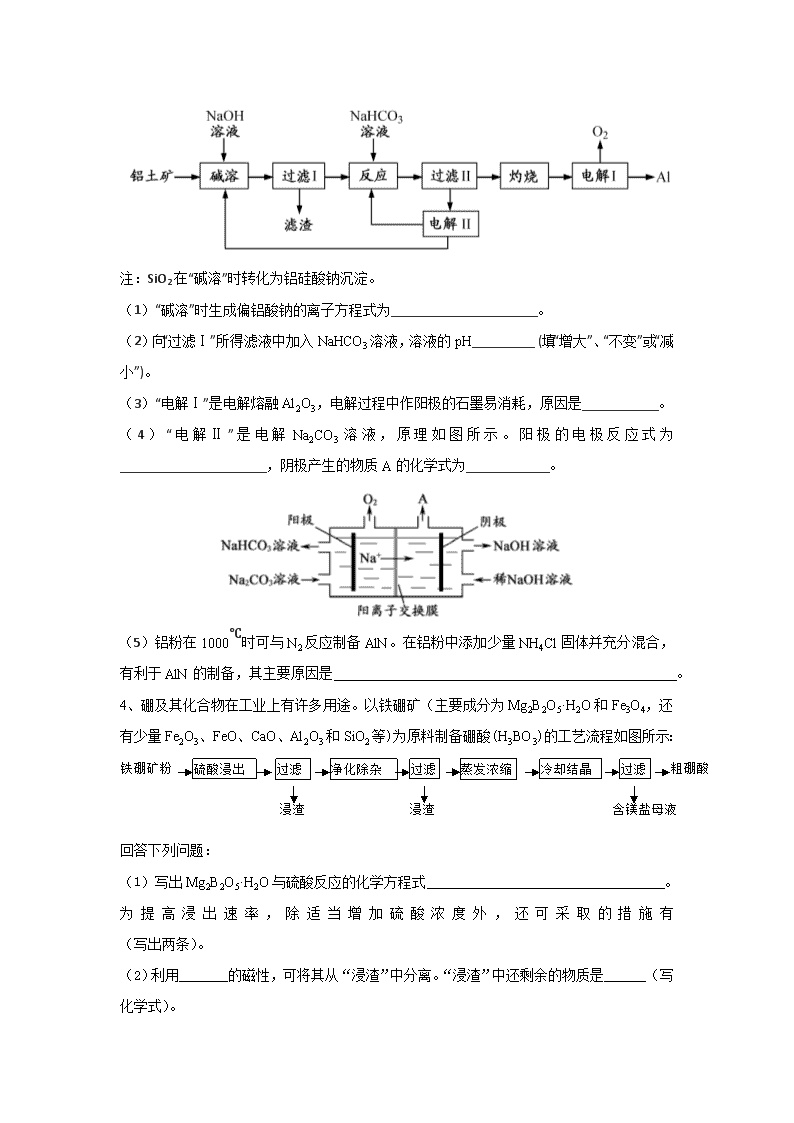
注:SiO2 在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入 NaHCO3 溶液,溶液的 pH_________ (填“增大”、“不变”或“减
小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
( 4 ) “ 电 解 Ⅱ ” 是 电 解 Na2CO3 溶 液 , 原 理 如 图 所 示 。 阳 极 的 电 极 反 应 式 为
_____________________,阴极产生的物质 A 的化学式为____________。
(5)铝粉在 1000℃时可与 N2 反应制备 AlN。在铝粉中添加少量 NH4Cl 固体并充分混合,
有利于 AlN 的制备,其主要原因是 。
4、硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为 Mg2B2O5·H2O 和 Fe3O4,还
有少量 Fe2O3、FeO、CaO、Al2O3 和 SiO2 等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(1)写出 Mg2B2O5·H2O 与硫酸反应的化学方程式 。
为 提 高 浸 出 速 率 , 除 适 当 增 加 硫 酸 浓 度 外 , 还 可 采 取 的 措 施 有
(写出两条)。
(2)利用_______的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是______(写
化学式)。
硫酸浸出 过滤 净化除杂 过滤 蒸发浓缩 冷却结晶 过滤铁硼矿粉 粗硼酸
浸渣 浸渣 含镁盐母液
(3)“净化除杂”需先加 H2O2 溶液,作用是 。然后再调节
溶液的 pH 约为 5,目的是 。
(4)“粗硼酸”中的主要杂质是________(填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为
_______。
(6)单质硼可用于生产具有优良抗冲击性能硼钢。以硼酸和金属镁为原料可制备单质硼,
用化学方程式表示制备过程 。
5、孔雀石主要成分是 Cu2(OH)2CO3,还含少量 FeCO3 及 Si 的化合物,实验室以孔雀石
为原料制备硫酸铜晶体的步骤如下:
(1)步骤Ⅰ中涉及的反应用离子方程式表示为 .
(2)步骤Ⅱ中试剂①是 (填代号).
a.KMnO4 b.H2O2 c.Fe 粉 d.KSCN
(3)步骤Ⅲ加入 CuO 的目的是 .
(4)步骤Ⅳ获得硫酸铜晶体,需要经过 、 、过滤等操作.
(5)孔雀石与焦炭一起加热可以生成 Cu 及其它无毒物质,写出该反应的化学方程
式 .
(6)测定硫酸铜晶体(CuSO4•xH2O)中结晶水的 x 值:称取 2.4g 硫酸铜晶体,加热至质
量不再改变时,称量粉末的质量为 1.6g.则计算得 x= (计算结果精确到 0.1)。
【参考答案】
1、(1)H2SO4 SiO2 (2)将 Fe2+氧化为 Fe3+ 调节溶液 pH,使 Fe3+、Al3+以氢氧化物
的形式沉淀除去 (3)取滤液将其酸化后滴加 KSCN 溶液,若溶液未变红,则说明除杂完
全 (4)防止 MgSO4·7H2O 结晶析出
2、(1)2∶7 陶瓷在高温下会与 Na2CO3 反应 (2)铁 Al(OH)3
(3)小 2 +2H+ +H2O (4)d 复分解反应 (5) ×100%
3、(1)Al2O3+2OH−=2AlO2-+H2O (2)减小 (3)石墨电极被阳极上产生的 O2 氧化
(4)4CO32-+2H2O−4e−=4HCO3-+O2↑ H2
(5)NH4Cl 分解产生的 HCl 能够破坏 Al 表面的 Al2O3 薄膜
2
4CrO − 2
2 7Cr O − 2
1
190
147
m
m
4、(1)Mg2B2O5·H2O+2H2SO4 2MgSO4+2H3BO3;提高反应温度、减小铁硼矿粉粒径
(2)Fe3O4; SiO2 和 CaSO4;(3)将 Fe2+氧化为 Fe3+;使 Fe3+与 Al3+形成氢氧化物沉淀而
除去
(4)(七水)硫酸镁 (5) (6)2H 3BO3 B2O3+3H2O B2O3+3Mg 2B
+3MgO
5、(1)Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
(2)b;(3)消耗酸使溶液 pH 升高,便于 Fe3+形成沉淀除去;(4)加热浓缩;冷却结晶;
(5)Cu2(OH)2CO3+C 2Cu+2CO2↑+H2O;(6)4.4
【解析】
1、(1)流程制备的是 MgSO4·7H2O,为了不引入杂质,因此所用的酸是硫酸,化学式为 H2SO4;
根据硼镁泥的成分,SiO2 不与硫酸反应,因此滤渣 1 为 SiO2;
(2)硼镁泥中含有 FeO,与硫酸反应后生成 FeSO4,次氯酸钙具有强氧化性,能把 Fe2+氧
化成 Fe3+,氧化镁的作用是调节 pH,使 Al3+和 Fe3+以氢氧化物形式沉淀出来,除去 Fe3+
和 Al3+;
(3)除杂是除去的 Fe3+和 Al3+,因此验证 Fe3+就行,方法是取滤液将其酸化后滴加 KSCN
溶液,若溶液未变红,则说明除杂完全;
(4)防止 MgSO4·7H2O 结晶析出。
2、(1)FeO·Cr2O3 是还原剂,完全氧化为 Na2CrO4 和 Fe2O3,每摩转移 7mol 电子,而 NaNO3
是氧化剂,还原产物为 NaNO2,每摩转移 2mol 电子,根据电子守恒可知,FeO·Cr 2O3 和
NaNO3 系数比为 2:7;陶瓷在高温下会与 Na2CO3 反应,则熔融时不能使用陶瓷容器;
(2)熔块中氧化铁不溶于水,过滤后进入滤渣 1,则滤渣 1 中含量最多的金属元素是铁;
滤液 1 中含有 AlO2-、SiO32-及 CrO42-,调节溶液 pH 并过滤后得滤渣 2 为 Al(OH)3;
(3)滤液 2 调节 pH 的目的是提高溶液的酸性,pH 变小;因为溶液中存在 2CrO42-+2H+
Cr2O72-+H2O,增大溶液中 H+浓度,可促进平衡正向移动,提高溶液中 Cr2O72-的浓度;
( 4 ) 由 图 示 可 知 , 在 10℃ 左 右 时 , 得 到 K2Cr2O7 的 固 体 最 多 , 故 答 案 为 d ;
2KCl+Na2Cr2O7=K2Cr2O7↓+2NaCl 的反应类型为复分解反应;
(5)样品中 Cr2O3 的质量为 m1×40%Kg,则生成 K2Cr2O7 的理论质量为 m1×40%Kg× ,294
152
则所得产品的产率为 m2Kg÷(m1×40%Kg× )×100%= ×100%。
3、(1)氧化铝为两性氧化物,可溶于强碱溶液生成偏铝酸钠和水,离子方程式为
Al2O3+2OH-=2AlO2-+H2O 。
(2)为了提高铝土矿的浸取率,氢氧化钠溶液必须过量,所以过滤 I 所得滤液中含有氢氧
化钠,加入碳酸氢钠溶液后,氢氧化钠与碳酸氢钠发生反应生成碳酸钠和水,所以溶液的 pH
减小。
(3)电解 I 过程中,石墨阳极上氧离子被氧化为氧气,在高温下,氧气与石墨发生反应生
成气体,所以,石墨电极易消耗的原因是被阳极上产生的氧气氧化。
(4)由图中信息可知,生成氧气的为阳极室,溶液中水电离的 OH-放电生成氧气,破坏了
水 的 电 离 平 衡 , 碳 酸 根 结 合 H+ 转 化 为 HCO3- , 所 以 电 极 反 应 式 为
4CO32-+2H2O-4e-=4HCO3-+O2↑,阴极室氢氧化钠溶液浓度变大,说明水电离的 H+放电生成
氢气而破坏水的电离平衡生成大,所以阴极产生的物质 A 为 H2 。
(5)铝在常温下就容易与空气中的氧气反应生成一层致密的氧化膜。氯化铵受热分解产生
的氯化氢能够破坏铝表面的氧化铝薄膜,所以加入少量的氯化铵有利于 AlN 的制备。
4、(1)硫酸可与硼酸盐反应制取酸性较弱的硼酸,所以 Mg2B2O5·H2O 与硫酸反应的化学方
程式为:Mg2B2O5·H2O+2H2SO4=2MgSO4+2H3BO3。为提高浸出速率,除适当增加硫酸浓
度外,还可采取提高反应温度、减小铁硼矿粉粒径等措施。
(2)Fe3O4 有磁性,可利用其磁性将其从“浸渣”中分离;“浸渣”中还剩余的物质是 SiO2 和
CaSO4。
(3)“净化除杂”需先加 H2O2 溶液,其作用是把 Fe2+氧化为 Fe3+,然后调节溶液的 pH 约
为 5,使 Al3+和 Fe3+以 Al(OH)3、Fe(OH)3 形式沉降而除去。
(4)“粗硼酸”中所含杂质主要是没有除去的易溶性镁盐,故为(七水)硫酸镁。
(5)硼氢化钠的电子式为 。
(6)利用 Mg 的还原性制取硼的化学方程式为 2 H3BO3 B2O3+3 H2O、B2O3+3Mg
2B+3MgO。
5、孔雀石的主要成分为 Cu2(OH)2CO3,还含少量 FeCO3、Si 的化合物,加入稀硫酸反应
后生成二氧化碳气体,过滤得到二氧化硅固体,得到滤液 1 为硫酸铜、硫酸亚铁溶液,“除
杂”时先通入足量过氧化氢将 Fe2+氧化成 Fe3+,得到溶液 2 为硫酸铜、硫酸铁溶液,再加入
294
152
2
1
190
147
m
m
CuO 固体调节溶液 pH,沉淀铁离子生成氢氧化铁沉淀;过滤得到滤液为硫酸铜溶液,滤液
3 为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体;
(1)孔雀石的主要成分为 Cu2(OH)2CO3,还含少量 FeCO3、Si 的化合物,步骤Ⅰ中涉及
的反应是 Cu2(OH)2CO3 和 FeCO3 与硫酸发生复分解反应生成二氧化碳,反应的化学方程
式为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
故答案为:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O,FeCO3+2H+=Fe2++CO2↑+H2O;
(2)步骤Ⅱ中加入试剂①的目的是氧化亚铁离子为铁离子,便于沉淀除去,所加试剂能和
亚铁离子反应且不能引入新的杂质,
a.KMnO4 溶液加入后,能氧化亚铁离子,但会引入钾离子、锰离子,故 a 不符合;
b.加入 H2O2 会氧化亚铁离子为铁离子,过氧化氢被还原为水,不引入杂质,故 b 符合;
c.Fe 粉不能氧化亚铁离子,故 c 不符合;
d.加入 KSCN 溶液结合铁离子形成络合物,不能氧化亚铁离子,亚铁离子的存在会干扰硫
酸铜晶体的析出,故 d 不符合;故答案为:b;
(3)步骤Ⅲ加入 CuO 目的是和酸反应,调节溶液的 PH 使铁离子全部沉淀,故答案为:消
耗酸使溶液 pH 升高,便于 Fe3+形成沉淀除去;
(4)操作Ⅳ是溶液中得到溶质的方法是蒸发浓缩、冷却结晶、过滤洗涤;故答案为:加热
浓缩;冷却结晶;
(5)孔雀石与焦炭一起加热可以生成 Cu、二氧化碳和水,依据原子守恒配平书写得到的化
学方程式为:Cu2(OH)2CO3+C 2Cu+2CO2↑+H2O;
故答案为:Cu2(OH)2CO3+C 2Cu+2CO2↑+H2O;
(6)称取 2.4g 硫酸铜晶体,加热至质量不再改变时,称量粉末的质量为 1.6g 为硫酸铜质量,
n(CuSO4)物质的量= =0.01mol,受热质量减少 2.4g﹣1.6g=0.8g,水的物质的量
= =0.044mol;
二、温故知新 夯实基础
1、工艺流程题型特点
2、工艺流程主线与核心
3、原料预处理常用方法及其作用
研磨:减小矿物的粒径,增大接触面积,加快反应速率;提高原料利用率;
溶解:通常用酸溶,如用硫酸、盐酸等。
①水浸:与水接触反应或溶解
②水洗:除去水溶性杂质
③酸浸(或酸洗):在酸溶液中反应使可溶性金属离子进入溶液,不溶物通过过滤除去的溶解
过程;有时可抑制某些物质的水解
④碱浸(或碱洗)——除去油污或氧化膜;溶解铝和二氧化硅
注意:碱浸过程包括碳酸盐等碱性物质
⑤醇浸:增大某物质的溶解度,便于反应,如苯甲酸
⑥灼烧、焙烧、煅烧:不易转化的物质转为容易提取的物质;其他矿(如 FeCO3)转化为氧
化物;除去有机物;除去热不稳定的杂质
4、制备过程中反应条件的控制
①加热——加快反应速率;加速固体溶解;平衡向吸热方向移动。若在制备过程中出现一些
受热易分解的物质或产物,则要注意对温度的控制。
②降温(冰水中)——防止某物质在高温时会溶解(或分解);使化学反应速率下降;为使
化学平衡向放热的方向移动;保持反应物为液态,减小汽化损耗,如冷凝回流。
③控温——温度过高,物质会分解(如过氧化氢)或挥发(如氨水);温度过低,物质无法
挥发或者反应。
④趁热过滤——防止某物质降温时会析出。(注意趁热过滤操作需要提纯的物质有时在滤液
中有时在晶体中,需要视情况而定)
⑤调 pH 值除杂——控制溶液的酸碱性使其中某些金属离子形成氢氧化物沉淀。
调节 pH 所需的物质一般应满足两点:能与 H+反应,使溶液 pH 值增大;不引入新杂质。
所以通常加所保留阳离子对应的氧化物,氢氧化物,碳酸盐等。
5、无机工艺常用分离方法
(1)过滤:分离难溶物和溶液,根据特殊需要采用趁热过滤或者抽滤等方法。
(2)萃取和分液:利用溶质在互不相溶的溶剂里的溶解度不同提取分离物质,如用 CCl4 或
苯萃取溴水中的溴。
(3)蒸发结晶:提取溶解度随温度变化不大的溶质,如 NaCl。
(4)蒸发浓缩,冷却结晶:提取溶解度随温度变化较大的溶质、易水解的溶质(通常在酸
性氛围中进行,以抑制金属离子的水解)或结晶水合物,如 KNO3、FeCl3、CuCl2、CuSO4·5H2O、
FeSO4·7H2O 等。
(5)蒸馏或分馏:分离沸点不同且互溶的液体混合物,如分离乙醇和甘油。
注意:分馏一般是多组分分离,如石油的分馏;蒸馏一般是两组分分离,或者溶剂和溶质分
离过程,如海水蒸馏制备淡水,乙醇加氧化钙后蒸馏以除去乙醇中的水。
(6)冷凝法:利用气体易液化的特点分离气体,如合成氨工业采用冷却法分离氨气与氮气、
氢气。
6、无机工艺常用净化提纯方法
(1)趁热过滤:通过溶质的溶解度与温度之间的关系,将其分离,通常目的是防止某些物
质降温时析出。
注意:趁热过滤所得产物有时候在滤液中,有时候在晶体中,需要视情况而定。
(2)冰水洗涤:洗去晶体表面的杂质离子,并减少晶体在洗涤过程中的溶解损耗。
(3)乙醇洗涤:利用乙醇易挥发的性质带走晶体(沉淀)表面的水分,利于干燥;降低晶
体的溶解度,提高原料利用率或产率(该条作用一般是在题干给出某物质微溶于乙醇的时候
答出)
7、无机工艺常见文字叙述答题示例及需要考虑的角度
1. “浸出”步骤中,为提高镁的浸出率,可采取的措施有:
答:适当提高反应温度,增加浸出时间,适当增加硫酸的浓度,搅拌
注意:一般不考虑催化剂问题
2.如何提高吸收液和 SO2 反应速率:
答:适当提高温度、增大吸收液或 NaClO3 的浓度、增大 SO2 与吸收液的接触面积或搅
拌,使用多空球泡等
3.从溶液中得到晶体:
答:蒸发浓缩-冷却结晶-过滤-洗涤-干燥
4.过滤用到的三个玻璃仪器:答:普通漏斗、玻璃棒、烧杯
5.过滤后滤液仍然浑浊的可能的操作原因:
答:玻璃棒下端靠在滤纸的单层处,导致滤纸破损;漏斗中液面高于滤纸边缘
6.沉淀洗涤操作:
答:用玻璃棒引流,往漏斗中(工业上改为往过滤器中)加入蒸馏水至浸没沉淀,待水
自然流下后,重复以上操作 2-3 次
注意:通常是用蒸馏水洗涤,但有时候为了减小固体物质的溶解度,采用乙醇洗涤,需
要结合题干考虑
7.检验沉淀 Fe(OH)3 是否洗涤干净(含 SO42-):
答:取最后一次洗涤液,加入 BaCl2 溶液,若有白色沉淀则说明未洗涤干净,若无白色
沉淀则说明洗涤干净
注意:检验沉淀是否洗涤干净,沉淀是否沉淀完全,所加试剂是否过量等都是检验溶液
中的可溶性离子,同时注意题目问的是“是否”还是证明肯定的一方。
8.如何从 MgCl2·6H2O 中得到无水 MgCl2:
答:在干燥的 HCl 气流中加热。原因:干燥的 HCl 气流中抑制了 MgCl2 的水解,且带走
MgCl2·6H2O 受热产生的水汽
注意:有时候题干用的是 SO2Cl2 这种能够和结晶水反应生成 HCl 气体的物质,有时候用
能够分解产生 HCl 气体的物质,无论什么,都是抑制金属离子的水解,在答题过程中需要
具体化。
10.CuCl2 中混有 Fe3+加何种试剂调 pH 值:
答:CuO、Cu(OH)2、CuCO3、Cu2(OH)2CO3。原因:加 CuO 消耗溶液中的 H+的,促进
Fe3+的水解,生成 Fe(OH)3 沉淀析出
11.调 pH 值使得 Cu2+(4.7-6.2)中的 Fe3+(2.1-3.2)沉淀,pH 值范围是:
答:3.2-4.7。原因:调节溶液的 pH 值至 3.2-4.7,使 Fe3+全部以 Fe(OH)3 沉淀的形式析
出而 Cu2+不沉淀,且不会引入新杂质
12.固体粗产品进一步提纯的操作:
答:重结晶
13.趁热过滤的原因及操作:
答:减少过滤时间、保持过滤温度,防止××杂质析出或防止降温过程中××析出而损耗;
注意:前面已经提过,趁热过滤所得物质有时候在滤液中,有时候在固体物质中,需要
结合题干信息,但通常都是防止××析出。
14.水浴加热的好处:答:受热均匀,温度可控,且温度不超过 100℃
15.减压蒸发(小心烘干):
答:常压蒸发温度过高,××易分解;或者减压蒸发降低了蒸发温度,可以防止××分解
16.Mg(OH)2 沉淀中混有 Ca(OH)2 应怎样除去:
答:加入 MgCl2 溶液,充分搅拌,过滤,沉淀用蒸馏水水洗涤
17.蒸发浓缩用到的主要仪器有 、 、烧杯、酒精灯等
答:蒸发皿、玻璃棒。还有取蒸发皿用坩埚钳
18.不用其它试剂,检查 NH4Cl 产品是否纯净的方法及操作是:
答:加热法;取少量氯化铵产品于试管底部,加热,若试管底部无残留物,表明氯化铵
产品纯净
19.检验 NH4+的方法是:
答:取××少许于试管中,加入浓 NaOH 溶液,加热,生成的气体能使润湿的红色石蕊
试纸变蓝。
20.过滤的沉淀欲称重之前的操作:
答:过滤,洗涤,干燥,(在干燥器中)冷却,称重
21.“趁热过滤”后,有时先往滤液中加入少量水,加热至沸,然后再“冷却结晶”:
答:稀释溶液,防止降温过程中××析出,提高产品的纯度
22.苯甲酸的重结晶中粗苯甲酸全部溶解后,再加入少量蒸馏水的目的:
答:为了减少趁热过滤过程中损失苯甲酸,一般再加入少量蒸馏水
23.加 NaCl 固体减低了过碳酸钠的溶解度,原因:
答:Na+浓度显著增加抑止了过碳酸钠的溶解
24.检验 Fe(OH)3 是否沉淀完全的试验操作是:
答:取少量上层清液或过滤后的滤液,滴加几滴 KSCN 溶液,若不出现血红色,则表
明 Fe(OH)3 沉淀完全。
25.检验滤液中是否含有 Fe3+的方法是:
答:滴入少量 KSCN 溶液,若出现血红色,则证明有 Fe3+ (或加 NaOH,根据情况而
定)或者滴加亚铁氰化钾(K4[Fe(CN)6])溶液,若出现蓝色沉淀,证明含有 Fe3+
26.检验溶液中是否含有 Fe2+(当溶液不含 Fe3+)的方法是:
答:(任选一种即可)
①滴加几滴高锰酸钾溶液,若高锰酸钾溶液紫红色褪去,则证明有 Fe2+
②先滴加 KSCN 溶液,溶液不变血红色,在滴加氯水,溶液变成血红色,证明含有 Fe2+
③滴加铁氰化钾(K3[Fe(CN)6])溶液,若生成蓝色沉淀,证明含有 Fe2+
三、典例剖析 思维拓展
考点一 工艺物质的制备
例 1Li4Ti5O12 和 LiFePO4 都是锂离子电池的电极材料,可利用钛铁矿(主要成分为 FeTiO3,
还含有少量 MgO、SiO2 等杂质)来制备,工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出
率为 70%时,所采用的实验条件为___________________。
(2 )“ 酸浸” 后,钛主要以 形式存在,写出相应反应的离子方程
式__________________。
(3)TiO2·xH2O 沉淀与双氧水、氨水反应 40 min 所得实验结果如下表所
示:
温度/℃ 30 35 40 45 50
TiO2·xH2O 转化率% 92 95 97 93 88
分析 40 ℃时 TiO2·xH2O 转化率最高的原因__________________。
(4)Li2Ti5O15 中 Ti 的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中 ,加入双氧水和磷酸(设溶液体积增加 1 倍),
使 恰好沉淀完全即溶液中 ,此时是否有 Mg3(PO4)2 沉淀生
成? (列式计算)。FePO4、Mg3(PO4)2 的 Ksp 分别为 。
(6)写出“高温煅烧②”中由 FePO4 制备 LiFePO4 的化学方程式 。
【答案】
(1)100℃、2h,90℃,5h
(2)FeTiO3+ 4H++4Cl− = Fe2+ + + 2H2O
(3)低于 40℃,TiO2·xH2O 转化反应速率随温度升高而增加;超过 40℃,双氧水分解与氨
气逸出导致 TiO2·xH2O 转化反应速率下降
(4)4
(5)Fe3+ 恰 好 沉 淀 完 全 时 , c( )= mol·L−1=1.3×10–17 mol·L−1 ,
c3(Mg2+)×c2( ) = (0.01)3×(1.3×10–17)2=1.7×10–40 < Ksp [Mg3(PO4)2] , 因 此 不 会 生 成
Mg3(PO4)2 沉淀。
(6)2FePO4 + Li2CO3+ H2C2O4 2LiFePO4+ H2O↑+ 3CO2↑
【解析】
高温
2
4TiOCl −
2 1(Mg ) 0.02mol Lc + −= ⋅
3Fe + 3 5 1(Fe ) 1.0 10 mol Lc + − −= × ⋅
22 241.3 10 1.0 10− −× ×、
2
4TiOCl −
3
4PO −
22
5
1.3 10
1.0 10
−
−
×
×
3
4PO −
(1)由图示可知,“酸浸时铁的净出率为 70%时所需要的时间最短,速率最快,则应选择在
100C、2h,90oC,5h 下进行;
(2)“酸浸时用盐酸溶解 FeTiO3 生成 TOC142-时,发生反应的高子方程式为
FeTiO3+4H++4Cl-=Fe2++TiOC142-+2H2O
(3)温度是景响速率的主要因素,但 H2O2 在高温下易分解、氨水易挥发,即原因是低于 40oC,
Ti02·xH2O 转化反应速率随温度升高而增加;超过 40oC,双氧水分解与氨气逸出导致
TiO2·xH2O 转化反应速率下降;
(4) Li2Ti5O15 中 Li 为+1 价,0 为-2 价,Ti 为+4 价,过氧根(O22-)中氧元素显-1 价,设过
氧键的数目为 x;根据正负化合价代数和为 0,可知(+1)×2+(+4)×5+(-2)×(15-2x)+(-1)×2x=0,
解得:x=4;
(5)Ksp[FePO4]=c(Fe3+)×c(PO43-)=1.3×10-2,则 c(PO43-)=Ksp/c(Fe2+)=1.3×10-17mol/L,
Qc[Mg3(PO4)2]=c(Mg2+)3×c(PO43-)2=(0.01)3×(1.3×10-17)2=1.69×10-40<1.0×10-34 则无沉淀。
(6)高温下 FePO4 与 Li2CO3 和 H2C2O4 混合加热可得 LiFePO4,根据电子守恒和原子守恒
可得此反应的化学方程式为 2FePO4+Li2CO3+H2C2O4 2LiFePO4+H2O+3CO2↑。
【易错点】常见元素的化学性质、工艺流程路线分析、Ksp 的运用、化学反应方程式的书写
【方法点拨】平时注重积累和梳理工艺路程路线和答题技巧
例 2 已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为 Ni,含有一
定量的 Al2O3、FeO、SiO2、CaO 等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的 pH 见表中数据:
金属离子 Fe3+ Fe2+ Al3+ Ni2+
开始沉淀的 pH 1.1 5.8 3.0 6.8
完全沉淀的 pH 3.2 8.8 5.0 9.5
②Ksp(CaF2)=1.46×10-10;
③当某物质浓度小于 1.0×10-5 mol·L-1 时,视为完全沉淀。
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:________________。
(2)试剂 a 是一种绿色氧化剂,写出“氧化”时反应的离子方程式:_____。
高温
(3)“调 pH”时 pH 的调控范围为________,试用化学反应原理的相关知识解释滤渣Ⅱ的生
成:__________________________________。
(4)写出“沉镍”时发生反应的离子方程式:______________________,证明 Ni2+已经沉淀
完全的实验步骤及现象是_______________________,当 Ca 2+ 沉淀完全时,溶液中 c(F
-)>____________mol·L-1(写出计算式即可)。
(5)操作 a 的内容是__________________________________。
【答案】
(1)把废镍催化剂粉碎(或适当加热、适当增大酸的浓度或提高搅拌速率等)
(2)2Fe2++2H++H2O2===2Fe3++2H2O
(3)5.0≤pH<6.8 加入 Ni(OH)2 消耗溶液中的 H+,促使铁离子、铝离子的水解平衡右移,
使铁离子、铝离子转化为相应的沉淀
( 4 ) Ni2 + + C2O2-4 + 2H2O===NiC2O4·2H2O↓ 取 适 量 上 层 清 液 于 试 管 中 , 继 续 滴 加
(NH4)2C2O4 溶液,无沉淀生成 1.46 × 10-10
1.0 × 10-5
(5)过滤、洗涤、干燥
【解析】
(1)把废镍催化剂粉碎,或适当加热、适当增大酸的浓度或提高搅拌速率等都可以提高酸
浸速率。
(2)试剂 a 是过氧化氢,反应的离子方程式为 2Fe2++2H++H2O2===2Fe3++2H2O。
(3)因为铁、铝是以氢氧化铁和氢氧化铝的形式沉淀下来的,并且不能使镍离子形成沉淀,
故 pH 范围为 5.0≤pH<6.8;加入 Ni(OH)2 消耗溶液中的氢离子,促使铁离子、铝离子的水解
平衡向右移动,使铁离子、铝离子转化为相应的沉淀而除去。
(4)加入草酸铵后生成的固体是 NiC2O4·2H2O,因此有水参加反应,故反应的离子方程式
为 Ni2++C2O2-4 +2H2O===NiC2O4·2H2O↓。若镍离子没有完全沉淀,则继续加入草酸铵,仍
会有沉淀生成,所以证明 Ni2+已经沉淀完全的操作及实验现象是:取适量上层清液于试管
中,继续滴加(NH4)2C2O4 溶液,无沉淀生成。钙离子沉淀完全的标志是溶液中钙离子的物质
的量浓度小于 1.0×10-5 mol·L-1,结合 CaF2 的 Ksp 可求出 c(F-)> 1.46 × 10-10
1.0 × 10-5 mol·L-1。
(5)从溶液中分离出晶体需要进行过滤、洗涤、干燥。
【易错点】工艺流程路线不清楚、元素知识不熟悉
【方法点拨】归纳工艺路程中生产条件的控制、分离、提纯等相关技巧
考点二 工艺物质的分离、提纯、净化
例 1 以硅藻土为载体的五氧化二钒(V2O5)是接触法生产硫酸的催化剂。从废钒催化剂中
回收 V2O5 既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 V2O5 V2O4 K2SO4 SiO2 Fe2O3 Al2O3
质量分数/% 2.2~2.9 2.8~3.1 22~28 60~65 1~2 <1
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
(1)“酸浸”时 V2O5 转化为 VO2+,反应的离子方程式为___________,同时 V2O4 转成
VO2+。“废渣 1”的主要成分是__________________。
(2)“氧化”中欲使 3 mol 的 VO2+变为 VO2+,则需要氧化剂 KClO3 至少为______mol。
(3)“中和”作用之一是使钒以 V4O124-形式存在于溶液中。“废渣 2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+V4O124- R4V4O12+4OH−(以 ROH
为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH 4VO3 )沉淀,写出“煅烧”中发生反应的化学方程式
____________。
【答案】
(1)V2O5+2H+=2VO2++H2O;SiO2 (2)0.5 (3)Fe(OH)3 和 Al(OH)3 (4)碱
(5)K+ (6)2NH4VO3 V2O5+H2O↑+2NH3↑
【解析】
本题是工艺流程问题,涉及氧化还原反应方程式的书写、步骤的分析、氧化还原反应的计算、
元素及其化合物的性质等知识,将理论应用于实践来解决实际问题。
(1)“酸浸”时 V2O5 转化为 VO2+,V 元素化合价不变,说明不是氧化还原反应,根据原子
守恒可知反应的离子方程式为 V2O5+2H+=2VO2++H2O;二氧化硅与酸不反应,则“废渣
1”的主要成分是二氧化硅。
(2)“氧化”中欲使 3 mol 的 VO2+变为 VO2+,V 元素化合价从+4 价升高到+5 价,而氧化
剂 KClO3 中氯元素化合价从+5 价降低到-1 价,则根据电子得失守恒可知需要氯酸钾的物
KClO3
废钒
催化剂
V2O5
H2SO4 KOH 淋洗液 NH4Cl
废渣 1 废渣 2 流出液
浸液 离子
交换酸浸 氧化 中和 洗脱 沉钒 煅烧
质的量为少 3mol÷6=0.5mol。(3)“中和”作用之一是使钒以 V4O124-形式存在于溶液中,同
时生成氢氧化铁、氢氧化铝沉淀,则“废渣 2”中含有 Fe(OH)3 和 Al(OH)3。
(4)根据方程式可知,为了提高洗脱效率,反应应该向你反应方向进行,因此淋洗液应该
呈碱性。
(5)由于前面加入了氯酸钾和氢氧化钾,所以“流出液”中阳离子最多的是钾离子。
(6)根据原子守恒可知偏钒酸铵(NH4VO3)“煅烧”生成五氧化二钒、氨气和水,反应的化
学方程式为 2NH4VO3 V2O5+H2O↑+2NH3↑。
【易错点】离子反应方程式的书写、氧化还原反应相关计算、元素常见性质
【方法点拨】熟练掌握得失电子、电荷守恒等运用
例 2 某科研小组采用如下方案回收一种光盘金属层中的少量 Ag(金属层中其他金属含量过
低,对实验的影响可忽略)。
已知:
①NaClO 溶液在受热或酸性条件下易分解,如:3NaClO 2NaCl+NaClO3
②AgCl 可溶于氨水:AgCl+2NH3·H2O Ag(NH3) 2++ Cl− +2H2O
③常温时 N2H4·H2O(水合肼)在碱性条件下能还原 Ag(NH3)2+:
4Ag(NH3) 2++N2H4·H2O 4Ag↓+N2↑+4NH4++4NH3↑+H2O
(1)“氧化”阶段需在 80℃条件下进行,适宜的加热方式为__________________。
(2)NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2 ,该反应的化学方程式为
________________。 HNO3 也能氧化 Ag,从反应产物的角度分析,以 HNO3 代替 NaClO 的
缺点是____________________。
(3)为提高 Ag 的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,并_______________________。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加 10%氨水,则需要增加氨水的用量,
除因过量 NaClO 与 NH3·H2O 反应外(该条件下 NaClO3 与 NH3·H2O 不反应),还因为
_____________________。
(5)请设计从“过滤Ⅱ”后的滤液中获取单质 Ag 的实验方案:________________________(实
验中须使用的试剂有:2 mol·L−1 水合肼溶液,1 mol·L−1H2SO4)。
【答案】
(1)水浴加热
(2)4Ag+4NaClO+2H2O 4AgCl+4NaOH+O2↑会释放出氮氧化物(或 NO、NO2 ),造成
环境污染
(3)将洗涤后的滤液合并入过滤Ⅱ的滤液中
(4)未过滤掉的溶液会稀释加入的氨水,且其中含有一定浓度的 Cl−,不利于 AgCl 与氨水
反应
(5)向滤液中滴加 2 mol·L−1 水合肼溶液,搅拌使其充分反应,同时用 1 mol·L−1 H2SO4 溶
液吸收反应中放出的 NH3,待溶液中无气泡产生,停止滴加,静置,过滤、洗涤,干燥。
【解析】
分析题中的实验流程可知,第一步氧化是为了把光盘中的少量银转化为氯化银,氯化银难溶
于水,过滤后存在于滤渣中;第三步溶解时,氨水把氯化银溶解转化为银氨配离子,最后进
过一系列操作还原为银。
(1)“氧化”阶段需要再 80℃条件下进行,由于加热温度低于水的沸点,所以适宜的加热方
式为水浴加热。
(2)因为已知 NaClO 溶液与 Ag 反应的产物为 AgCl、NaOH 和 O2,用化合价升降法即可
配平该反应的化学方程式为 4Ag+4NaClO+2H2O=4AgCl+4NaOH+O2↑。 HNO3 也能氧化 Ag,
硝酸做氧化剂时通常被还原为有毒的氮的氧化物而污染环境,所以以 HNO3 代替 NaClO 的
缺点是会释放出氮氧化物(或 NO、NO2 ),造成环境污染。
(3)为提高 Ag 的回收率,需对“过滤Ⅱ”的滤渣进行洗涤,洗涤的目的是为了把滤渣表面
残存的银氨配离子洗涤下来,并将洗涤后的滤液合并入过滤Ⅱ的滤液中。
(4)若省略“过滤Ⅰ”,直接向冷却后的反应容器中滴加 10%氨水,则需要增加氨水的用量,
除因过量 NaClO 与 NH3·H2O 反应外,还因为未过滤掉的溶液会稀释加入的氨水,氨水的浓
度变小,且其中含有一定浓度的 Cl−,不利于 AgCl 与氨水发生 AgCl+2NH3·H2O Ag(NH3)
2++ Cl− +2H2O 反应 ,使得银的回收率变小。
(5)“过滤Ⅱ”后的滤液含有银氨配离子,根据题中信息常温时 N2H4·H2O(水合肼)在碱性条
件下能还原 Ag(NH3) 2+ ;4 Ag(NH3) 2++N2H4·H2O=4Ag↓+ N2↑+ 4NH4++ 4NH3↑+H2O ,所
以首先向该滤液中加入水合肼把银氨配离子充分还原,由于该反应产生所气体中含有氨气,
氨气有强烈的刺激性气味会污染空气,所以要设计尾气处理措施,可以用题中提供的、要求
必须使用的硫酸作尾气吸收剂把氨气吸收。最后把反应混合物静置、过滤、洗涤、干燥即可
得到回收的银。具体方案如下:向滤液中滴加 2mol·L−1 水合肼溶液,搅拌使其充分反应,
同时用 1 mol·L−1 H2SO4 溶液吸收反应中放出的 NH3 ,待溶液中无气泡产生,停止滴加,静
置,过滤、洗涤,干燥。
【易错点】新知识的提取和运用、实验方案的设计
【方法点拨】平时注意新知识提取和运用的技巧
四、举一反三 成果巩固
考点一 工艺物质的制备
1.NaClO2 是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2 中 Cl 的化合价为__________。
(2)写出“反应”步骤中生成 ClO2 的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去 Mg2+和 Ca2+,要加入的试剂分
别为__________、__________。“电解”中阴极反应的主要产物是 。
(4)“尾气吸收”是吸收“电解”过程排出的少量 ClO2,此吸收反应中,氧化剂与还原剂的物
质的量之比为__________,该反应中氧化产物是 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化
能力相当于多少克 Cl2 的氧化能力。NaClO2 的有效氯含量为 。
(计算结果保留两位小数)。
【答案】(1)+3 (2)2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4 (3)NaOH;
Na2CO3;NaClO2 (4)2:1,O2(5)1.57
【解析】(1)NaClO2 中 Na 为+1 价,O 为-2 价,计算可得 Cl 的化合价为 。
(2)由流程图可知反应物为 H2SO4、SO2 和 NaClO3,产物为 ClO2 和 NaHSO4,根
据氧化还原化合价升降守恒进行配平,可得方程式
2NaClO3+SO2+H2SO4===2ClO2+2NaHSO4:
(3)粗盐提纯过程,主要考虑除去杂质离子,且不引入新的杂质,故加入 NaOH 除去
Mg2+、加入 Na2CO3 除去 Ca2+;电解食盐水并加入 ClO2,产物中有 NaClO2 生成,
由于阴极发生还原反应,所以应该是 ClO2 在阴极被还原生成 NaClO2。
3+
(4)根据尾气吸收过程中加入的反应物和生成物,写出氧化还原反应方程式并配平,可得:
2ClO2+2NaOH+H2O2=2NaClO2+O2+2H2O2。其中氧化剂为 ClO2,还原剂为 H2O2,
氧化剂与还原剂的比值为 2:1,该反应的氧化产物为 O2。
(5)“有效氯含量”的定义是每克含氯消毒剂的氧化能力相当于多少克 Cl2 的氧化能力。其
实就是求相同质量的 NaClO2 和 Cl2 在还原为 Cl-时,转移的电子数之比。1mol
NaClO2 还原为 Cl-时转移 4mol 电子,1mol Cl2 还原为 Cl-时转移 2mol 电子,也就是
说每摩尔 相当于 。即 90.5g NaClO2 相当于 142gCl2,即“有效氯含
量”= (保留两位小数)。
2.二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问題:
(1)工业上可用 KC1O3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,该反应氧化剂与还原剂物质
的量之比为 。
(2)实验室用 NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备 ClO2:
①电解时发生反应的化学方程式为 。
②溶液 X 中大量存在的阴离子有__________。
③除去 ClO2 中的 NH3 可选用的试剂是 (填标号)。
a.水 b.碱石灰 c.浓硫酸 d.饱和食盐水
(3)用右图装置可以测定混合气中 ClO2 的含量:
Ⅰ.在锥形瓶中加入足量的碘化钾,用 50mL 水溶解后,再加入 3mL 稀硫
酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用 0.1000mol·L-1 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I- +S4O62-),
指示剂显示终点 时共用去 20.00 mL 硫代硫酸钠溶液。在此过程中:①锥形瓶内 ClO2 与碘
化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
2NaClO 22molCl
142 1.5790.5
=
③V 中加入的指示剂通常为 ,滴定至终点的现象是
。
④测得混合气中 ClO2 的质量为 g。
(4)用 ClO2 处理过的饮用水会含有一定最的亚氯酸盐。若要除去超标的亚氯酸盐,下列物
质最适宜的是 _______(填标号)。
a.明矾 b.碘化钾 c.盐酸 d.硫酸亚铁
【答案】
(1)2:1 (2)①NH4Cl+2HCl 3H2↑+NCl3 ②Cl—、OH— ③c
(3)①2ClO2+10I-+8H+=2Cl-+5I2+4H2O ②吸收残余的二氧化氯气体(避免碘的
逸出)
③淀粉溶液;溶液由蓝色变为无色,且半分钟内溶液颜色不再改变 ④0.02700
(4)d
【解析】
(1)工业上可用 KC1O3 与 Na2SO3 在 H2SO4 存在下制得 ClO2,在反应中氯元素的化合价从
+5 价降低到+4 价,得到 1 个电子,氯酸钾是氧化剂。S 元素的化合价从+4 价升高到+6 价,
失去 2 个电子,亚硫酸钠是还原剂,则根据电子得失守恒可知该反应中氧化剂与还原剂物质
的量之比为 2:1。
①根据流程图可知电解时生成氢气和 NCl3,则电解时发生反应的化学方程式为 NH4Cl+
2HCl
3H2↑+NCl3。
②NCl3 与 NaClO2 反应生成 ClO2、NH3 和氯化钠、NaOH,反应的离子反应为
NCl3+3H2O+6ClO2-=6ClO2↑+3Cl-+3OH-+NH3↑,溶液中应该存在大量的氯离子和氢氧根离子。
③a、ClO2 易溶于水,不能利用水吸收氨气,a 错误;b、碱石灰不能吸收氨气,b 错误;c、
浓硫酸可以吸收氨气,且不影响 ClO2,c 正确;d、ClO2 易溶于水,不能利用饱和食盐水吸
收氨气,d 错误,答案选 c。
(2)①ClO2 具有强氧化性,通入锥形瓶与酸性碘化钾溶液反应,氧化 I—为 I2,自身被还原
为 Cl—,同时生成水,反应离子方程式为 2ClO2+10I-+8H+=2Cl-+5I2+4H2O。②由于
二氧化氯是气体,容易挥发到空气中,所以玻璃液封装置的作用是吸收残余的二氧化氯气体。
③由于碘遇淀粉显蓝色,则 V 中加入的指示剂通常为淀粉,滴定至终点的现象是溶液由蓝
色变为无色且半分钟内不变色。④根据方程式可知 2ClO2~5I2~10S2O32-,则测得混合气中
ClO2 的质量为 0.1mol/L×0.02L×67.5g/mol/5=0.02700 g。
(4)亚氯酸盐具有氧化性,明矾不能被氧化,碘化钾被氧化为碘,盐酸可能被氧化氯气,
因此若要除去超标的亚氯酸盐,最适宜的是硫酸亚铁,且产生的氧化产物铁离子能净水。
考点二 工艺物质的分离、提纯、净化
1.水泥是重要的建筑材料。水泥的主要成分 CaO、SiO2,并含有一定量的铁、铝和镁等金属
氧化物,实验室测定水泥样品中钙含量的过程如下图所示
回答下列问题
(1)再分解水泥样品的过程中,以盐酸为溶剂,氯化铵为助溶剂,还需要加入几滴硝酸。
加入硝酸的目的是: ;还可使用 代替硝酸。
(2)沉淀 A 的主要成分: ,其不溶于强酸但可与一种弱酸反应,该反应的化学反应方
程式:
(3)加氨水过程中加热的目的是 ,沉淀 B 的主要成分为 、
(填化学式)
(4)草酸钙沉淀经稀 H2SO4 处理后,用 KMnO4 标准溶液滴定,通过测定草酸的量可间接
获知钙的含量,滴定反应为:MnO4- + H+ + H2C2O4 → Mn2+ + CO2 + H2O。实验中称取 0.400g
水泥样品,滴定时消耗了 0.0500mol/L 的 KMnO4 溶液 36.00mL,则该水泥样品中钙的质量
分数为:
【答案】
(1)将 Fe2+氧化为 Fe3+ H2O2
(2)SiO2 SiO2 + HF = SiF4 ↑+ H2O
(3)防止胶体生成,易沉淀分离 Al(OH)3 Fe(OH)3
(4)45%
【解析】
(1)铁离子在 pH 较小时易生成沉淀,加入硝酸可氧化亚铁离子生成铁离子,避免引入新
杂质;双氧水能氧化 Fe2+氧化为 Fe3+,且不会引入杂质,故还可用过氧化氢代替硝酸;
水泥
样品
氯化铵
盐酸、硝酸
沉淀 A
滤液
加热
氨水 PH4--5 沉淀 B
滤液
草 酸 铵 溶
液 草酸钙
硫酸 KMnO4
法测定
(2)沉淀 A 为 SiO2,不溶于强酸但可与一种弱酸反应,应为与 HF 的反应,化学方程式为:
SiO2+4HF=SiF4↑+2H2O;
(3)滴加氨水,溶液呈碱性,此时不用考虑盐类水解的问题,加热的目的是促进 Fe3+与 Al3+
水解,生成的沉淀主要是 Al(OH)3、Fe(OH)3;
(4)根据得失电子守恒,可得出反应的关系式为 5Ca2+~5H2C2O4~2KMnO4,则
n(KMnO4)=0.0500mol/L×36.00×10-3L=1.80×10-3mol,则
n(Ca2+)=1.80×10-3mol×52=4.50×10-3mol,水泥中钙的质量分数为
4.5×10−3mol×40.0g/mol0.400g×100%=45.0%。
2.碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(主要含有 TeO2、少量 Ag、Au)
为原料制备单质碲的一种工艺流程如下:
已知 TeO2 微溶于水,易溶于较浓的强酸和强喊。
(1)“碱浸”时发生反应的离子方程式为____________________。
(2)碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是______________。
(3)“沉碲”时控制溶液的 pH 为 4.5〜5.0,生成 TeO 2 沉淀。酸性不能过强,其原因是
_______________;防止局部酸度过大的操作方法是_________。
(4)“酸溶”后,将 SO2 通人 TeCl4 酸性溶液中进行“还原”得到碲,该反应的化学方程式是
__________。
(5)25°C 时,亚碲酸(H2TeO3) 的 Ka1=1×10-3,Ka2=2×10-8。
①0.1 mol·L-1 H2TeO3 电离度 α 约为_____________。(α= ×100%)
②0.lmol • L-1 的 NaH TeO3 溶液中,下列粒子的物质的量浓度关系正确的是___________。
A.c(Na+ )>c(HTeO3- )>c(OH-)>c(H2TeO3)>c(H+ )
B.c(Na+) + c( H+) >= c(HTeO3- ) +c(TeO32-) +c(OH- )
C.c(Na+ ) =c(TeO32-) +c( HTeO3-) + c( H2TeO3)
D.c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-)
【答案】
弱电解质分子总数
已电离弱电解质分子数
阳极泥 碱浸 过滤 酸溶TeO2过滤沉碲 还原 碲
SO2HClH2SO4NaOH
阳极泥 碱浸 酸溶TeO2过滤沉碲 还原 碲
TeO2+2OH-=TeO32-+H2O 3Ag +4HNO3 = 3AgNO3 +NO↑+2H2O 溶液酸性过强,TeO2 会
继 续 与 酸 反 应 导 致 碲 元 素 损 失 缓 慢 加 入 H2SO4 , 并 不 断 搅 拌
TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4 10% C D
【解析】根据 TeO2 微溶于水,易溶于较浓的强酸和强喊,加碱溶过滤除去杂质,得到
Na2TeO3 溶液,再加硫酸沉降经过滤得到 TeO2 沉淀,再用盐酸溶解生成四氯化碲,再
用二氧化硫还原制成碲单质
(1)TeO2 微溶于水,易溶于较浓的强酸和强喊,是两性氧化物,与氢氧化钠发生类似氧化
铝与氢氧化钠的反应;
(2)Ag 溶于稀硝酸生成硝酸银和 NO;
(3)因为 TeO2 是两性氧化物,H2SO4 过量会导致 TeO2 继续与 H2SO4 反应导致损失;
(4)SO2 将 TeCl4 还原成 Te,本身被氧化成 SO42- ,因此有 TeCl4+SO2→Te+H 2SO4+
HCl,根据化合价的升降法进行配平,即 TeCl4+2SO2→Te+2H2SO4+4HCl,反应物中
缺 少 8 个 H 和 4 个 O , 即 缺 少 4 个 H2O , 反 应 方 程 式 为 :
TeCl4+2SO2+4H2O=Te+4HCl+2H2SO4 ;
(5)①亚碲酸是二元弱酸,以第一步电离为主,H 2TeO3 HTeO3-+H +,根据
Ka1=c(HTeO3-)×c(H+)/c(H2TeO3),代入数值,求出 c(H+)=0.01mol·L -1,即转化率为
0.01/0.1×100%=10%;②A、NaHTeO3 的水解平衡常数 Kh=Kw/Ka1=1×10-14/1×10-3=10
-11<2×10-8,此溶液应显酸性,即 c(OH-)>c(H+),故 A 错误;B、根据电荷守恒,应
是 c(Na+) + c( H+) = c(HTeO3- ) +2c(TeO32-) +c(OH- ),故 B 错误;C、根据物料守
恒,因此有:c(Na+ ) =c(TeO32-) +c( HTeO3-) + c( H2TeO3),故 C 正确;D、根据质子
守恒,.c(H+)+c(H2TeO3)=c(OH-)+e(TeO32-),故 D 正确。
五、分层训练 能力进阶
【基础达标】
1.聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分 Fe3O4,
少量碳及二氧化硅)为原料制备的流程如下:
(1)废铁渣进行“粉碎”的目的是____________。
(2)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等,其中酸浸温度对铁浸取率的
影响如右图所示:
①加热条件下酸浸时,Fe3O4 与硫酸反应的化学方程式为______ _____。
② 酸 浸 时 , 通 入 O2 的 目 的 是 _____________ , 该 反 应 的 离 子 方 程 式
为 。
③ 当 酸 浸 温 度 超 过 100℃ 时 , 铁 浸 取 率 反 而 减 小 , 其 原 因
是 。
(3)滤渣的主要成分为____________(填化学式)。
(4)“Fe3+浓度检测”是先用 SnCl2 将 Fe3+还原为 Fe2+;在酸性条件下,再用 K2Cr2O7 标准溶
液滴定 Fe2+(Cr2O72-被还原为 Cr3+),该滴定反应的离子方程式为 。
【答案】
减 小 颗 粒 直 径 , 增 大 浸 取 时 的 反 应 速 率 和 提 高 铁 浸 取 率 Fe3O4+4H2SO4
FeSO4+Fe2(SO4)3+4H2O 将 FeSO4 氧化为 Fe2(SO4)3 4Fe2++O2+4H+==4Fe3++2H2O 温度超
过 100℃明显加快了 Fe3+水解反应的速率,导致 Fe3+浓度降低 C 和 SiO2 6Fe2++Cr2O72-
+14H+=6Fe3++2Cr3++7H2O
【解析】
(1)对废铁渣进行粉碎的目的:减小颗粒直径,增大浸取时的反应速率和提高铁浸取率;
(2)① 加 热 条 件 下 酸 浸 时 ,Fe3O4 与 硫 酸 反 应 生 成 硫 酸 铁 和 硫 酸 亚 铁 , 方 程 式 为
Fe3O4+4H2SO4 FeSO4+Fe2(SO4)3+4H2O
②酸浸时有亚铁离子生成,通入氧气能将亚铁离子氧化为铁离子;反应的离子方程式
为 4Fe2++O2+4H+==4Fe3++2H2O , 故 答 案 为 : 将 FeSO4 氧 化 为 Fe2(SO4)3 ;
4Fe2++O2+4H+==4Fe3++2H2O;
③铁离子在水溶液中存在水解,温度升高有利于水解反应的进行,温度超过 100℃明显
加快了 Fe3+水解反应的速率,导致 Fe3+浓度降低;故答案为:温度超过 100℃明显加快了 Fe3+
水解反应的速率,导致 Fe3+浓度降低;
(3)废铁渣(主要成分 Fe3O4,少量碳及二氧化硅),酸浸,碳与二氧化硅不溶于稀硫酸也不
反应,故滤渣的主要成分问碳和二氧化硅;故答案为:C 和 SiO2;
(4)在酸性条件下,再用 K2Cr2O7 标准溶液滴定 Fe2+(Cr2O72-被还原为 Cr3+),则亚铁离子被
氧化为铁离子,发生的离子方程式为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
2.铵明矾是一种广泛应用于医药、食品、污水处理等多个行业的重要化工产品。以高岭
土(含 SiO2、Al2O3、少量 Fe2O3 等)为原料制备硫酸铝晶体[Al2(SO4)3·18H2O]和铵明矾
[NH4Al(SO4)2·12H2O]的实验方案如下图所示。
请回答下列问题:
(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有 (填字母)。
A.蒸发皿 B.泥三角 C.漏斗 D.酒精灯 e.三脚架 f.坩埚 g.烧杯 h.试管
(2)写出酸溶过程中发生反应的离子方程式: 。
(3)检验滤液 2 中是否含有 Fe3+的实验方法为: ;
滤渣 2 的主要成分为: (填化学式)。
(4)滤液 2→硫酸铝晶体的操作包含的实验步骤有: 、 、 、洗
涤、干燥。
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比(溶液中游离硫
酸和硫酸铝的物质的量之比),再用氨水中和至一定的 pH 值即可析出铵明矾晶体,写出该
过程中的总反应方程式: 。
【答案】(1)bdef
(2)Al2O3+6H+=2Al3++3H2O, Fe2O3+6H+=2Fe 3++3H2O
(3)取少量滤液 2 于试管中,滴加几滴 KSCN 溶液,若溶液变为血红色则含 Fe3+,否则
不含 Fe3+; Fe(OH)3
(4)蒸发浓缩、冷却结晶、过滤
(5)Al2(SO4)3 +H2SO4 +2NH3·H2O +22H2O=2[NH4Al(SO4)2·12H2O]↓
或 Al2(SO4)3 +H2SO4 +2NH3 +24H2O=2[NH4Al(SO4)2·12H2O]↓
【解析】(1)高岭土首先需要灼烧,实验室灼烧高岭土所需的实验仪器有泥三角、酒精灯、
三脚架、坩埚,答案选 bdef;
(2)根据以上分析可知酸溶过程中发生反应的离子方程式为 Al2O3+6H+=2Al3++3H2O,
Fe2O3+6H+=2Fe3++3H2O。
(3)检验溶液中是否含有 Fe3+应用 KSCN 溶液,试验方法为取少量滤液 2 于试管中,滴
加几滴 KSCN 溶液,若溶液变为血红色则含 Fe3+,否则不含 Fe3+;滤渣 2 的主要成分是
Fe(OH)3 。
(4)“分离 1”操作包含的实验步骤有蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(5)中和结晶操作是将过滤出硫酸铝晶体后的滤液,先用硫酸调节酸铝比,再用氨水中和
至一定的 PH 值即可析出铵明矾晶体,该过程的总反应式为 Al2(SO4)3 +H2SO4 +2NH3·H2O
+22H2O=2[NH4Al(SO4)2·12H2O]↓ 或 Al2(SO4)3 +H2SO4 +2NH3
+24H2O=2[NH4Al(SO4)2·12H2O]↓。
3.高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 Fe2+、
Mn2+、Cu2+、Ni2+、Cd2+等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
已知 Ksp[Fe(OH)3]=4.0×10-38。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):_____________。
(2)氧化时,加入 KMnO4 溶液是为了除去浸出液中的 Fe2+和 Mn2+(溶液中 Mn 全部转化为
MnO2),请配平下列除去 Fe2+的离子方程式:
MnO-4 + Fe2++ ________=== MnO2↓+ Fe(OH)3↓+ H+
(3)加入锌粉的目的是_____________________________________。
(4)已知 H2SO4 浸出液中,c(Fe2+)=5.04 mg·L-1、c(Mn2+)=1.65 mg·L-1。
①加入 KMnO4 溶液反应一段时间后,溶液中 c(Fe3+)=0.56 mg·L -1,若溶液 pH=3,
则此时 Fe3+________(填“能”或“不能”)生成沉淀。
②若要除尽 1 m3 上述浸出液中的 Fe2+和 Mn2+,需加入________ g KMnO4。
【答案】
(1)将工业级氧化锌粉碎、搅拌(其他合理答案也可)
(2)1 3 7 H2O 1 3 5
(3)调节溶液 pH,除去溶液中的 Cu2+、Ni2+、Cd2+等
(4)①不能 ②7.9
【解析】
(1)为了提高浸出效率,可以适当增大硫酸浓度、搅拌、将固体粉碎、提高浸出温度等。
(2)锰元素由+7 价降低到+4 价,而铁元素由+2 价升高到+3 价,根据得失电子守恒、
元素守恒和电荷守恒配平方程式。
(3)加入锌粉的目的是消耗溶液中的 H+,调节溶液,pH,促进溶液中的 Cu2+、Ni2+、Cd2
+等形成沉淀而除去。
(4)①c(Fe3+)=0.56 × 10-3 g·L-1
56 g·mol-1 =1.0×10-5 mol·L-1,此时溶液中 c(OH-)=1.0×10-
11mol·L-1,c(Fe3+)·c3(OH-)=1.0×10-38
相关文档
- 2021届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学实验的2021-07-0812页
- 2019届高考化学一轮复习化学键 分2021-07-086页
- 2021届高考化学一轮复习化学反应速2021-07-0815页
- 2019届一轮复习化学实验常用仪器和2021-07-0816页
- 2020届高考化学一轮复习化学反应速2021-07-086页
- 2020届高考化学一轮复习化学资源的2021-07-0815页
- 2020届高考化学一轮复习化学计量在2021-07-0811页
- 2020届高考化学一轮复习化学反应与2021-07-088页
- 2020届高考化学一轮复习化学反应中2021-07-089页