- 2.34 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三单元
铁、铜的获取及应用
1.
铁的主要性质及工业炼铁
(a
、
b)
(1)
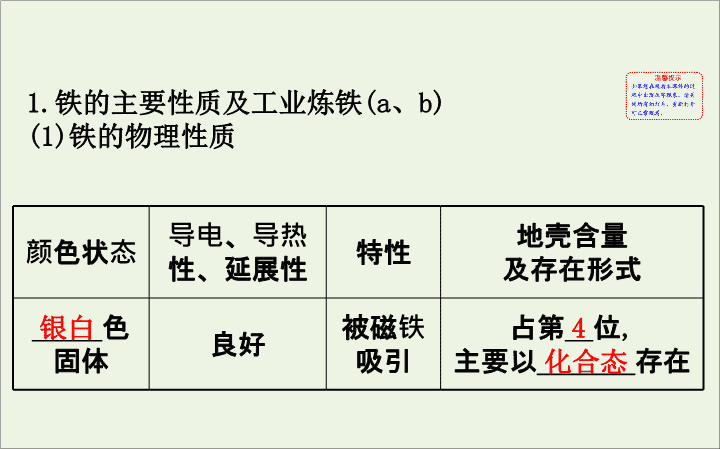
铁的物理性质
颜色状态
导电、导热
性、延展性
特性
地壳含量
及存在形式
_____
色
固体
良好
被磁铁
吸引
占第
__
位
,
主要以
_______
存在
银白
4
化合态
(2)
铁的化学性质
铁元素性质活泼
,
单质有较强的还原性
,
主要化合价为
+2
价和
+3
价。
①
与非金属单质的反应
化学方程式
与
S
反应
______________
与
I
2
反应
_______________
与
O
2
反应
__________________
与
Cl
2
反应
2Fe+3Cl
2
2FeCl
3
Fe+S FeS
Fe+I
2
FeI
2
3Fe+2O
2
Fe
3
O
4
△
====
△
====
点燃
====
点燃
====
②
与水的反应
常温下铁与水不反应
,
在高温条件下与水蒸气反应
:
3Fe+4H
2
O(g) Fe
3
O
4
+4H
2
。
高温
====
③
与酸的反应
酸
化学方程式或现象
稀硫酸
Fe+H
2
SO
4
====FeSO
4
+H
2
↑
稀
硝
酸
Fe
不足
Fe+4HNO
3
====Fe(NO
3
)
3
+NO↑+2H
2
O
Fe
过量
3Fe+8HNO
3
====3Fe(NO
3
)
2
+2NO↑+4H
2
O
浓硝酸、
浓硫酸
常温下
_____
钝化
④
与某些盐溶液的反应
a.
与
CuSO
4
溶液反应的离子方程式
:_________________
。
b.
与
FeCl
3
溶液反应的离子方程式
:________________
。
Fe+Cu
2+
====Fe
2+
+Cu
Fe+2Fe
3+
====3Fe
2+
(3)
铁的冶炼
设 备
炼 铁 高 炉
原 料
___________________________
反应
原理
___________________________
、
______________________
铁矿石、焦炭、空气、石灰石
C+O
2
CO
2
、
C+CO
2
2CO
Fe
2
O
3
+3CO 2Fe+3CO
2
点燃
====
△
====
高温
====
炉渣
形成
______________________
____________________
产 品
含碳
2%
~
4.5%
的
_____,
进一步炼制
,
可得到含碳
0.03%
~
2%
的钢
CaCO
3
CaO+CO
2
↑
、
CaO+SiO
2
CaSiO
3
生铁
高温
====
高温
====
2.
铁的化合物
(a
、
b)
(1)
铁的氧化物
化学式
FeO
Fe
2
O
3
Fe
3
O
4
俗名
_____
磁性氧化铁
颜色状态
___
色粉末
_____
色
粉末
黑色晶体
(
有磁性
)
溶解性
难溶于水
难溶于水
难溶于水
铁红
黑
红棕
化学式
FeO
Fe
2
O
3
Fe
3
O
4
铁的化合价
___
___
_______
与
H
+
反应的离子方程式
___________
________
____________
__________
Fe
3
O
4
+8H
+
==== Fe
2+
+2Fe
3+
+
4H
2
O
+2
+3
+2
、
+3
FeO+2H
+
====
Fe
2+
+H
2
O
Fe
2
O
3
+6H
+
====
2Fe
3+
+3H
2
O
(2)
铁的氢氧化物
化学式
Fe(OH)
2
Fe(OH)
3
色态
_________
___________
与盐酸反应
_______________
_________
Fe(OH)
3
+3H
+
====
Fe
3+
+3H
2
O
受热分解
______________
__________
白色固体
红褐色固体
Fe(OH)
2
+2H
+
====
Fe
2+
+2H
2
O
2Fe(OH)
3
Fe
2
O
3
+3H
2
O
△
====
化学式
Fe(OH)
2
Fe(OH)
3
制法
可溶性亚铁盐与碱反应
:_____________
_________
可溶性铁盐与碱反应
:_____________
_________
二者的
关系
空气中
,Fe(OH)
2
能够非常迅速地被氧气氧
化成
Fe(OH)
3
,
现象是白色沉淀迅速变成
_____
色
,
最后变成
_____
色
,
化学方程式为
___________________________
Fe
2+
+2OH
-
====
Fe(OH)
2
↓
Fe
3+
+3OH
-
====
Fe(OH)
3
↓
灰绿
红褐
4Fe(OH)
2
+O
2
+2H
2
O====4Fe(OH)
3
(3)
铁盐和亚铁盐
①亚铁盐
:
含有
Fe
2+
的溶液呈
_____
色
,
既有氧化性
,
又有还原性。
a.
氧化性
:Fe
2+
与
Zn
反应的离子方程式
:
Zn+Fe
2+
====_______
。
浅绿
Fe+Zn
2+
b.
还原性
2Fe
2+
+Cl
2
====__________
。
Mn
+5Fe
2+
+8H
+
====______________
。
2Fe
3+
+2Cl
-
5Fe
3+
+Mn
2+
+4H
2
O
②
铁盐
:
a.
氧化性
:
含
Fe
3+
的溶液呈
___
色
,Fe
3+
具有较强的氧化性。
2Fe
3+
+Fe====_____
。
2Fe
3+
+2I
-
====________
。
2Fe
3+
+H
2
S====_____________
。
黄
3Fe
2+
I
2
+2Fe
2+
2Fe
2+
+S↓+2H
+
b.
特性
:
含有
Fe
3+
的盐溶液遇到
_____
时变成红色。
c.FeCl
3
易水解
:
将其饱和溶液滴入沸水中制备胶体的
化学方程式为
_________________________________
。
KSCN
FeCl
3
+3H
2
O Fe(OH)
3
(
胶体
)+3HCl
△
====
③Fe
2+
、
Fe
3+
的相互转化
:
Fe
2+
Fe
3+
上述转化关系中标号反应的离子方程式为
a. ______________________;
b. _________________
c. _____________________
。
2Fe
2+
+Cl
2
====2Fe
3+
+2Cl
-
2Fe
3+
+Fe====3Fe
2+
;
2Fe
3+
+Cu====2Fe
2+
+Cu
2+
【
典例精析
】
【
典例
1】
将
a g
铁和氧化铁的混合物加入足量的盐酸
中充分反应后
,
固体无剩余
,
测得参加反应的
HCl
为
0.08 mol,
放出标准状况下的气体
0.224 L,
已知氧化性
Fe
3+
大于
H
+
。则下列判断中正确的是
(
)
A.
原混合物中
n(Fe)∶n(Fe
2
O
3
)=2∶1
B.
向溶液中滴入
KSCN
溶液
,
显红色
C.
无法计算原混合物的质量
D.
此时溶液中
Fe
2+
和
Fe
3+
的物质的量之比为
3∶1
【
解题思路
】
根据化学方程式
Fe+2HCl====FeCl
2
+H
2
↑
中
H
2
的量来计算出
Fe
和
HCl
的量
,
再由
Fe
2
O
3
+6HCl====2FeCl
3
+3H
2
O
算出
Fe
2
O
3
和
FeCl
3
的量
,
由题目数据计算这个反应中消耗的
HCl
的量
,
得出
n(FeCl
3
)
、
n(Fe
2
O
3
),
最后由
Fe+2Fe
3+
====3Fe
2+
中
,
根据铁离子的量算出消耗
Fe
的量即可。
【
解析
】
选
A
。因为
Fe
3+
和
H
+
的氧化性强弱顺序为
Fe
3+
>
H
+
,
所以当产生氢气时
,Fe
3+
已经全部被还原为
Fe
2+
,
故向
溶液中滴入
KSCN
溶液
,
溶液不变红
,
故
B
、
D
错误
;
根据化
学方程式
Fe+2HCl====FeCl
2
+H
2
↑
中
H
2
的量来计算出
Fe
和
HCl
的物质的量分别是
n(Fe)=0.01 mol, n(HCl)=
0.02 mol,
由
Fe
2
O
3
+6HCl====2FeCl
3
+3H
2
O
算出
Fe
2
O
3
和
FeCl
3
的量
,
由题目可知
,
这个反应中消耗的
HCl
的量为
0.08 mol-0.02 mol=0.06 mol,
得出
n(FeCl
3
)=
0.02 mol,n(Fe
2
O
3
)=0.01 mol,
在反应
Fe+2Fe
3+
====3Fe
2+
中
,
根据
Fe
3+
的量
0.02 mol
算出消耗
Fe
的量为
0.01 mol,
故
A
正确
,C
错误。
【
考题变式
】
若将本题中的混合物在
CO
气体中加热并充分冷却
,
最后可得到固体的质量是多少
?
提示
:
2.24 g
。反应后铁元素已经全部被还原为
Fe
2+
,
即
FeCl
2
,
根据消耗的
HCl
为
0.08 mol,
可知混合物中铁元素的物质的量为
0.04 mol
。根据元素守恒
,
混合物在
CO
气体中加热并充分冷却
,
最后可得到固体
Fe
的物质的量是
0.04 mol
。质量为
2.24 g
。
【
典例
2】
下图中
,
固体
A
是铁锈的主要成分。
请回答
:
(1)
白色沉淀
E
的化学式
__________
。
(2)
写出
A→B
的化学方程式
______________
。
(3)
写出
C→D
在溶液中发生氧化还原反应的离子方程式
______________________________________
。
【
解析
】
铁锈的主要成分是
Fe
2
O
3
,Fe
2
O
3
在高温下被
CO
还
原成
Fe,
反应的化学方程式为
Fe
2
O
3
+3CO 2Fe+3CO
2
。
Fe
在加热条件下和氯气反应生成
FeCl
3
。
FeCl
3
具有强氧
化性
,
能够把
SO
2
氧化成
H
2
SO
4
,
自身被还原成
FeCl
2
,
反应
的离子方程式为
2Fe
3+
+SO
2
+2H
2
O====2Fe
2+
+ +4H
+
。
生成的 和
BaCl
2
溶液中的
Ba
2+
反应生成
BaSO
4
沉淀。
高温
====
答案
:
(1)BaSO
4
(2)Fe
2
O
3
+3CO 2Fe+3CO
2
(3)SO
2
+2H
2
O+2Fe
3+
====2Fe
2+
+ +4H
+
高温
====
【
强化训练
】
1.
判断下列叙述的正误
(
正确的打“√”
,
错误的打“
×”)
(1)
铁具有导电、导热、延展性及被磁体吸引的特性。
(
)
提示
:
√
。
(2)Fe
与稀硝酸、稀硫酸反应均有气泡产生
,
说明
Fe
与两种酸均发生置换反应。
(
)
提示
:
×
。
Fe
与稀硝酸发生氧化还原反应生成硝酸铁和
NO,
不是置换反应。
(3)Fe
在足量
Cl
2
中燃烧生成
FeCl
3
,
在少量
Cl
2
中燃烧生成
FeCl
2
。
(
)
提示
:
×
。
Fe
在
Cl
2
中燃烧只能生成
FeCl
3
,
无
FeCl
2
生成。
(4)
常温下
,
将铁片浸入足量浓硫酸中
,
铁片不溶解
,
说明常温下
,
铁与浓硫酸不发生化学反应。
(
)
提示
:
×
。常温下
,
铁片在浓硫酸中发生钝化
,
生成一层致密的氧化膜
,
为化学反应。
(5)
铁表面自然形成的氧化层能保护内层不被空气氧化。
(
)
提示
:
×
。铁表面自然形成的氧化层为氧化铁
,
比较疏松
,
不能保护内层不被空气氧化。
2.
把
22.4 g
铁粉完全溶解于某浓度的硝酸中
,
若反应只收集到
0.3 mol NO
2
和
0.2 mol NO,
下列说法正确的是
(
)
A.
反应后生成的盐只为
Fe(NO
3
)
3
B.
反应后生成的盐只为
Fe(NO
3
)
2
C.
反应后生成的盐为
Fe(NO
3
)
3
和
Fe(NO
3
)
2
,
其物质的量之比为
1∶3
D.
反应后生成的盐为
Fe(NO
3
)
3
和
Fe(NO
3
)
2
,
其物质的量之比为
3∶1
【
解析
】
选
C
。
n(Fe)= =0.4 mol,Fe
在反应的
过程中失去的电子数应介于
0.8 mol(
此时只产生
Fe
2+
)
和
1.2 mol(
此时只产生
Fe
3+
)
之间
,
又产生
0.3 mol NO
2
和
0.2 mol NO,
即反应过程中硝酸得电子物质的量为
0.3 mol
×
(5-4)+0.2 mol
×
(5-2)=0.9 mol,
产物既有
Fe(NO
3
)
3
又有
Fe(NO
3
)
2
,
设前者的物质的量为
x,
后者的物
质的量为
y,
则由铁原子守恒可得
x+y=0.4 mol,
由得失电子守恒得
3x+2y=0.9 mol,
解得
x=0.1 mol,y=0.3 mol
。
3.(
高考试题改编
)
下列各图示中能较长时间看到
Fe(OH)
2
白色沉淀的是
________(
填序号
)
。 世纪金榜导学号
【
解析
】
因为
Fe(OH)
2
在空气中很容易被氧化为红褐色
的
Fe(OH)
3
,
即
4Fe(OH)
2
+O
2
+2H
2
O====4Fe(OH)
3
,
因此要较
长时间看到
Fe(OH)
2
白色沉淀
,
就要排除装置中的氧气或
空气。①、②原理一样
,
都是先用氢气将装置中的空气
排尽
,
并使生成的
Fe(OH)
2
处在氢气的保护中
;③
的原理
为铁作阳极产生
Fe
2+
,
与电解水产生的
OH
-
结合生成
Fe(OH)
2
,
且液面用汽油保护
,
能防止空气进入
;⑤
中液面加苯阻止了空气进入
;④
由于带入空气中的氧气
,
能迅速将
Fe(OH)
2
氧化
,
因而不能较长时间看到白色沉淀。
答案
:
①②③⑤
4.
某小组在验证反应“
Fe+2Ag
+
====Fe
2+
+2Ag”
的实验中检测到
Fe
3+
,
发现和探究过程如下。
向硝酸酸化的
0.05 mol·L
-1
硝酸银溶液
(pH≈2)
中加入过量铁粉
,
搅拌后静置
,
烧杯底部有黑色固体
,
溶液呈黄色。
(1)
检验产物
①取出少量黑色固体
,
洗涤后
,______________(
填操作和现象
),
证明黑色固体中含有
Ag
。
②取上层清液
,
滴加
K
3
[Fe(CN)
6
]
溶液
,
产生蓝色沉淀
,
说明溶液中含有
__________
。
(2)
针对“溶液呈黄色”
,
甲认为溶液中有
Fe
3+
,
乙认为
铁粉过量时不可能有
Fe
3+
,
乙依据的原理是
__________
(
用离子方程式表示
)
。针对两种观点继续实验
:
①
取上层清液
,
滴加
KSCN
溶液
,
溶液变红
,
证实了甲的猜
测。同时发现有白色沉淀产生
,
且溶液颜色深浅、沉淀
量多少与取样时间有关
,
对比实验记录如下
:
序号
取样时
间
/min
现象
ⅰ
3
产生大量白色沉淀
;
溶液呈红色
ⅱ
30
产生白色沉淀
;
较
3 min
时量少
;
溶液红色较
3 min
时加深
ⅲ
120
产生白色沉淀
;
较
30 min
时量少
;
溶液红色较
30 min
时变浅
(
资料
:Ag
+
与
SCN
-
生成白色沉淀
AgSCN)
②
对
Fe
3+
产生的原因作出如下假设
:
假设
a:
可能是铁粉表面有氧化层
,
能产生
Fe
3+
;
假设
b:
空气中存在
O
2
,
由于
____________(
用离子方程
式表示
),
可产生
Fe
3+
;
假设
c:
酸性溶液中
具有氧化性
,
可产生
Fe
3+
;
假设
d:
根据
______________
现象
,
判断溶液中存在
Ag
+
,
可产生
Fe
3+
。
③
下列实验
Ⅰ
可证实假设
a
、
b
、
c
不是产生
Fe
3+
的主要原因。
实验
Ⅱ
可证实假设
d
成立。
实验
Ⅰ:
向硝酸酸化的
________
溶液
(pH≈2)
中加入过量铁粉
,
搅拌后静置
,
不同时间取上层清液滴加
KSCN
溶液
,3 min
时溶液呈浅红色
,30 min
后溶液几乎无色。
实验
Ⅱ:
装置如图。其中甲溶液是
________,
操作及现象是
__________________
。
【
解析
】
(1)①
黑色固体中含有过量铁
,
如果同时含有
银
,
则可以加入
HCl
或
H
2
SO
4
溶解
Fe,
而银不溶解。
②
K
3
[Fe(CN)
6
]
是检验
Fe
2+
的试剂
,
所以产生蓝色沉淀说
明含有
Fe
2+
。
(2)②
过量铁粉与
Fe
3+
反应生成
Fe
2+
,
即
Fe+2Fe
3+
====3Fe
2+
。
O
2
氧化
Fe
2+
反应为
4Fe
2+
+O
2
+4H
+
====4Fe
3+
+2H
2
O
。③实验
Ⅰ
的目的是证实
假设
a
、
b
、
c
非主要原因
,
可以从后续现象中看出。
Fe
3+
在
30 min
时几乎完全消失
,
故应使
a
、
b
、
c
、中变量全部存在
,
即溶液中只需不存在
Ag
+
,
此时
Fe
3+
可被过量铁粉还原为
Fe
2+
。故初始时加入
Fe(NO
3
)
3
溶液
,
随时间进行
,
可看到
Fe
3+
浓度逐渐降低的实验现象。
实验
Ⅱ
是为了证实
Ag
+
可能将
Fe
2+
氧化为
Fe
3+
,
故甲溶液
必为
Fe
2+
溶液。由于 的影响已被实验
Ⅰ
排除
,
为了
避免其他阴离子干扰
,
可选用
Fe(NO
3
)
2
。在原电池结构
中
,Ag
+
将
Fe
2+
氧化为
Fe
3+
,
电流表应有偏转。为证实
Fe
3+
产生
,
应在电流表偏转后向左池加入
KSCN
验证。
答案
:
(1)
①
加入足量稀盐酸
(
或稀硫酸
)
酸化
,
固体未完全溶解
②
Fe
2+
(2)Fe+2Fe
3+
====3Fe
2+
②
4Fe
2+
+O
2
+4H
+
====4Fe
3+
+2H
2
O
生成白色沉淀
③
Fe(NO
3
)
3
Fe(NO
3
)
2
当电流表指针偏转时
,
向左侧甲溶液中加入
KSCN
溶液
;
溶液变红
【
归纳总结
】
1.
防氧化是制备
Fe(OH)
2
的关键
(1)
将配制溶液的蒸馏水煮沸
,
驱除溶液中的氧气。
(2)
将盛有
NaOH
溶液的胶头滴管尖端插入试管的亚铁盐溶液底部
,
并慢慢挤出
NaOH
溶液。
(3)
在亚铁盐溶液上面充入保护气
,
如
H
2
、
N
2
、稀有气体等。
(4)
在亚铁盐溶液上面加保护层
,
如苯、植物油等。
(5)
用
Fe
作阳极
,
石墨作阴极
,
电解
NaOH
溶液
,
利用新产生的
Fe
2+
与
OH
-
反应制取。
2.
数轴法分析铁与稀硝酸反应的产物
一是明确哪种物质过量
,
二是根据两种物质的量分析讨论判断
,
根据反应方程式
:
(1)HNO
3
过量
:Fe+4HNO
3
(
稀
)====Fe(NO
3
)
3
+NO↑+2H
2
O,
铁元素的存在形式为
Fe
3+
。
(2)Fe
过量
: 3Fe+8HNO
3
(
稀
)====3Fe(NO
3
)
2
+2NO↑+4H
2
O,
铁元素的存在形式为
Fe
2+
。
(3)
用数轴表示
:
(4)
解题时需注意量的范围
:
产物
结论
≤
Fe(NO
3
)
3
HNO
3
可能有剩余
≥
Fe(NO
3
)
2
Fe
可能有剩余
在 ~ 之间
Fe(NO
3
)
3
和
Fe(NO
3
)
2
Fe
和
HNO
3
都反应完全
考点
2:
铁的转化及
Fe
2+
、
Fe
3+
的检验
1.“
铁三角”及应用
(c)
(1)
铁的转化关系
(2)“
铁三角”转化关系的应用
①判断离子能否共存
②
盐溶液的配制与保存
2.Fe
2+
、
Fe
3+
的检验方法
(c)
(1)
用
KSCN
溶液和氯水
(2)
用
NaOH
溶液
(3)
含
Fe
2+
、
Fe
3+
的混合溶液中
Fe
3+
、
Fe
2+
的检验
(4)Fe
2+
的特征检验方法
溶液 产生蓝色沉淀
,
说明溶液中含有
Fe
2+
,3Fe
2+
+2[Fe(CN)
6
]
3-
====Fe
3
[Fe(CN)
6
]
2
↓
3.
含
Fe
2+
、
Fe
3+
的除杂问题
(c)
主要成分
杂质
除杂方法
FeCl
3
(aq)
FeCl
2
(aq)
加入氯水或
H
2
O
2
FeCl
2
(aq)
FeCl
3
(aq)
加过量铁粉后过滤
FeCl
2
(aq)
CuCl
2
(aq)
加过量铁粉后过滤
4.
溶液中
Fe
2+
、
Fe
3+
的除去方法
(c)
(1)
原理
:Fe
3+
、
Fe
2+
完全生成氢氧化物沉淀时
,
溶液的
pH
分别为
pH≥3.7
、
pH≥9.6
。
(2)
步骤
:
①
除去溶液中的
Fe
3+
时
,
一般是加入能与酸反应的物质
(
但不能引入新的杂质
),
使溶液的
pH
至
3
~
4,
使
Fe
3+
水解生成
Fe(OH)
3
沉淀而除去。
②
除去溶液中的
Fe
2+
时
,
先加入
H
2
O
2
(
或其他氧化剂
,
但不引入新杂质
)
使
Fe
2+
转化为
Fe
3+
,
然后调节溶液的
pH
至
3
~
4,
使
Fe
3+
水解生成
Fe(OH)
3
沉淀而除去。
(3)
示例
:
①
除去
MgCl
2
溶液中的
Fe
3+
可在加热搅拌条件下
,
加入足量
MgO
或
MgCO
3
或
Mg(OH)
2
,
搅拌、充分反应后过滤除去。
②除去
CuCl
2
溶液中的
Fe
2+
,
先加入
H
2
O
2
(
或
Cl
2
),
然后在加热搅拌条件下
,
加入足量
CuO
或
CuCO
3
或
Cu(OH)
2
,
搅拌、充分反应后过滤除去。
【
典例精析
】
【
典例
】
硫酸亚铁晶体
(FeSO
4
·7H
2
O)
在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下
:
请回答下列问题
:
(1)
证明步骤①滤液中含有
Fe
2+
的方法是取样
,
先滴加
KSCN
溶液
,
再滴加
__________,
该过程的现象为
_______________________________________
。
(2)
步骤②加入过量
H
2
O
2
的目的是
___________
。
(3)
步骤③反应的离子方程式是
_____________
。
(4)
步骤④中一系列处理的操作步骤
:
过滤、
__________
、 灼烧、
__________
、称量。
(5)
若实验中铁无损耗
,
则每片补血剂中含铁元素的质量为
__________ g
。
【
解析
】
(1)
证明步骤
①
滤液中含有
Fe
2+
的方法是取样
,
先滴加
KSCN
溶液
,
再滴加氯水或双氧水、稀硝酸等
,
若滤液由浅绿色变为血红色
,
则说明滤液中含有
Fe
2+
。
(2)
由于
H
2
O
2
具有氧化性
,
加入过量
H
2
O
2
的目的是将
Fe
2+
全部氧化为
Fe
3+
。
(3)
步骤
③
的目的是将
Fe
3+
全部转化为
Fe(OH)
3
,
所以步骤
③
需加入过量的
NaOH
溶液
(
或氨水
),
反应的离子方程式是
Fe
3+
+3OH
-
====Fe(OH)
3
↓
。
(4)
步骤
④
的目的是将产生的红褐色悬浊液分离
,
最终得到固体
Fe
2
O
3
,
所以步骤
④
的操作步骤是过滤、洗涤、灼烧、冷却、称量。
(5)
由于实验中铁无损耗
,
根据铁元素守恒得
,
每片补血
剂中
m(Fe)=
÷
10=0.07a g
。
答案
:
(1)
氯水
(
或双氧水、稀硝酸等合理氧化剂
)
溶液由浅绿色变为血红色
(2)
将
Fe
2+
全部氧化为
Fe
3+
(3)Fe
3+
+3OH
-
====Fe(OH)
3
↓
(4)
洗涤 冷却
(5)0.07a
【
强化训练
】
1.
判断正误
(
正确的打“√”
,
错误的打“
×”)
(1)FeCl
3
溶液与
KSCN
溶液反应的离子方程式为
Fe
3+
+3SCN
-
====Fe(SCN)
3
↓
。
(
)
提示
:
×
。
Fe(SCN)
3
是红色溶液。
(2)
向某溶液中
,
滴加氯水无现象
,
再滴加
KSCN
溶液溶液显红色
,
该溶液中一定含
Fe
2+
。
(
)
提示
:
×
。应先滴加
KSCN
溶液无现象
,
滴加氯水后溶液显红色。
(3)FeCl
3
溶液腐蚀
Cu
刻制印刷电路板是由于铁比铜的金属性强。
(
)
提示
:
×
。
FeCl
3
溶液腐蚀
Cu
刻制印刷电路板是由于
2FeCl
3
+Cu====2FeCl
2
+CuCl
2
。
(4)
检验
Fe(NO
3
)
2
晶体是否氧化变质的方法是将
Fe(NO
3
)
2
样品溶于稀硫酸后
,
滴加
KSCN
溶液
,
观察溶液是否变红。
(
)
提示
:
×
。由于
Fe(NO
3
)
2
溶液中含有
,
加入稀硫酸
后
, (H
+
)
会将
Fe
2+
氧化成
Fe
3+
。故不能用
KSCN
溶液检
验
Fe
3+
而判断
Fe(NO
3
)
2
是否变质。
2.
下列关于
Fe
3+
、
Fe
2+
性质实验的说法错误的是
(
)
A.
用如图装置可以制备沉淀
Fe(OH)
2
B.
配制
FeCl
3
溶液时
,
先将氯化铁晶体溶于较浓的盐酸中
,
再加水稀释到所需要的浓度
C.
向某溶液中滴加
KSCN
溶液
,
溶液不变色
,
滴加氯水后溶液显红色
,
此现象不能确定溶液中含有
Fe
2+
D.
向
FeCl
2
溶液中加入少量铁粉是为了防止
Fe
2+
被氧化
【
解析
】
选
C
。反应开始时生成的氢气进入
B
中
,
可排出
氧气
,
防止生成的氢氧化亚铁被氧化
,
一段时间后关闭
止水夹
C,A
中硫酸亚铁进入
B
中可生成
Fe(OH)
2
,
故
A
正确
;
FeCl
3
易水解
,
配制溶液时应防止溶液因水解而生成氢
氧化铁沉淀
,
可先将氯化铁晶体溶于较浓的盐酸中
,
再
加水稀释到所需要的浓度
,
故
B
正确
;
溶液中加入
KSCN
溶液
,
溶液不变色
,
说明无
Fe
3+
,
但滴加氯水后溶液显红色
,
说明生成了
Fe
3+
,
则原溶液中含有
Fe
2+
,C
错误
;Fe
3+
与铁反应可生成
Fe
2+
,
则向
FeCl
2
溶液中加入少量铁粉是为了防止
Fe
2+
被氧化
,
故
D
正确。
3.
下列说法错误的是
(
)
①
向
NaClO
溶液中滴入少量
FeSO
4
溶液
,
反应的离子方程
式为
2Fe
2+
+ClO
-
+2H
+
====Cl
-
+2Fe
3+
+H
2
O
②
向
FeSO
4
溶液中先滴入
KSCN
溶液
,
再滴加
H
2
O
2
溶液
,
溶
液变成血红色
,
说明
Fe
2+
既有氧化性又有还原性
③将稀硝酸加入过量铁粉中
,
充分反应后滴加
KSCN
溶液
,
有气体生成
,
溶液呈血红色
,
则稀硝酸将
Fe
氧化为
Fe
3+
④
向某溶液中滴加氯水后再加入
KSCN
溶液
,
溶液呈红色
,
溶液一定含有
Fe
2+
⑤
在溶液中加
KSCN,
溶液显红色
,
证明原溶液中有
Fe
3+
,
无
Fe
2+
A.①②③④ B.①②③④⑤
C.②③④ D.②③④⑤
【
解析
】
选
B
。①
NaClO
溶液为碱性
,
滴入少量硫酸亚铁
溶液时
,
亚铁离子被
ClO
-
氧化
,
离子方程式中不能写
H
+
而
应写水
,
生成
Fe(OH)
3
,
错误
;②
向
FeSO
4
溶液中先滴入
KSCN
溶液再滴加
H
2
O
2
溶液
,H
2
O
2
溶液将
Fe
2+
氧化为
Fe
3+
,
溶液变为红色
,
体现了
Fe
2+
的还原性
,
错误
;③
将稀硝酸
加入过量铁粉中
,
生成
Fe(NO
3
)
2
、
NO
和水
,
无
Fe
3+
,
因此
加入
KSCN
后溶液不会变红
,
错误
;④
若溶液中有
Fe
3+
也会出现红色
,
证明溶液中含有
Fe
2+
应先加入
KSCN
溶液
,
无明显现象
,
再滴入氯水呈红色可证明含
Fe
2+
,
错误
;⑤
加入
KSCN
溶液
,
溶液显红色
,
说明一定含有
Fe
3+
,
但无法确定是否有
Fe
2+
,
错误。
4.
某班同学用如下实验探究
Fe
2+
、
Fe
3+
的性质。
回答下列问题
:
世纪金榜导学号
(1)
分别取一定量氯化铁、氯化亚铁固体
,
均配制成
0.1 mol·L
-1
的溶液。在
FeCl
2
溶液中需加入少量铁屑
,
其目的是
_______________________________
。
(2)
甲组同学取
2 mL FeCl
2
溶液
,
加入几滴氯水
,
再加入
1
滴
KSCN
溶液
,
溶液变红
,
说明
Cl
2
可将
Fe
2+
氧化。
FeCl
2
溶
液与氯水反应的离子方程式为
_________________
。
(3)
乙组同学认为甲组的实验不够严谨
,
该组同学在
2 mL FeCl
2
溶液中先加入
0.5 mL
煤油
,
再于液面下依次
加入几滴氯水和
1
滴
KSCN
溶液
,
溶液变红
,
煤油的作用是
____________________________________
。
(4)
丙组同学取
10 mL 0.1 mol·L
-1
KI
溶液
,
加入
6 mL 0.1 mol·L
-1
FeCl
3
溶液混合。分别取
2 mL
此溶液于
3
支试管中进行如下实验
:
①
第一支试管中加入
1 mL CCl
4
充分振荡、静置
,CCl
4
层显紫色
;
②
第二支试管中加入
1
滴
K
3
[Fe(CN)
6
]
溶液
,
生成蓝色沉淀
;
③
第三支试管中加入
1
滴
KSCN
溶液
,
溶液变红。
实验②检验的离子是
________(
填离子符号
);
实验①和③说明
:
在
I
-
过量的情况下
,
溶液中仍含有
________(
填离子符号
),
由此可以证明该氧化还原反应为
________________________________
。
(5)
丁组同学向盛有
H
2
O
2
溶液的试管中加入几滴酸化的
FeCl
2
溶液
,
溶液变成棕黄色
,
发生反应的离子方程式为
____________________________________
。
一段时间后
,
溶液中有气泡出现
,
并放热
,
随后有红褐色
沉淀生成。产生气泡的原因是
______________
。
生成沉淀的原因是
_____________________(
用平衡移
动原理解释
)
。
【
解析
】
(1)Fe
2+
具有很强的还原性
,
易被空气中的
O
2
氧化为
Fe
3+
,
在
FeCl
2
溶液中加入少量铁屑
,
可防止
Fe
2+
被氧化。
(2)Fe
2+
被氧化为
Fe
3+
,Cl
2
被还原为
Cl
-
,
反应的离子方程式为
2Fe
2+
+Cl
2
====2Fe
3+
+2Cl
-
。
(3)O
2
难溶于煤油
,
加入煤油能隔绝空气
,
排除
O
2
对实验的影响。
(4)KI
溶液与
FeCl
3
溶液反应的离子方程式为
2I
-
+2Fe
3+
====I
2
+2Fe
2+
。
K
3
[Fe(CN)
6
]
是检验
Fe
2+
的试剂。实验
③
溶液变红
,
说明溶液中仍存在
Fe
3+
,
由此可说明该氧化还原反应为可逆反应。
(5)
酸化的
FeCl
2
溶液与
H
2
O
2
反应
,Fe
2+
被氧化为
Fe
3+
,H
2
O
2
被还原为
H
2
O,
反应的离子方程式为
H
2
O
2
+2Fe
2+
+2H
+
====
2Fe
3+
+2H
2
O
。
Fe
3+
对
H
2
O
2
的分解起催化作用
,
当反应一段
时间后
,
会发生反应
:2H
2
O
2
2H
2
O+O
2
↑,
故溶液中产
生气泡。由于
H
2
O
2
分解反应放热
,
促使
Fe
3+
+3H
2
O
Fe(OH)
3
+3H
+
平衡右移
,
最终出现
Fe(OH)
3
红褐色沉淀。
答案
:
(1)
防止
Fe
2+
被氧化
(2)2Fe
2+
+Cl
2
====2Fe
3+
+2Cl
-
(3)
隔绝空气
(
排除氧气对实验的影响
)
(4)Fe
2+
Fe
3+
可逆反应
(5)2Fe
2+
+H
2
O
2
+2H
+
====2Fe
3+
+2H
2
O
Fe
3+
催化
H
2
O
2
分解产生
O
2
H
2
O
2
分解反应放热
,
促进
Fe
3+
的水解平衡正向移动
【
归纳总结
】
1.Fe
2+
、
Fe
3+
的检验方法对比
鉴别方法
Fe
2+
Fe
3+
直接观色
浅绿色
棕黄色
利用显
色反应
与
KSCN
溶液
无现象
显红色
鉴别方法
Fe
2+
Fe
3+
利用
Fe
3+
的氧化性
与铜片
无现象
Cu
溶解
,
溶液
变为蓝绿色
与
KI-
淀粉溶液
无现象
溶液变蓝
利用
Fe
2+
的还原性
与溴水
溴水褪色
无现象
与酸性
KMnO
4
溶液
紫色褪去
无现象
鉴别方法
Fe
2+
Fe
3+
利用沉淀反应
Fe
2+
+2OH
-
====Fe(OH)
2
↓,
4Fe(OH)
2
+O
2
+2H
2
O====
4Fe(OH)
3
白色→灰绿色→红褐色
Fe
3+
+3OH
-
====Fe(OH)
3
↓
红褐色沉淀
2.
含
Fe
2+
、
Fe
3+
的混合溶液中
Fe
3+
、
Fe
2+
的检验
(1)Fe
3+
的检验
:
(2)Fe
2+
的检验
:
考点
3:
铜及其化合物的性质
1.
自然界铜元素的存在形式
(a)
主要以
_______
形式存在
,
常见铜矿有黄铜矿
(
主要成分为
CuFeS
2
),
孔雀石
[
主要成分为
CuCO
3
·Cu(OH)
2
]
等。
化合态
2.
单质铜的化学性质
(b)
(1)
与非金属的反应
(
写出化学方程式
)
。
①与
O
2
反应。
加热
:_______________
。
常温下在潮湿的空气中
:
2Cu+O
2
+H
2
O+CO
2
====Cu
2
(OH)
2
CO
3
。
②与
Cl
2
反应
:________________(_____
色烟
)
。
2Cu+O
2
2CuO
Cu+Cl
2
CuCl
2
棕黄
△
====
点燃
====
(2)
与氧化性酸的反应
(
写出相应的化学方程式
)
。
铜与非氧化性酸不反应
,
与氧化性酸反应。
①与浓硫酸的反应
:
_________________________________
。
②与浓硝酸的反应
:
___________________________________
。
Cu+2H
2
SO
4
(
浓
) CuSO
4
+SO
2
↑+2H
2
O
Cu+4HNO
3
(
浓
)====Cu(NO
3
)
2
+2NO
2
↑+2H
2
O
△
====
③
与稀硝酸的反应
:
_____________________________________
。
(3)
与盐溶液的反应
(
用离子方程式表示
)
。
与硝酸银溶液的反应
:___________________
。
与氯化铁溶液的反应
:_____________________
。
3Cu+8HNO
3
(
稀
)====3Cu(NO
3
)
2
+2NO↑+4H
2
O
Cu+2Ag
+
====Cu
2+
+2Ag
2Fe
3+
+Cu====2Fe
2+
+Cu
2+
3.
氧化铜和氧化亚铜
名称
氧化铜
氧化亚铜
颜色
黑色
砖红色
与酸反应
(H
+
)
__________________
____________
___________
与
H
2
反应
_________________
___________________
转化关系
___________________
CuO+2H
+
====Cu
2+
+H
2
O
Cu
2
O+2H
+
====
Cu
2+
+Cu+H
2
O
CuO+H
2
Cu+H
2
O
Cu
2
O+H
2
2Cu+H
2
O
4CuO 2Cu
2
O+O
2
↑
△
====
△
====
高温
====
4.
氢氧化铜
(1)
物理性质
:___
色
___
溶于水的固体。
(2)
化学性质及应用
蓝
不
5.
硫酸铜
(1)CuSO
4
·5H
2
O
为蓝色晶体
,
俗称
___________,
受热易
分解为白色粉末
CuSO
4
和水。
(2)
无水
CuSO
4
遇水变蓝色
(
生成
CuSO
4
·5H
2
O),
可作为水
的检验试剂。
(3)CuSO
4
与石灰乳的混合液即为无机农药波尔多液
,
是
一种良好的杀菌剂
,
可以用来防治多种作物的病害。
蓝矾或胆矾
6.
铜的冶炼
(1)
高温炼铜
:
黄铜矿 粗铜 精铜
(2)
生物炼铜
:
硫化铜矿石
CuSO
4
Cu
(3)
湿法炼铜
:CuSO
4
+Fe====FeSO
4
+Cu
【
典例精析
】
【
典例
】
铜及其化合物在工农业生产领域有着重要的用途
,
氯化铜、氯化亚铜经常用作催化剂。其中
CuCl
广泛应用于化工和印染等行业。
【
查阅资料
】
(ⅰ)
氯化铜
:
从水溶液中结晶时
,
在
15 ℃
以下得到四水物
,
在
15
~
25.7 ℃
得到三水物
,
在
26
~
42 ℃
得到二水物
,
在
42 ℃
以上得到一水物
,
在
100 ℃
得到无水物。
(1)
实验室用如图所示的实验仪器及药品制备纯净、干燥的氯气并与铜反应
(
铁架台、铁夹略
)
制备氯化铜。
①按气流方向连接各仪器接口的顺序是
a→________
、
________→________
、
________→________
、
________→________
。
②本套装置有两个仪器需要加热
,
加热的顺序为先
________
后
________
。
(2)
印刷电路板是由高分子材料和铜箔复合而成
,
刻制印刷电路板时
,
要用
FeCl
3
溶液作为“腐蚀液”
,
写出该反应的化学方程式
:________________________
。
(3)
现欲从
(2)
所得溶液获得纯净的
CuCl
2
·2H
2
O,
进行如下操作
:
①
首先向溶液中加入
H
2
O
2
溶液然后再加试剂
X
用于调节
pH,
过滤
,
除去杂质
,X
可选用下列试剂中的
________(
填序号
)
。
a.NaOH
b.NH
3
·H
2
O
c.CuO
d.CuSO
4
②
要获得纯净
CuCl
2
·2H
2
O
晶体的操作步骤
:
向①所得滤液中加少量盐酸
,
蒸发浓缩、
________
、
________
、洗涤、干燥。
(4)
用
CuCl
2
·2H
2
O
为原料制备
CuCl
时
,
发现其中含有少
量的
CuCl
2
或
CuO
杂质
,
若杂质是
CuCl
2
,
则产生的原因是
________________________________________
。
(5)
设计简单的实验验证
0.1 mol·L
-1
的
CuCl
2
溶液中的
Cu
2+
对
H
2
O
2
的分解具有催化作用
:_______________
。
【
解题思路
】
本题的解题关键有
:
(1)
掌握铜及其化合物的性质。
(2)
明确物质制备的流程及方法。
【
解析
】
(1)
①
用装置
A
制备
Cl
2
,
制得的
Cl
2
中混有
HCl
、
H
2
O(g),
所以将气体先通过盛饱和食盐水的装置
C
除去
HCl,
再通过盛浓硫酸的装置
E
干燥
Cl
2
,
用纯净、干燥的
Cl
2
与
Cu
反应制备
CuCl
2
;
由于
Cl
2
会污染大气
,
最后用盛放
NaOH
溶液的装置
B
吸收尾气
;
同时注意洗气时导气管应长进短出
;
按气流方向连接各仪器接口的顺序是
: a→d
、
e→h
、
i→f
、
g→b
。
②
实验室用
MnO
2
和浓盐酸加热制
Cl
2
,Cu
与
Cl
2
加热反应制备
CuCl
2
,
则装置
A
和装置
D
需要加热
;
为了防止
Cu
与空气中的
O
2
反应生成
CuO,
所以实验时必须先加热装置
A
产生
Cl
2
,
用生成的
Cl
2
赶尽装置中的空气后再加热装置
D
。
(2)Cu
与
FeCl
3
溶液反应生成
CuCl
2
和
FeCl
2
。
(3)
①
向
(2)
所得溶液中加入
H
2
O
2
溶液将
Fe
2+
氧化成
Fe
3+
,
加入试剂
X
调节
pH
除去
Fe
3+
。
a
项
,
加入
NaOH
可调节
pH
除
去
Fe
3+
,
但引入新杂质
Na
+
;b
项
,
加入
NH
3
·H
2
O
可调节
pH
除
去
Fe
3+
,
但引入新杂质
;c
项
,
加入
CuO
可调节
pH
除去
Fe
3+
,
且不引入新杂质
;d
项
,
加入
CuSO
4
不能除去
Fe
3+
。
②
根据题给资料
(
ⅰ
)
要获得
CuCl
2
·2H
2
O
需控制温度在
26
~
42
℃
。
(4)
根据资料
(
ⅱ
),CuCl
2
·2H
2
O
在
HCl
气流中加热到
140
℃
失去结晶水生成
CuCl
2
,
继续加热到温度大于
300
℃
时生成
CuCl
和
Cl
2
,
若发现
CuCl
中含有杂质
CuCl
2
,
产生的原因是加热温度低或加热时间不够。
(5)
要证明
0.1 mol·L
-1
CuCl
2
溶液中的
Cu
2+
对
H
2
O
2
的分
解具有催化作用可采用控制变量法
,
控制
H
2
O
2
溶液等浓
度、等体积
,
两溶液中
Cl
-
浓度相同。
答案
:
(1)
①
d e h i f g b
②
A
D
(2)2FeCl
3
+Cu====2FeCl
2
+CuCl
2
(3)
①
c
②
冷却到
26
~
42
℃
结晶 过滤
(4)
加热温度低
(
或加热时间不够
)
(5)
取两支试管
,
加入等体积、等浓度的过氧化氢溶液
,
一支加入几滴
0.1 mol·L
-1
的
CuCl
2
溶液
,
另一支加入几滴
0.2 mol·L
-1
的
NaCl
溶液
,
滴加氯化铜溶液的试管产生气泡的速率快
(
其他合理答案也可
)
【
强化训练
】
1.
判断正误
(
正确的打“√”
,
错误的打“
×”)
(1)
除去铜粉中混有的
CuO,
加入稀硝酸
,
过滤、洗涤、干燥。
(
)
提示
:
×
。
Cu
、
CuO
都可溶于稀硝酸。
(2)
过量的铜与浓硝酸反应一定没有一氧化氮生成。
(
)
提示
:
×
。当浓硝酸变稀时生成
NO
。
(3)
利用无水硫酸铜遇水变成蓝色这一性质
,
来检验水的存在。
(
)
提示
:
√
。无水硫酸铜遇水生成蓝色的
CuSO
4
·5H
2
O
。
(4)
将铜丝插入浓硫酸加热
,
反应后把水加入反应器中
,
观察硫酸铜溶液的颜色。
(
)
提示
:
×
。应把反应液倒入水中。
(5)
将铜粉加入
1.0 mol·L
-1
Fe
2
(SO
4
)
3
溶液中
,
现象是溶液变蓝
,
有黑色固体出现。
(
)
提示
:
×
。铜粉不能置换出铁
,
故没有黑色固体出现。
(6)Cu
2
(OH)
2
CO
3
是铜锈的主要成分
,
在干燥的空气中不易生成。
(
)
提示
:
√
。铜锈的生成需要水参加反应。
2.(
高考试题改编
)
下列说法或转化正确的是
(
)
世纪金榜导学号
A.MgCO
3
MgCl
2
(aq) Mg
B.
工业上通过电解氯化钠溶液制备金属钠和氯气
C.
钢铁厂用热还原法冶炼铁
D.
工业上电解熔融状态的
Al
2
O
3
制备
Al
不涉及氧化还原反应
【
解析
】
选
C
。
Na
、
Mg
属于活泼金属
,
用电解熔融
NaCl
、
MgCl
2
的方法制备而不能电解
NaCl
溶液、
MgCl
2
溶液
,A
、
B
错误
;
电解熔融
Al
2
O
3
制取
Al
的反应为
2Al
2
O
3
(
熔融
)
4Al+3O
2
↑,
该反应属于氧化还原反应
,D
错误。
3. (2019·
济南模拟
)
某化学兴趣小组对金牌成分提出猜想
:
甲认为金牌是由纯金制造
;
乙认为金牌是由金银合金制成
;
丙认为金牌是由黄铜
(
铜锌合金
)
制成。为了验证他们的猜想
,
请你选择一种试剂来证明甲、乙、丙猜想的正误
(
)
A.
硫酸铜溶液
B.
稀硝酸
C.
盐酸
D.
硝酸银溶液
【
解析
】
选
B
。当金牌是纯金时遇到稀硝酸不溶解
;
当金牌是金银合金时遇到稀硝酸会部分溶解
;
当金牌是黄铜时遇到稀硝酸会全部溶解。
4.
新制氢氧化铜存在平衡
:Cu(OH)
2
+2OH
-
Cu(OH)
4
2-
(
深蓝色
)
。某同学进行下列实验
:
下列说法不正确的是
(
)
A.①
中出现蓝色沉淀
B.③
中现象是
Cu(OH)
2
+2OH
-
Cu(OH)
4
2-
正向移动的结果
C.④
中现象证明葡萄糖具有还原性
D.
对比②和④可知
Cu(OH)
2
氧化性强于
Cu(OH)
4
2-
【
解析
】
选
D
。
CuSO
4
溶液与
NaOH
溶液反应可生成蓝色沉
淀
Cu(OH)
2
,A
正确。新制
Cu(OH)
2
存在平衡
:Cu(OH)
2
+2OH
-
Cu(OH)
4
2-
,
加入
NaOH,
氢氧根离子的浓度增大
,
平
衡正向移动
,B
正确。③中加入葡萄糖溶液有砖红色的
沉淀生成
,
说明葡萄糖中含有醛基
,
所以葡萄糖具有还原
性
,C
正确。④中氧化葡萄糖的是
Cu(OH
)
4
2-
,
而②中未生
成砖红色沉淀
,
可知氧化性
:Cu(OH)
2
相关文档
- 2021新高考化学鲁科版一轮复习同步2021-07-082页
- 2018届高考一轮复习人教版金属及其2021-07-0816页
- 2019届二轮复习金属及其化合物作业2021-07-089页
- 化学人教版必修1练习:第三章金属及2021-07-089页
- 2018届二轮复习非金属及其化合物学2021-07-0823页
- 2020届化学高考二轮复习(浙江)非金属2021-07-086页
- 【知识学习】高一化学必修一《金属2021-07-0812页
- 全国通用2021高考化学一轮复习第四2021-07-087页
- 全国通用2021高考化学一轮复习第三2021-07-084页
- 2020年高考化学一轮复习金属及其化2021-07-0811页