- 260.92 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微考点17 氢氧化亚铁、高铁酸钾制备实验探究
题型一 氢氧化亚铁制备实验探究
1.(1)下列各图示中,能较长时间观察到Fe(OH)2白色沉淀的是________。
(2)用下列方法可制得白色的Fe(OH)2沉淀:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
①用硫酸亚铁晶体配制上述FeSO4溶液时还需加入________。
②除去蒸馏水中溶解的O2常采用________的方法。
③生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是___________________________________。
2.如图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验提供的试剂:铁屑、6mol·L-1硫酸溶液、NaOH溶液。下列说法错误的是( )
A.B中盛有一定量的NaOH溶液,A中应预先加入的试剂是铁屑
B.实验开始应先将活塞E关闭
5
C.生成Fe(OH)2的操作为关闭E,使A中溶液压入B瓶中
D.取下装置B中的橡皮塞,使空气进入,有关反应的化学方程式为4Fe(OH)2+O2+2H2O===4Fe(OH)3
3.(2018·全国卷Ⅰ,26)醋酸亚铬[(CH3COO)2Cr·2H2O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂。一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示。
回答下列问题:
(1)实验中所用蒸馏水均需经煮沸后迅速冷却,目的是
________________________________________________________________________。
仪器a的名称是________。
(2)将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置。打开K1、K2,关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为_____________________。
②同时c中有气体产生,该气体的作用是_____________________________________。
(3)打开K3,关闭K1和K2。c中亮蓝色溶液流入d,其原因是_______________________;
d中析出砖红色沉淀。为使沉淀充分析出并分离,需采用的操作是________、________、洗涤、干燥。
(4)指出装置d可能存在的缺陷__________________。
题型二 高铁酸钾制备实验探究
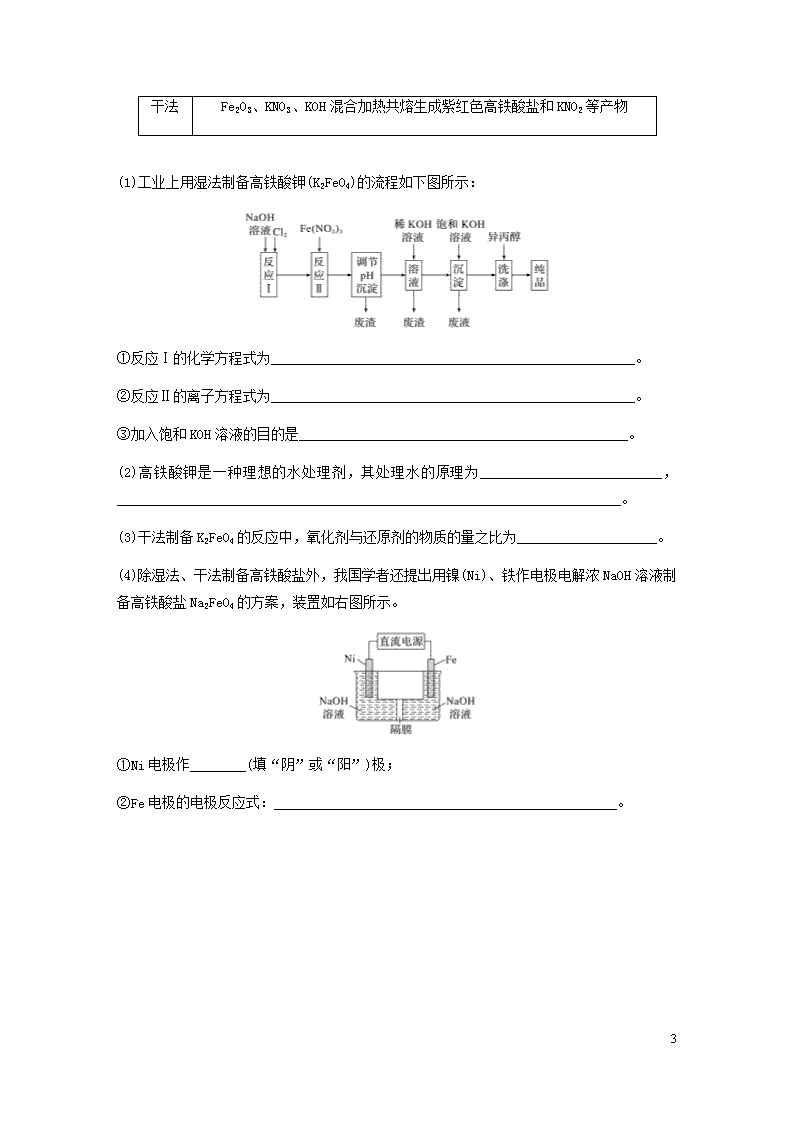
4.高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
5
干法
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
①反应Ⅰ的化学方程式为____________________________________________________。
②反应Ⅱ的离子方程式为____________________________________________________。
③加入饱和KOH溶液的目的是_______________________________________________。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为__________________________,________________________________________________________________________。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为____________________。
(4)除湿法、干法制备高铁酸盐外,我国学者还提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
①Ni电极作________(填“阴”或“阳”)极;
②Fe电极的电极反应式:_________________________________________________。
5
答案精析
1.(1)①②③⑤ (2)①稀硫酸、铁屑 ②煮沸 ③避免生成的Fe(OH)2沉淀接触O2
解析 (1)因为Fe(OH)2在空气中容易被氧化为红褐色的Fe(OH)3,因此要较长时间看到Fe(OH)2白色沉淀,就要排除装置中的氧气或空气。①、②原理相同,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢气的保护中;③的原理为铁作阳极产生Fe2+,与电解水产生的OH-结合生成Fe(OH)2,且液面用汽油保护,能防止空气进入;⑤中液面加苯阻止了空气进入;④由于带入空气中的氧气,能迅速将Fe(OH)2氧化,因而不能较长时间看到白色沉淀。
(2)①Fe2+易水解,要加入稀硫酸防止其水解;Fe2+易被空气中的O2氧化,要加Fe粉防止Fe2+被氧化。②气体的溶解度随温度升高而降低,所以煮沸后的水中溶解的O2较少。
2.B
3.(1)去除水中溶解氧 分液(或滴液)漏斗
(2)①Zn+2Cr3+===Zn2++2Cr2+ ②排除c中空气
(3)c中产生H2使压强大于大气压 (冰浴)冷却 过滤
(4)敞开体系,可能使醋酸亚铬与空气接触
解析 (1)由题给信息,(CH3COO)2Cr·2H2O在气体分析中用作O2吸收剂,说明Cr2+具有强还原性,易被O2氧化,故所用蒸馏水需经煮沸除去其中的O2,以免影响(CH3COO)2Cr·2H2O的制备。由仪器的结构特点可知,a为分液漏斗。
(2)①Zn将Cr3+还原为Cr2+,离子方程式为Zn+2Cr3+===Zn2++2Cr2+。②Zn+2H+===Zn2++H2↑,H2起到排除c中空气的作用,以防Cr2+被氧化。
(3)过量的Zn与盐酸反应放出大量的H2,使装置c中压强增大,关闭K1和K2,打开K3时,溶液被压入装置d。由题给信息知,(CH3COO)2Cr·2H2O难溶于冷水,因此应用冰浴冷却,以便于(CH3COO)2Cr·2H2O析出,再将沉淀过滤、洗涤、干燥即可。
(4)装置d的缺点是该装置与大气直接相通,空气中的O2易将(CH3COO)2Cr·2H2O氧化。
4.(1)①2NaOH+Cl2===NaCl+NaClO+H2O
②3ClO-+10OH-+2Fe3+===2FeO+3Cl-+5H2O ③增大K+浓度,促进K2FeO4晶体析出
(2)高铁酸钾有强氧化性,能杀菌消毒 产生的Fe(OH)3
5
胶粒有吸附性,有絮凝作用 (3)3∶1 (4)①阴 ②Fe-6e-+8OH-===FeO+4H2O
5
相关文档
- 福建省长乐市高级中学2020届高三上2021-07-089页
- 2021新高考化学鲁科版一轮复习突破2021-07-083页
- 高中化学第三章水溶液中的离子平衡2021-07-083页
- 【化学】重庆市大足区2018-2019学2021-07-0815页
- 【化学】海南省嘉积中学2019-20202021-07-0819页
- 化学名师讲练大一轮复习方略人教通2021-07-082页
- 浙江省嘉兴市2020届高三5月教学质2021-07-0831页
- 广东省深圳市普通高中2020届高三线2021-07-0818页
- 2020届高考化学二轮复习常考题型大2021-07-0822页
- 2018-2019学年四川省遂宁市高一下2021-07-088页