- 1.15 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
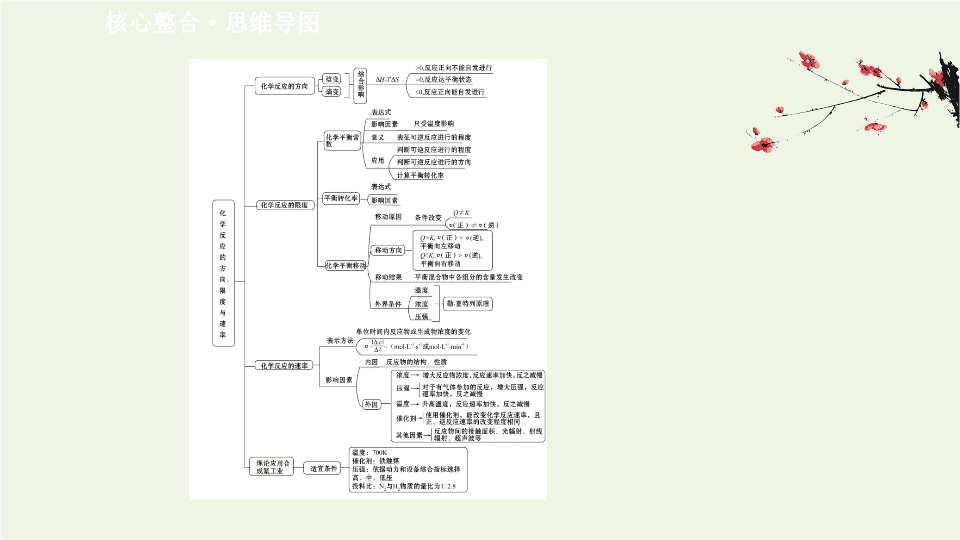
阶段复习课
第
2
章
核心整合
·
思维导图
情境探究
·
素养提升
1.
根据我国目前汽车业发展速度
,
预计
2020
年汽车保有量超过
2
亿辆
,
中国已成为全球最大的汽车市场。因此
,
如何有效处理汽车排放的尾气
,
是需要进行研究的一项重要课题。汽车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化合物等。
(1)
汽油燃油车上安装三元催化转化器
,
可有效降低汽车尾气污染发生的反应
为
2NO(g)+2CO(g) N
2
(g)+2CO
2
(g)
ΔH=-746.5 kJ·mol
-1
。研究
CO
和
NO
的
催化反应
,
用气体传感器测得在某温度下、一定体积的密闭容器中
,
不同时间
NO
和
CO
浓度如下表
:
时间
(s)
0
1
2
3
4
5
c(NO)/
(10
-4
mol·L
-1
)
10.0
4.50
2.50
1.50
1.00
1.00
c(CO)/
(10
-3
mol·L
-1
)
3.60
3.05
2.85
2.75
2.70
2.70
①
计算前
4 s
内的平均反应速率
v(CO)
。
提示
:
前
4 s
内的平均反应速率
v(CO)=
mol·L
-1
·s
-1
=2.25×10
-4
mol·L
-1
·s
-1
。
②从温度和压强角度分析有利于上述反应发生的条件。
提示
:
低温高压。因为此反应为气体体积减小的放热反应
,
因此加压、降温有
利于反应正向进行。
(2)
柴油燃油车是通过尿素
-
选择性催化还原
(Urea-SCR)
法处理氮氧化物。
Urea-SCR
的工作原理为尿素
[CO(NH
2
)
2
]
水溶液通过喷嘴喷入排气管中
,
当温度高于
160 ℃
时尿素水解
,
产生
NH
3
,
生成的
NH
3
与富氧尾气混合后
,
加入合适的催化剂
,
使氮氧化物得以处理。下图为在不同投料比
a
、
b[n(
尿素
)/n(NO)]
时
NO
转化效率随温度变化的曲线。
①
比较
a
、
b
的大小
;
提示
:
a>b
。增大尿素的量可提高
NO
的转化率
,
即尿素与
NO
物质的量比值越大
,NO
的转化率越大
,
则图象中
a>b
。
②由图可知
,
低于
400 ℃
时
,
温度升高
,NO
转化效率升高
,
分析原因。
提示
:
由图可知
,
随着温度升高
,
尿素水解释放氨气的速率加快
,c(NH
3
)
增大
,
且温度升高
,
催化剂活性增加
,
导致化学反应速率加快
,
故温度升高
,NO
转化效率升高。
③
温度过高
,NO
转化效率下降
,NO
的浓度反而升高
,
分析可能的原因。
提示
:
温度过高
,
发生反应
4NH
3
+5O
2
====4NO+6H
2
O,
生成
NO,
导致
NO
的浓度升高
,NO
转化效率下降。
2.
聚乙烯
(polyethylene ,
简称
PE)
是乙烯经聚合制得的一种热塑性树脂。
一定条件下合成乙烯的反应为
6H
2
(g)+2CO
2
(g) CH
2
=
CH
2
(g)+4H
2
O(g)
。已
知温度对
CO
2
的平衡转化率和催化剂催化效率的影响如图所示
:
(1)
判断该反应是吸热反应还是放热反应
?
提示
:
升高温度
,
二氧化碳的平衡转化率降低
,
则平衡逆向移动
,
逆反应为吸热反应
,
正反应为放热反应。
(2)
生成乙烯的速率
v(N)
一定大于
v(M)
吗
?
提示
:
不一定。化学反应速率随温度的升高而加快
,
但从图示中可以得出
N
点催化剂的催化效率降低
,
所以
v(N)
有可能小于
v(M)
。
(3)
当温度高于
250 ℃
时
,
升高温度
,
催化剂的催化效率为什么会降低
?
提示
:
催化剂的活性在适宜的温度范围内最高
,
温度过高
,
催化剂逐渐失去活性
,
导致催化剂的催化效率降低。
3.Ni(CO)
4
可用于有机合成
,
也常用作催化剂。一定条件下
,
一定容积的密闭容
器中
,
发生反应
:Ni(s)+4CO(g) Ni(CO)
4
(g),
已知该反应平衡常数与温度的
关系如下表
:
温度
/℃
25
80
230
平衡常数
5×10
4
2
1.9×10
-5
(1)25 ℃
达到平衡时
,
向容器中继续通入
CO,
判断
Ni
粉和
CO
转化率变化。
提示
:
向容器中继续通入
CO,
相当于增大压强
,
平衡正向进行
,Ni
粉和
CO
转化率均增大。
(2)
是不是温度越低
,
越有利于
Ni(CO)
4
的生成
?
提示
:
不是。由图表数据可知
,
温度升高平衡常数减小
,
说明反应是放热反应
,
降低温度平衡正向进行
,
但反应速率小
,
生产效益低
,
不利于
Ni(CO)
4
的生成。
(3)
在
80 ℃
时
,
测得某时刻
,Ni(CO)
4
、
CO
浓度均为
0.5 mol·L
-1
,
判断此时反应
进行的方向。
提示
:
逆向进行。依据浓度商计算和平衡常数比较分析判断反应进行的方向
,
在
80 ℃
时
,
测得某时刻
,Ni(CO)
4
、
CO
浓度均为
0.5 mol·L
-1
,Q=
=8>2,Q>K,
反应逆向进行。
4.
二甲醚又称甲醚
(DME)
是一种新兴的基本化工原料
,
由于其良好的易压缩、
冷凝、气化的特性
,
使得二甲醚在制药、燃料、农药等化学工业中有许多独特
的用途。如高纯度的二甲醚可代替氟里昂用作气溶胶喷射剂和致冷剂
,
减少对
大气环境的污染和臭氧层的破坏。采用一种新型的催化剂
(
主要成分是
Cu-Mn
合金
),
利用
CO
和
H
2
制备二甲醚。
主反应
:2CO(g)+4H
2
(g) CH
3
OCH
3
(g)+H
2
O(g)
副反应
:CO(g)+H
2
O(g) CO
2
(g)+H
2
(g)
CO(g)+2H
2
(g) CH
3
OH(g)
测得反应体系中各物质的产率或转化率与催化剂的关系如图所示。
则最有利于二甲醚的合成的催化剂中
n(Mn)/n(Cu)
约为多少
?
提示
:
2.0
。由图可知
,
当催化剂中
n(Mn)/n(Cu)
约为
2.0
时
,CO
的转化率最大
,
生成的二甲醚最多。
相关文档
- 【化学】河北省保定市第三中学20192021-07-0821页
- 高考化学四海八荒易错集专题10反应2021-07-0820页
- 2020届一轮复习人教版化学能与热能2021-07-0825页
- 高中化学第三章水溶液中的离子平衡2021-07-0813页
- 2021版化学名师讲练大一轮复习鲁科2021-07-087页
- 【化学】山东省济宁市嘉祥县第一中2021-07-0819页
- 人教版高二化学 第二节二氧化硫2021-07-084页
- 【化学】河北省唐山市第一中学20192021-07-0821页
- 【化学】河北省武邑中学2019-20202021-07-088页
- 福建省仙游县枫亭中学2019-2020学2021-07-087页