- 424.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 利用化学反应制备物质
[学习目标] 1.掌握实验室制备氯气的原理、净化方法及尾气处理方法。2.了解常见气体的实验室制备装置及收集方法。3.了解一些常见物质的制备原理。
一、氯气的制备方法
[自主学习]
1.氯气的实验室制法
(1)试剂:浓盐酸和MnO2。
(2)反应原理
化学反应方程式:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O。
离子反应方程式:MnO2+2Cl-+4H+Mn2++Cl2↑+2H2O。
①氧化剂是MnO2,还原剂是HCl,氧化剂与还原剂的物质的量之比为1∶2。
②在MnO2与浓盐酸反应制取氯气的反应中体现了浓盐酸的酸性、氧化性。
③若2 mol HCl参加反应,被氧化的HCl为1 mol。
(3)反应特点
固体+液体气体。
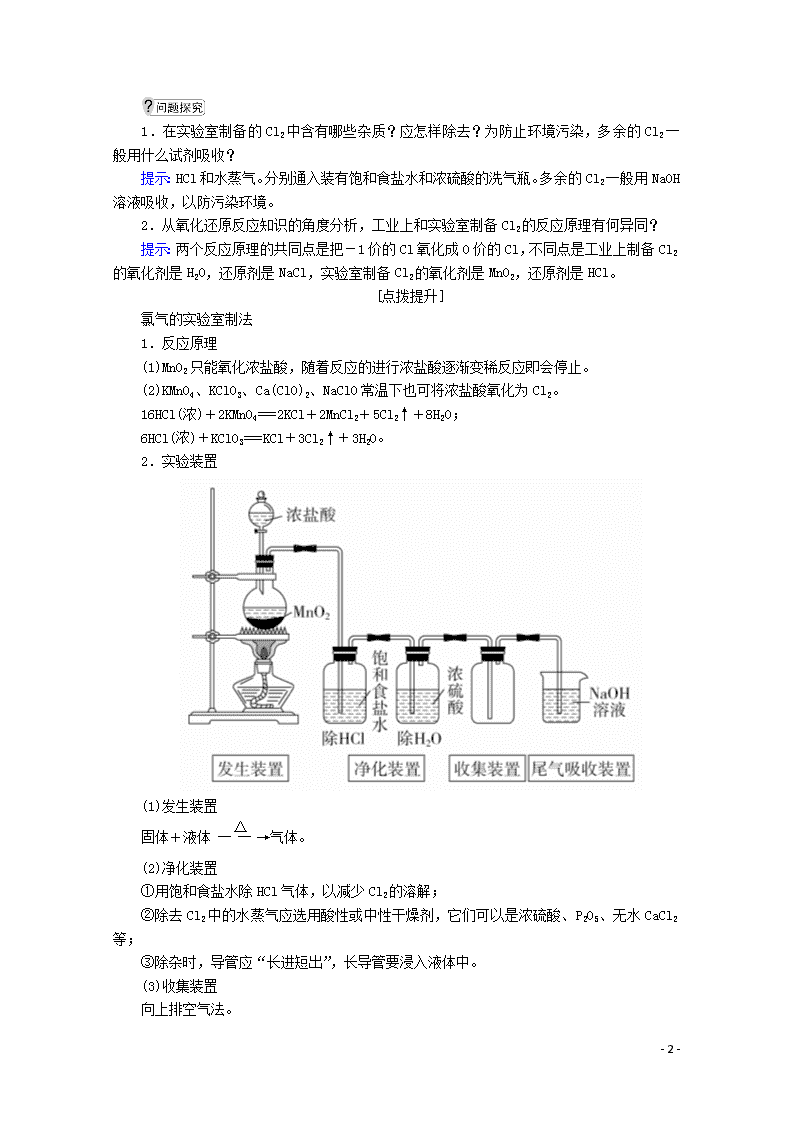
(4)实验装置
仪器名称:①分液漏斗,②圆底烧瓶。
2.氯气的工业制法——电解饱和食盐水
(1)化学方程式:2NaCl+2H2O2NaOH+H2↑+Cl2↑。
氧化剂是H2O,还原剂是NaCl。
(2)离子方程式:2Cl-+2H2O2OH-+H2↑+Cl2↑。
- 8 -
1.在实验室制备的Cl2中含有哪些杂质?应怎样除去?为防止环境污染,多余的Cl2一般用什么试剂吸收?
提示:HCl和水蒸气。分别通入装有饱和食盐水和浓硫酸的洗气瓶。多余的Cl2一般用NaOH溶液吸收,以防污染环境。
2.从氧化还原反应知识的角度分析,工业上和实验室制备Cl2的反应原理有何异同?
提示:两个反应原理的共同点是把-1价的Cl氧化成0价的Cl,不同点是工业上制备Cl2的氧化剂是H2O,还原剂是NaCl,实验室制备Cl2的氧化剂是MnO2,还原剂是HCl。
[点拨提升]
氯气的实验室制法
1.反应原理
(1)MnO2只能氧化浓盐酸,随着反应的进行浓盐酸逐渐变稀反应即会停止。
(2)KMnO4、KClO3、Ca(ClO)2、NaClO常温下也可将浓盐酸氧化为Cl2。
16HCl(浓)+2KMnO4===2KCl+2MnCl2+5Cl2↑+8H2O;
6HCl(浓)+KClO3===KCl+3Cl2↑+3H2O。
2.实验装置
(1)发生装置
固体+液体气体。
(2)净化装置
①用饱和食盐水除HCl气体,以减少Cl2的溶解;
②除去Cl2中的水蒸气应选用酸性或中性干燥剂,它们可以是浓硫酸、P2O5、无水CaCl2等;
③除杂时,导管应“长进短出”,长导管要浸入液体中。
(3)收集装置
向上排空气法。
- 8 -
(4)尾气处理装置
NaOH溶液吸收法。
(5)气体的验证
①观察集气瓶中气体颜色,瓶中充满黄绿色气体即收集满。
②用湿润的淀粉KI试纸放在瓶口,试纸变蓝。
[练习与活动]
1.用下列装置收集Cl2并进行尾气吸收,其中最合理的是( )
答案 C
解析 由于ρCl2>ρ空气,故采用向上排空气法收集Cl2,即导气管在试管中“长进短出”,排除A、B两项;用NaOH溶液吸收Cl2,为防止倒吸应使用倒扣漏斗,排除D项。
2.某化学小组用如图所示装置制取氯气。下列说法中错误的是( )
A.该装置图中至少存在两处明显错误
B.该实验中收集氯气的方法错误
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉KI试纸可以证明是否有氯气逸出
答案 B
解析
- 8 -
该反应应该用酒精灯加热,应该用分液漏斗而不是长颈漏斗,氯气有毒,应该进行尾气处理,故A、C正确;由于氯气的密度比空气的密度大,所以用向上排空气法收集,故B不正确;在集气瓶口处放一片湿润的淀粉KI试纸可以证明是否有氯气逸出,若有则变蓝,反之不变色,故D正确。
规律方法
实验室制备Cl2的尾气吸收装置中不能用水作吸收剂,同时也不能用饱和澄清石灰水作吸收剂,因为Ca(OH)2的溶解度很小,吸收不完全。
二、常见物质的制备
[自主学习]
1.几种气体物质的制备
2.常见固体或液体物质的工业制法
- 8 -
下列反应是否适宜于实验室制备气体?
(1)2Na+2H2O===2NaOH+H2↑
(2)Na2CO3+2HCl===2NaCl+H2O+CO2↑
(3)2NaCl+2H2O2NaOH+H2↑+Cl2↑
(4)2H2O22H2O+O2↑
(5)2H2O2H2↑+O2↑
(6)CaCO3+H2SO4===CaSO4+H2O+CO2↑
(7)NH4ClNH3↑+HCl↑
提示:(1)(2)(3)(5)(6)(7)不适宜于实验室制备气体。实验室制取气体要求原理正确,反应速率适宜,反应条件较容易实现,操作简单、安全等。(1)和(2)反应过快,(3)和(5)反应条件不易操作,(6)和(7)原理不正确,CaSO4微溶于水,阻止进一步反应;NH3和HCl遇冷又会生成NH4Cl。
- 8 -
[点拨提升]
实验室制取气体的一套完整的装置应当由四部分组成:
―→―→―→
1.气体的发生装置通常是根据制取气体所需的反应物状态(固体或液体)及反应条件(加热还是不加热)来进行选择,中学阶段常见气体发生装置有固—固加热、固—液加热、固—液不加热三种。
2.收集气体需根据气体的溶解度、与空气的相对密度等来选择。此外,还可用球胆或袋囊、塑料袋等收集。
3.净化装置需根据气体中混有的杂质的性质来选择,选择的标准是所选试剂能与杂质反应,但不与主要成分气体反应。如除去酸性气体杂质可选用碱性溶液或碱石灰,除去碱性气体杂质可选用浓硫酸或P2O5,干燥氯气选用浓硫酸,干燥氨气选用碱石灰。
4.尾气处理的主要目的是防止污染空气或使人中毒以及某些尾气在有限空间内达到爆炸极限。常用方法有:
(1)点燃法:如CO、H2、CH4等易燃性气体可用此法。
(2)吸收法:如HCl、SO2等可用水或碱液吸收;NH3可用水吸收。
(3)转化法:采用一定的方法,使有毒气体转化为无毒气体即可排放。如NO、NO2转化成N2即可排放,CO转化为CO2排放。
[练习与活动]
3.实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
- 8 -
答案 B
解析 A项,氨气的收集应使用向下排空气法,而图中为向上排空气法,A不正确;B正确;C项,铜与稀硝酸反应生成NO,不能用向上排空气法收集NO,而c中收集的是NO2,应由浓硝酸与铜反应制取,C不正确;D项,缺少加热装置,不能制取Cl2,D不正确。
4.下列制备和收集气体的实验装置合理的是( )
答案 D
解析 用氯化铵和氢氧化钙制NH3,盛放固体反应物的大试管的管口应该略向下倾斜,防止试管炸裂,A不正确;用MnO2和浓盐酸制Cl2需要加热,且集气瓶中导管应长进短出,B不正确;应该用向下排空气法或排水法收集H2 ,C不正确。
规律方法
- 8 -
实验室制取气体并进行性质实验的操作步骤:连接组装仪器―→检验装置的气密性―→装入药品―→制取―→除杂、净化、干燥―→收集、验满―→性质验证―→尾气处理―→拆卸仪器并洗刷收存。可简记为连、检、装、制、净、集、验、拆。
本课归纳总结
气体实验装置的设计
(1)装置顺序:制气装置→净化装置→反应或收集装置→尾气吸收装置。
(2)安装顺序:由下向上,由左向右。
(3)操作顺序:装配仪器→检验气密性→加入药品。
- 8 -