- 995.49 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题十 盐类水解 沉淀溶解平衡
挖命题
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
盐类水解原理及其应用
了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用
2017课标Ⅰ,13,6分
难
弱酸电离平衡常数的计算与应用
★★★
2016课标Ⅲ,13,6分
中
Ksp及电荷守恒的应用
沉淀溶解平衡及其应用
1.了解难溶电解质的沉淀溶解平衡
2.理解溶度积(Ksp)的含义,能进行相关的计算
2018课标Ⅲ,12,6分
难
★★★
分析解读 盐类的水解是高考的重点,每年高考都有考查该知识的试题,考查的形式有两种:一种是以选择题形式出现,综合考查包括盐类水解和沉淀溶解平衡在内的水溶液中的平衡内容;另一种是以非选择题形式出现,一般赋分6~12分。考查的重点内容有:①分析盐对水的电离程度的影响并进行定性判断或定量计算;②pH大小的比较;③微粒浓度大小的比较等。从近几年的高考试题来看,将盐类水解与其他知识有机地结合起来一起考查学生各方面的能力,仍将是今后命题的基本方向。关于沉淀的溶解平衡知识在近几年的高考试题中也有考查,预计在今后的高考中,本部分知识仍然是考查的重点,可以结合图像在选择题或综合题中考查,试题难度较大。
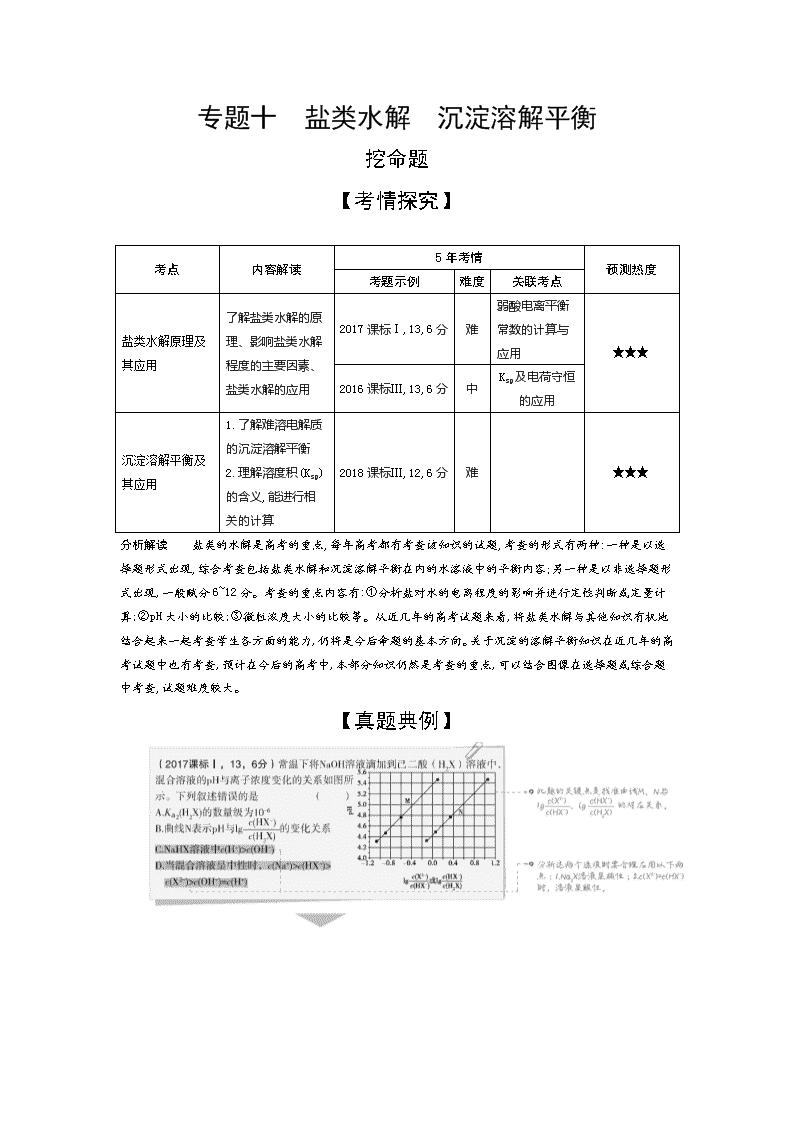
【真题典例】
破考点
【考点集训】
考点一 盐类水解原理及其应用
1.(2018浙江“七彩阳光”联盟期初联考,8)下列盐类水解的应用不正确的是( )
A.实验室配制氯化铁溶液时,滴入少量稀硫酸抑制水解
B.为使纯碱溶液的去油污效果更好,可以使用热的纯碱溶液
C.明矾可用于净水,是由于溶于水后产生的Al(OH)3胶体具有吸附作用
D.铵态氮肥不能和草木灰混合施用,是由于NH4+与CO32-互相促进水解,肥效下降
答案 A
2.(2017河南百校联盟3月联盟,11)25 ℃时,有pH=2的HX溶液和HY溶液各1 mL ,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是( )
A.a、c两点对应HX的电离平衡常数:Ka(c)>Ka(a)
B.a、b两点对应的溶液中:c(X-)>c(Y-)
C.等物质的量浓度的NaX和NaY的混合溶液中:c(HY)>c(HX)
D.分别向10 mL 0.1 mol/L HX溶液和10 mL 0.1 mol/L HY溶液中滴加同浓度的氢氧化钠溶液至pH=7,消耗氢氧化钠溶液较少的是HX
答案 C
3.(2018安徽江南十校综合素质检测,12)常温下,下列有关叙述不正确的是( )
A.若NH4Cl溶液的pH=6,则c(Cl-)-c(NH4+)=9.9×10-7 mol·L-1
B.CH3COONa和CaCl2混合溶液中:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
C.等物质的量浓度的Na2CO3与NaHCO3的混合溶液中:2c(Na+)=3c(CO32-)+3c(HCO3-)+3c(H2CO3)
D.已知H2A的Ka1=4.17×10-7,Ka2=4.9×10-11,则NaHA溶液呈碱性
答案 B
4.(2018山西太原3月模拟,12)室温下,下列溶液中微粒浓度关系一定正确的是( )
A.0.1 mol·L-1 Na2CO3溶液中,加水稀释,c(HCO3-)c(CO32-)的值减小
B.pH=7的氨水与氯化铵的混合溶液中:c(Cl-)>c(NH4+)
C.0.1 mol·L-1的硫酸铝溶液中:c(SO42-)>c(Al3+)>c(H+)>c(OH-)
D.pH=2的醋酸溶液和pH=12的NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH)
答案 C
5.(2019届辽宁六校协作体期初联考,12)20 ℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100 mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
A.①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B.Q点对应的溶液中lgc(H+)c(HCO3-)>c(OH-)>c(H+)
B.叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+)
C.常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-)
D.常温下pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后溶液pH>7
答案 D
7.(2017山西太原一模,13)常温下,向1 L pH=10的KOH溶液中持续通入CO2。溶液中水电离出的c(OH-)与通入CO2的体积(V)关系如图所示。下列叙述不正确的是( )
A.b点溶液呈中性
B.d 点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
C.c点溶液中:2c(H2CO3)+c(H+)+c(HCO3-)=c(OH-)
D.a点溶液中:水电离出的c(H+)=1×10-10mol·L-1
答案 A
考点二 沉淀溶解平衡及其应用
1.(2019届四川成都顶级名校零诊,19)已知t ℃时AgCl的Ksp=4×10-10,在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.在t ℃时,Ag2CrO4的Ksp为1×10-11
B.在饱和Ag2CrO4溶液中加入K2CrO4(s)可使溶液由Y点到Z点
C.在t ℃,Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO42-(aq)的平衡常数K=6.25×107
D.在t ℃时,用0.001 mol·L-1 AgNO3溶液滴定20 mL 0.001 mol·L-1 KCl和0.001 mol·L-1的K2CrO4的混合溶液,CrO42-先沉淀
答案 D
2.(2019届辽宁五校协作体联合模拟,14)25 ℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图所示。已知Ksp(PbCO3)c(CH3COO-)>c(OH-)>c(H+)
D.用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
答案 B
8.(2017广东揭阳期末,10)下列实验能达到实验目的的是( )
编号
实验内容
实验目的
A
向含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅
证明Na2CO3溶液中存在水解平衡
B
室温下,用pH试纸分别测定浓度为18 mol/L和0.1 mol/L H2SO4溶液的pH
比较不同浓度H2SO4溶液的酸性强弱
C
配制FeCl2溶液时,先将FeCl2溶于适量浓盐酸中,再用蒸馏水稀释到所需浓度,最后在试剂瓶中加入少量铜粉
抑制Fe2+水解,并防止Fe2+被氧化
D
向10 mL 0.2 mol/L NaOH溶液中滴入2滴0.1 mol/L MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol/L FeCl3溶液,又生成红褐色沉淀
证明在相同温度下
Ksp[Mg(OH)2]>
Ksp[Fe(OH)3]
答案 A
炼技法
方法集训
方法 微粒浓度大小的比较及电解质溶液中微粒之间的定量关系
1.(2018湖北黄冈调研,13)室温时,配制一组c(H2A)+c(HA-)+c(A2-)=0.10 mol·L-1的H2A和NaOH的混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法中正确的是( )
A.在c(Na+)=0.10 mol·L-1的溶液中:c(A2-)-c(H+)=c(H2A)-c(OH-)
B.pH=4的溶液中:c(HA-)=c(H2A)+c(A2-)
C.pH=7的溶液中:c(Na+)=c(A2-)+c(HA-)
D.Ka1(H2A)的数量级为10-5
答案 A
2.(2018广东茂名五大联盟学校5月联考,13)类比pH的定义,对于稀溶液可以定义pC=-lgc。常温下,某浓度的H2A溶液在不同pH下,测得pC(H2A)、pC(HA-)、pC(A2-)的变化如图所示。下列说法中正确的是( )
A.曲线Ⅱ表示pC(HA-)随pH的变化
B.当pH=1.40时,c(H2A)>c(A2-)>c(HA-)
C.常温下,c(H2A)·c(A2-)c2(HA-)=104.50
D.a、b、c三点对应的溶液中,c(H2A)+c(HA-)+c(A2-)的值相等
答案 D
3.(2018辽宁师大附中期中,17)室温下,用0.1 mol/L盐酸滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )
A.水电离程度由大到小的顺序为:a>b>c>d
B.a点时:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
C.b点时:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
D.d点时:c(H+)>c(HCO3-)=c(CO32-)
答案 A
过专题
【五年高考】
A组 统一命题·课标卷题组
考点一 盐类水解原理及其应用
1.(2016课标Ⅲ,13,6分)下列有关电解质溶液的说法正确的是 ( )
A.向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)c(CH3COOH)减小
B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)c(CH3COOH)·c(OH-)增大
C.向盐酸中加入氨水至中性,溶液中c(NH4+)c(Cl-)>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中c(Cl-)c(Br-)不变
答案 D
考点二 沉淀溶解平衡及其应用
2.(2018课标Ⅲ,12,6分)用0.100 mol·L-1AgNO3滴定50.0 mL 0.050 0 mol·L-1Cl-溶液的滴定曲线如图所示。下列有关描述错误的是( )
A.根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C.相同实验条件下,若改为0.040 0 mol·L-1Cl-,反应终点c移到a
D.相同实验条件下,若改为0.050 0 mol·L-1Br-,反应终点c向b方向移动
答案 C
3.(2017课标Ⅲ,13,6分)在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )
A.Ksp(CuCl)的数量级为10-7
B.除Cl-反应为Cu+Cu2++2Cl- 2CuCl
C.加入Cu越多,Cu+浓度越高,除Cl-效果越好
D.2Cu+ Cu2++Cu平衡常数很大,反应趋于完全
答案 C
4.(2014课标Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误··的是( )
A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
答案 A
5.(2016课标Ⅰ,27,15分)元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在。Cr(OH)3为难溶于水的灰蓝色固体。回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是
。
(2)CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示。
①用离子方程式表示Na2CrO4溶液中的转化反应 。
②由图可知,溶液酸性增大,CrO42-的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH 0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为 mol·L-1,此时溶液中c(CrO42-)等于 mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为
。
答案 (1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液
(2)①2CrO42-+2H+ Cr2O72-+H2O
②增大 1.0×1014
③小于
(3)2.0×10-5 5.0×10-3
(4)Cr2O72-+3HSO3-+5H+ 2Cr3++3SO42-+4H2O
B组 自主命题·省(区、市)卷题组
考点一 盐类水解原理及其应用
1.(2018北京理综,11,6分)测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻
①
②
③
④
温度/℃
25
30
40
25
pH
9.66
9.52
9.37
9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是( )
A.Na2SO3溶液中存在水解平衡:SO32-+H2OHSO3-+OH-
B.④的pH与①不同,是由于SO32-浓度减小造成的
C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的KW值相等
答案 C
2.(2018天津理综,6,6分)LiH2PO4是制备电池的重要原料。室温下,LiH2PO4溶液的pH随c初始(H2PO4-)的变化如图1所示,H3PO4溶液中H2PO4-的分布分数δ随pH的变化如图2所示[δ=c(H2PO4-)c总(含P元素的粒子)]。
下列有关LiH2PO4溶液的叙述正确的是( )
A.溶液中存在3个平衡
B.含P元素的粒子有H2PO4-、HPO42-和PO43-
C.随c初始(H2PO4-)增大,溶液的pH明显变小
D.用浓度大于1 mol·L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PO4几乎全部转化为LiH2PO4
答案 D
3.(2016四川理综,7,6分)向1 L含0.01 mol NaAlO2和0.02 mol NaOH的溶液中缓慢通入CO2,随n(CO2)增大,先后发生三个不同的反应,当0.01 molc(AlO2-)+c(OH-)
B
0.01
c(Na+)>c(AlO2-)>c(OH-)>c(CO32-)
C
0.015
c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
D
0.03
c(Na+)>c(HCO3-)>c(OH-)>c(H+)
答案 D
4.(2015江苏单科,14,4分)室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A.向0.10 mol·L-1 NH4HCO3溶液中通CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B.向0.10 mol·L-1 NaHSO3溶液中通NH3:c(Na+)>c(NH4+)>c(SO32-)
C.向0.10 mol·L-1 Na2SO3溶液中通SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D.向0.10 mol·L-1 CH3COONa溶液中通HCl:c(Na+)>c(CH3COOH)=c(Cl-)
答案 D
5.(2015天津理综,5,6分)室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质
结论
A.
50 mL 1 mol·L-1 H2SO4
反应结束后,c(Na+)=c(SO42-)
B.
0.05 mol CaO
溶液中c(OH-)c(HCO3-)增大
C.
50 mL H2O
由水电离出的c(H+)·c(OH-)不变
D.
0.1 mol NaHSO4固体
反应完全后,溶液pH减小,c(Na+)不变
答案 B
6.(2015安徽理综,13,6分)25 ℃时,在10 mL浓度均为0.1 mol·L-1的NaOH和NH3·H2O混合溶液中滴加0.1 mol·L-1盐酸,下列有关溶液中粒子浓度关系正确的是( )
A.未加盐酸时:c(OH-)>c(Na+)=c(NH3·H2O)
B.加入10 mL盐酸时:c(NH4+)+c(H+)=c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-)=c(Na+)
D.加入20 mL盐酸时:c(Cl-)=c(NH4+)+c(Na+)
答案 B
7.(2015四川理综,6,6分)常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是( )
A.KWc(H+)<1.0×10-7mol/L
B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+2c(CO32-)
D.c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-)
答案 C
考点二 沉淀溶解平衡及其应用
8.(2016天津理综,3,6分)下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热(ΔH)
B.金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关
C.原电池中发生的反应达平衡时,该电池仍有电流产生
D.在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小
答案 D
9.(2015天津理综,3,6分)下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.饱和Na2SO4溶液或浓硝酸均可使蛋白质溶液产生沉淀,但原理不同
C.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
D.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
答案 C
C组 教师专用题组
考点一 盐类水解原理及其应用
1.(2018江苏单科,14,4分)H2C2O4为二元弱酸,Ka1(H2C2O4)=5.4×10-2,Ka2(H2C2O4)=5.4×10-5,设H2C2O4溶液中c(总)=c(H2C2O4)+c(HC2O4-)+c(C2O42-)。室温下用NaOH溶液滴定25.00 mL 0.100 0 mol·L-1 H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是(双选)( )
A.0.100 0 mol·L-1 H2C2O4溶液:c(H+)=0.100 0 mol·L-1+c(C2O42-)+c(OH-)-c(H2C2O4)
B.c(Na+)=c(总)的溶液:c(Na+)>c(H2C2O4)>c(C2O42-)>c(H+)
C.pH=7的溶液:c(Na+)=0.100 0 mol·L-1+c(C2O42-)-c(H2C2O4)
D.c(Na+)=2c(总)的溶液:c(OH-)-c(H+)=2c(H2C2O4)+c(HC2O4-)
答案 AD
2.(2016江苏单科,14,4分)H2C2O4为二元弱酸。20 ℃时,配制一组c(H2C2O4)+ c(HC2O4-)+c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是(双选)( )
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42-)> c(HC2O4-)
B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O42-)
C.c(HC2O4-)=c(C2O42-)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O4-)
D.pH=7.0的溶液中:c(Na+)>2c(C2O42-)
答案 BD
3.(2014福建理综,10,6分)下列关于0.10 mol·L-1NaHCO3溶液的说法正确的是( )
A.溶质的电离方程式为NaHCO3 Na++H++CO32-
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
D.温度升高,c(HCO3-)增大
答案 B
4.(2014江苏单科,14,4分)25 ℃时,下列有关溶液中微粒的物质的量浓度关系正确的是(双选)( )
A.0.1 mol·L-1CH3COONa溶液与0.1 mol·L-1 HCl溶液等体积混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(OH-)
B.0.1 mol·L-1 NH4Cl溶液与0.1 mol·L-1氨水等体积混合(pH>7):c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)
C.0.1 mol·L-1 Na2CO3溶液与0.1 mol·L-1 NaHCO3溶液等体积混合:23c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D.0.1 mol·L-1 Na2C2O4溶液与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
答案 AC
5.(2014安徽理综,11,6分)室温下,下列溶液中粒子浓度关系正确的是( )
A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S)
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-)
D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-)
答案 B
6.(2013四川理综,5,6分)室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略体积变化),实验数据如下表:
实验编号
起始浓度/(mol/L)
反应后溶
液的pH
c(HA)
c(KOH)
①
0.1
0.1
9
②
x
0.2
7
下列判断不正确的是( )
A.实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+)
B.实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=KW1×10-9 mol/L
C.实验②反应后的溶液中:c(A-)+c(HA)>0.1 mol/L
D.实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
答案 B
7.(2013安徽理综,13,6分)已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O H2SO3+OH- ①
HSO3- H++SO32- ②
向0.1 mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是( )
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+12c(SO32-)
C.加入少量NaOH溶液,c(SO32-)c(HSO3-)、c(OH-)c(H+)的值均增大
D.加入氨水至中性,则2c(Na+)=c(SO32-)>c(H+)=c(OH-)
答案 C
8.(2013福建理综,8,6分)室温下,对于0.10 mol·L-1的氨水,下列判断正确的是( )
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH- Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH-)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
答案 C
考点二 沉淀溶解平衡及其应用
9.(2015浙江理综,13,6分)某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
下列说法不正确的是( )
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
答案 D
10.(2014四川理综,4,6分)下列实验方案中,不能达到实验目的的是( )
选项
实验目的
实验方案
A
检验CH3CH2Br在NaOH溶液中是否发生水解
将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀
B
检验Fe(NO3)2晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
C
验证Br2的氧化性强于I2
将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色
D
验证Fe(OH)3的溶解度小于Mg(OH)2
将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
答案 B
11.(2014安徽理综,12,6分)中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
选项
规律
结论
A
较强酸可以制取较弱酸
次氯酸溶液无法制取盐酸
B
反应物浓度越大,反应速率越快
常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
C
结构和组成相似的物质,沸点随相对分子质量增大而升高
NH3沸点低于PH3
D
溶解度小的沉淀易向溶解度更小的沉淀转化
ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀
答案 D
12.(2013江苏单科,14,4分)一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p(CO32-)=-lg c(CO32-)。下列说法正确的是(双选)( )
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b点可表示CaCO3的饱和溶液,且c(Ca2+)c(A-)>c(HA)>c(OH-)
答案 A
3.(2019届山西太原定时训练,12)常温下,用AgNO3溶液分别滴定浓度均为0.01 mol·L-1的KCl、K2C2O4溶液,所得的沉淀溶解平衡图像如图所示(不考虑C2O42-的水解)。下列叙述正确的是( )
A.Ksp(Ag2C2O4)的数量级等于10-7
B.n点表示AgCl的不饱和溶液
C.向c(Cl-)=c(C2O42-)的混合液中滴入AgNO3溶液时,先生成Ag2C2O4沉淀
D.Ag2C2O4(s)+2Cl-(aq)2AgCl(s)+C2O42-(aq)的平衡常数为109.04
答案 D
4.(2017湖南、湖北八市十二校第一次联考,10)下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
A.等物质的量浓度的下列物质的溶液:①H2CO3 ②Na2CO3 ③NaHCO3 ④(NH4)2CO3,其中c(CO32-)的大小关系为:②>④>③>①
B.pH=2的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.向0.2 mol/L NaHCO3溶液中加入等体积0.1 mol/L NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+)
D.常温下,同浓度的CH3COONa与CH3COOH溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+)
答案 A
5.(2018湖北部分重点中学联考,14)常温下,体积为1 mL、浓度均为0.10 mol/L的XOH和X2CO3溶液,分别加水稀释至V mL,pH随lgV的变化情况如图所示。下列叙述中正确的是( )
A.XOH是弱碱
B.已知H2CO3的电离平衡常数Ka1远大于Ka2,则Ka2约为1.0×10-10.2
C.pH=10的两种溶液中的c(X+):XOH大于X2CO3
D.当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则c(HCO3-)/c(CO32-)的值减小
答案 B
6.(2017安徽安庆二模,12)298 K时,在20 mL b mol·L-1氢氧化钠溶液中滴入0.1 mol·L-1的醋酸溶液,溶液的pH与所加醋酸溶液的体积关系如图所示。下列有关叙述正确的是( )
A.a<20
B.C点溶液中:c(CH3COO-)+c(CH3COOH)=c(Na+)
C.A、B、C、D四点溶液中水的电离程度大小顺序为:D>B>C>A
D.醋酸的电离平衡常数Ka=2.0×10-7/(0.1a-2)
答案 D
7.(2017河南中原名校质检,13)已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=2.2×10-20,在某含有Fe3+和Cu2+的溶液中,c(Fe3+)为4.0×10-8mol·L-1。现向该溶液中滴加氨水,当开始出现氢氧化铁沉淀时,溶液的pH及溶液中允许的最大c(Cu2+)为( )
A.10 2.2 mol·L-1 B.4 2.2×10-1 mol·L-1
C.4 2.2 mol·L-1 D.10 2.2×10-1 mol·L-1
答案 C
8.(2018陕西西安长安一中四检,5)已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12。如图是向10 mL AgNO3溶液中逐滴加入0.1 mol·L-1的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像(实线)。根据图像所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
A.原AgNO3溶液的物质的量浓度为0.1 mol·L-1
B.把0.1 mol·L-1的NaCl换成0.1 mol·L-1 NaI,则图像在终点后变为虚线
C.图中X点表示溶液中Ag+被恰好完全沉淀
D.图中X点的坐标为(100,6)
答案 D
二、非选择题(共52分)
9.(2018广东珠海摸底,15)(16分)二氯亚砜(SOCl2)是一种无色易挥发液体,熔点-105 ℃,沸点79 ℃,140 ℃以上易分解,遇水剧烈反应生成SO2与HCl,常用作脱水剂。
(1)SOCl2遇水发生反应的化学方程式为 。
(2)甲同学用下图装置制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
①装置的连接顺序为:A→B→ → → → 。
②适合A的加热方式是 ,冷凝管的进水口是 (填“a”或“b”)。
③一段时间后,F中观察到的现象是 ,C中新增的阴离子可能有 。
④乙同学认为直接将ZnCl2·xH2O置于坩埚中加热即可得到无水ZnCl2,你认为这种方法是否可行,并说明原因: 。
(3)若用SOCl2作FeCl3·6H2O的脱水剂,有可能会发生氧化还原反应,请设计实验证明。
实验方案:取少量FeCl3·6H2O于试管中,加入过量SOCl2,振荡;
。
答案 (除标注外,每空2分)(1)SOCl2+H2O SO2↑+2HCl↑(HCl后可不标“↑”,若写先反应生成H2SO3, H2SO3再分解也可)
(2)①D(0.5分) E(0.5分) F(0.5分) C(0.5分) ②水浴加热 b ③品红溶液褪色 Cl-、HSO3-、SO32- ④不可行,因为ZnCl2加热时发生水解
(3)方法一:往试管中加水溶解,滴加BaCl2溶液,若生成白色沉淀,则证明脱水过程发生了氧化还原反应
方法二:往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程发生了氧化还原反应
方法三:往试管中加水溶解,滴加K3[Fe(CN)6]溶液,若生成蓝色沉淀,则证明脱水过程发生了氧化还原反应
10.(2017江西南昌一模,27)(18分)水合碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]又称轻质碳酸镁。常利用菱镁矿(质量含量为碳酸镁90%,碳酸钙10%)碳化法制取:
(1)根据下列表格数据,选择消化反应的最佳温度为 ;理由是 。
消化温度/℃
30
40
50
60
70
80
90
转化率/%
50.3
58.2
85.1
85.2
90.7
91.2
91.5
(2)碳化反应可生成Mg(HCO3)2,生成Mg(HCO3)2的化学方程式为 。
(3)流程图中 和 可以为碳化反应提供二氧化碳源。
(4)有工艺设计利用卤水碳化法制取轻质碳酸镁:
①卤水中含有Fe2+和Mn2+,当其浓度小于1×10-5mol/L时,可以认为完全除去。常温时当调节溶液pH为9.5时,此时Mn2+小于 mol/L,不会沉淀出来。
物质
Mg(OH)2
Fe(OH)3
Fe(OH)2
Mn(OH)2
Ksp
10-11
10-39
10-17
10-14
②如果把Fe2+转化为Fe3+,从环保角度考虑选择最合适的氧化剂为 。
A.Ca(ClO)2 B.Cl2
C.H2O2 D.HNO3
③下列方案中,较好的为 ,理由是 。
答案 (每空2分)(1)70 ℃ 温度进一步升高同等幅度,转化率增幅不大,但能耗增加
(2)Mg(OH)2+2CO2 Mg(HCO3)2
(3)煅烧反应 热解反应
(4)①10-5 ②C ③方案2 加入碳酸钠的产品中易混入更多杂质,不易提纯
11.(2018安徽合肥二模,27)(18分)二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
已知:ⅰ.Ce4+能与F-结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能;
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6 mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是 、 (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式: 。
(3)“萃取”时存在反应:Ce4++n(HA)2 Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=c[Ce(H2n-4A2n)]c{[CeSO4]2+})。保持其他条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是
。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:Ce(BF4)3(s)+3K+(aq) 3KBF4(s)+Ce3+(aq)。若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K= (用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为 。在“反萃取”后所得水层中加入1.0 mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5 mol·L-1],溶液中c(CO32-)约为 。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2 CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:
。
答案 (1)将矿石粉碎成细颗粒(2分) 通入大量空气(2分)
(2)CeO2+4H++SO42- [CeSO4]2++2H2O(2分)
(3)随着c(SO42-)增大,水层中Ce4+与SO42-结合成[CeSO4]2+,导致萃取平衡向生成[CeSO4]2+的方向移动,D减小(3分)
(4)ab3(2分)
(5)2Ce4++H2O2 2Ce3++O2↑+2H+(2分) 1×10-6 mol·L-1(2分)
(6)2xCO+CeO2 CeO2(1-x)+2xCO2(3分)
相关文档
- 2020届高考化学一轮复习化学平衡图2021-07-0825页
- 2020届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学平衡图2021-07-0811页
- 2020届高考化学一轮复习化学常用计2021-07-089页
- 2020届高考化学一轮复习化学能与热2021-07-087页
- 2021届高考化学一轮复习化学平衡及2021-07-0815页
- 2020届高考化学一轮复习化学平衡常2021-07-0811页
- 2021届高考化学一轮复习化学实验仪2021-07-089页
- 2021届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学实验的2021-07-0812页