- 274.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业25 难溶电解质的溶解平衡
时间:45分钟
一、选择题
1.(2020·山东枣庄三中段考)牙齿表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s)5Ca2+(aq)+3PO(aq)+OH-(aq) Ksp=6.8×10-37。已知Ca5(PO4)3F(s)的Ksp=2.8×10-61。下列说法错误的是( C )
A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿
B.由题述平衡可知,小孩长牙时要少吃糖多补钙
C.若减少OH-的浓度,题述平衡将向右移动,Ksp的值相应增大
D.使用含氟牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)
解析:本题考查溶度积常数、沉淀的转化等。残留在牙齿上的糖发酵会产生H+,与OH-反应生成H2O,促使Ca5(PO4)3OH(s)的沉淀溶解平衡正向移动,易造成龋齿,A正确;小孩长牙时,要在牙齿表面形成Ca5(PO4)3OH(s),从平衡移动角度分析,要增大牙齿表面的c(Ca2+)、c(OH-),促使Ca5(PO4)3OH(s)溶解平衡逆向移动,故小孩长牙时要少吃糖多补钙,B正确;减少OH-的浓度,Ca5(PO4)3OH(s)溶解平衡将向右移动,由于温度不变,Ksp的值不变,C错误;由于Ca5(PO4)3F的Ksp小于Ca5(PO4)3OH的Ksp,使用含氟牙膏,使Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s),可有效防止龋齿,D正确。
2.(2020·重庆合川中等七校联考)向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2OAg(NH3)+2H2O,平衡常数记为K[Ag(NH3)],下列分析不正确的是( B )
A.浊液中存在溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq)
B.实验表明实验室可用氨水洗涤附着有银的试管
C.由实验可以判断:NH3结合Ag+的能力比Cl-强
D.由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
解析:本题考查沉淀的溶解平衡、沉淀的转化等。AgCl是难溶电解质,在浊液中存在溶解平衡:AgCl(s)Ag+(aq)+Cl-(aq),A正确。Ag+与NH3·H2O反应生成Ag(NH3),但单质银与NH3·H2O不能反应,可用稀硝酸洗涤附着有银的试管,B错误。AgCl浊液中滴加氨水后可得到澄清溶液,生成Ag(NH3),说明Ag+结合NH3的能力比Cl-强,C正确。加浓硝酸后,NH3·H2O与H+反应生成NH,使平衡Ag++2NH3·H2OAg(NH3)+2H2O逆向移动,c(Ag+)增大,Ag+再与Cl-结合生成AgCl沉淀,D正确。
9
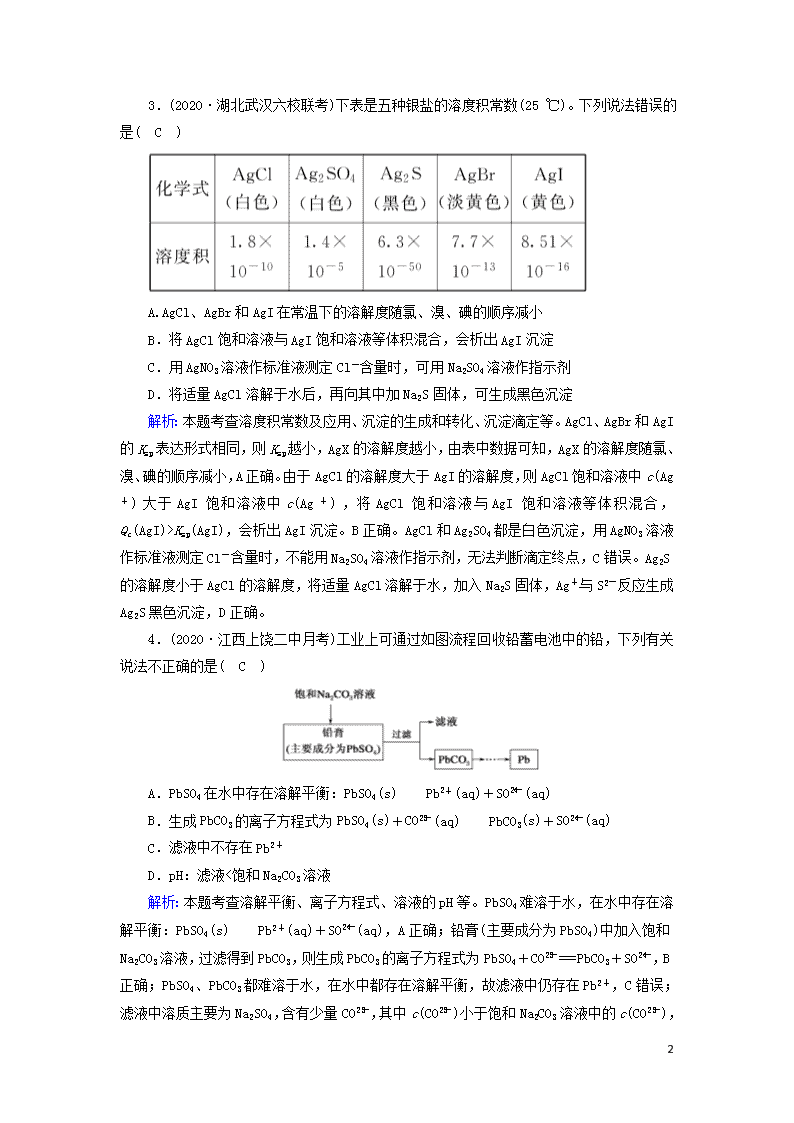
3.(2020·湖北武汉六校联考)下表是五种银盐的溶度积常数(25 ℃)。下列说法错误的是( C )
A.AgCl、AgBr和AgI在常温下的溶解度随氯、溴、碘的顺序减小
B.将AgCl饱和溶液与AgI饱和溶液等体积混合,会析出AgI沉淀
C.用AgNO3溶液作标准液测定Cl-含量时,可用Na2SO4溶液作指示剂
D.将适量AgCl溶解于水后,再向其中加Na2S固体,可生成黑色沉淀
解析:本题考查溶度积常数及应用、沉淀的生成和转化、沉淀滴定等。AgCl、AgBr和AgI的Ksp表达形式相同,则Ksp越小,AgX的溶解度越小,由表中数据可知,AgX的溶解度随氯、溴、碘的顺序减小,A正确。由于AgCl的溶解度大于AgI的溶解度,则AgCl饱和溶液中c(Ag+)大于AgI饱和溶液中c(Ag+),将AgCl饱和溶液与AgI饱和溶液等体积混合,Qc(AgI)>Ksp(AgI),会析出AgI沉淀。B正确。AgCl和Ag2SO4都是白色沉淀,用AgNO3溶液作标准液测定Cl-含量时,不能用Na2SO4溶液作指示剂,无法判断滴定终点,C错误。Ag2S的溶解度小于AgCl的溶解度,将适量AgCl溶解于水,加入Na2S固体,Ag+与S2-反应生成Ag2S黑色沉淀,D正确。
4.(2020·江西上饶二中月考)工业上可通过如图流程回收铅蓄电池中的铅,下列有关说法不正确的是( C )
A.PbSO4在水中存在溶解平衡:PbSO4(s)Pb2+(aq)+SO(aq)
B.生成PbCO3的离子方程式为PbSO4(s)+CO(aq)PbCO3(s)+SO(aq)
C.滤液中不存在Pb2+
D.pH:滤液<饱和Na2CO3溶液
解析:本题考查溶解平衡、离子方程式、溶液的pH等。PbSO4难溶于水,在水中存在溶解平衡:PbSO4(s)Pb2+(aq)+SO(aq),A正确;铅膏(主要成分为PbSO4)中加入饱和Na2CO3溶液,过滤得到PbCO3,则生成PbCO3的离子方程式为PbSO4+CO===PbCO3+SO,B正确;PbSO4、PbCO3都难溶于水,在水中都存在溶解平衡,故滤液中仍存在Pb2+,C错误;滤液中溶质主要为Na2SO4,含有少量CO,其中c(CO)小于饱和Na2CO3溶液中的c(CO),则滤液中CO
9
水解产生的c(OH-)小于饱和Na2CO3溶液中CO水解产生的c(OH-),Na2CO3溶液的碱性强,故pH:滤液<饱和Na2CO3溶液,D正确。
5.(2020·河南驻马店模拟)已知常温下,几种难溶电解质的溶度积(Ksp)如下表:
化学式
Mg(OH)2
MgF2
Fe(OH)3
Cu(OH)2
溶度积
5.6×
10-12
7.4×
10-11
4.0×
10-38
2.2×
10-20
下列说法不正确的是( B )
A.在Mg(OH)2的悬浊液中加入少量NH4Cl固体,c(Mg2+)增大
B.在Mg(OH)2的悬浊液中加入NaF溶液后,Mg(OH)2不可能转化为MgF2
C.CuCl2溶液中混入了一定量FeCl3溶液,可以通过向溶液中加入CuO的方法,调节溶液的pH,除去Fe3+杂质
D.向含一定浓度的Mg2+和Cu2+的溶液中加过量NaOH溶液,完全反应后过滤,滤液中=2.5×108
解析:本题考查沉淀溶解平衡的影响因素、沉淀的生成及转化等。在Mg(OH)2的悬浊液中存在溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),加入少量NH4Cl固体,NH与OH-反应生成NH3·H2O,促使溶解平衡正向移动,c(Mg2+)增大,A正确;在Mg(OH)2的悬浊液中加入NaF溶液后,若溶液中c(Mg2+)·c2(F-)>Ksp(MgF2),Mg(OH)2可以转化为MgF2,B错误;由数据可知,Fe3+完全转化为Fe(OH)3时的pH小于Cu2+,向溶液中加入CuO,调节溶液的pH,使Fe3+生成Fe(OH)3沉淀而除去Fe3+杂质,C正确;加入过量NaOH,则Cu2+和Mg2+都沉淀,过滤后的滤液为Cu(OH)2和Mg(OH)2饱和溶液,则满足:Ksp[Mg(OH)2]=c(Mg2+)·c2(OH-)、Ksp[Cu(OH)2]=c(Cu2+)·c2(OH-),故==≈2.5×108,D正确。
6.(2020·天津蓟州区模拟)已知:①t ℃时,AgCl的Ksp=2.0×10-10;②t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是( B )
A.在t ℃时,Ag2CrO4的Ksp为1.0×10-12
B.在饱和Ag2CrO4溶液中加入K2CrO4固体,可使溶液由Y点到X点
C.在t ℃时,用0.01 mol·L-1 AgNO3溶液滴定20.00 mL 0.01 mol·L-1 KCl和0.01
9
mol·L-1 K2CrO4的混合溶液,CrO后沉淀
D.在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数K=2.5×107
解析:本题考查沉淀溶解平衡曲线及分析、溶度积的计算、化学平衡常数的计算等。图中曲线代表Ag2CrO4的沉淀溶解平衡曲线,当c(CrO)=10-6 mol·L-1时,c(Ag+)=10-3 mol·L-1,则有Ksp(Ag2CrO4)=c2(Ag+)·c(CrO)=(10-3)2×10-6=1.0×10-12,A正确。在饱和Ag2CrO4溶液中存在溶解平衡:Ag2CrO4(s)2Ag+(aq)+CrO(aq),加入K2CrO4固体,溶液中c(CrO)增大,平衡逆向移动,c(Ag+)减小,故不能使溶液由Y点到X点,B错误。向浓度均为0.01 mol·L-1的KCl和K2CrO4的混合溶液中滴加AgNO3溶液,Cl-开始沉淀时c(Ag+)==2×10-8mol·L-1,CrO开始沉淀时,c(Ag+)==10-5mol·L-1,则先生成AgCl沉淀,后生成Ag2CrO4沉淀,C正确。在t ℃时,反应Ag2CrO4(s)+2Cl-(aq)2AgCl(s)+CrO(aq)的平衡常数K====2.5×107,D正确。
7.(2020·四川成都一模)已知:pCu=-lgc(Cu+),pX=-lgc(X-)。298 K时,Ksp(CuCl)=a×10-6,Ksp(CuBr)=b×10-9,Ksp(CuI)=c×10-12。在CuCl、CuBr、CuI的饱和溶液中阳离子和阴离子浓度关系如图所示。下列说法正确的是( D )
A.298 K时,在CuCl的饱和溶液中加入少量NaCl,c(Cu+)和c(Cl-)都减小
B.图中曲线x代表CuI,且P点对应的c(Cu+)=c(I-)
C.298 K时,增大M点的阴离子浓度,则y上的点向N点移动
D.298 K时,CuBr(s)+I-(aq)CuI(s)+Br-(aq)的平衡常数K的数量级为103或102
解析:本题考查沉淀溶解平衡曲线及分析、溶解平衡移动及影响因素、化学平衡常数K的计算等。根据图像,P点时,pCu=-lgc(Cu+)=3,c(Cu+)=10-3mol·L-1,pX=-lgc(X-)=3,c(X-)=10-3mol·L-1,则Ksp(CuX)=1×10-6,故P点对应CuCl饱和溶液中阳离子和阴离子浓度关系,即曲线x代表CuCl,则y代表CuBr,z代表CuI。298
9
K时,在CuCl的饱和溶液中加入少量NaCl,c(Cl-)增大,由于温度不变,Ksp(CuCl)不变,则c(Cu+)减小,A错误。根据上述分析,图中曲线x代表CuCl,B错误。298 K时,增大M点的阴离子浓度,温度不变,Ksp(CuBr)不变,则c(Cu+)减小,pCu=-lgc(Cu+)增大,即y上的点向M点的斜下方移动,C错误。298 K时CuBr(s)+I-(aq)CuI(s)+Br-(aq)的平衡常数K====×103,故K的数量级为103或102,D正确。
8.(2020·河南汝阳一中调研)在一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示,纵轴p(Mn+)表示-lgc(Mn+),横轴p(S2-)表示-lgc(S2-)。下列说法不正确的是( C )
A.该温度下,Ag2S的Ksp=1.6×10-49
B.该温度下,溶解度大小的顺序:NiS>SnS
C.NiS、SnS的饱和溶液中=10-6.5
D.向含有相同浓度Ag+、Ni2+、Sn2+的溶液中加入饱和Na2S溶液,析出沉淀的先后顺序:Ag2S、SnS、NiS
解析:本题考查沉淀溶解平衡曲线及分析、Ksp(Ag2S)的计算、溶液中离子沉淀先后顺序的比较。Ag2S的溶解平衡曲线上,a点坐标为a(30,10-lg4),则p(S2-)=30时,p(Ag+)=10-lg4,即c(S2-)=1×10-30mol·L-1时c(Ag+)=4×10-10mol·L-1,故该温度下Ag2S的Ksp=c2(Ag+)·c(S2-)=1×10-30×(4×10-10)2=1.6×10-49,A正确。由图可得,Ksp(NiS)=1×10-21,Ksp(SnS)=1×10-25,故溶解度:NiS>SnS,B正确。NiS、SnS的饱和溶液中===104,C错误。Ag+、Ni2+、Sn2+的浓度相同,可利用图像,画一条平行于横坐标的直线,可以看出Ni2+、Sn2+、Ag+沉淀时对应的p(S2-)依次增大,即c(S2-)依次减小,需要的S2-浓度越小,则越先沉淀,故析出沉淀顺序:Ag2S>SnS>NiS,D正确。
9.(2020·吉林四平四中模拟)已知:pBa=-lgc(Ba2+),pKa=-lgKa。已知常温下H2CO3:pKa1=6.4,pKa2=10.3。常温下,向20 mL 0.1 mol·L-1 BaCl2溶液中滴加0.2 mol·L-1 Na2CO3溶液的滴定曲线如图所示。下列说法正确的是( C )
9
A.E、F、G三点的Ksp从大到小的顺序为G>F>E
B.其他条件相同,用相同浓度、相同体积的MgCl2溶液替代BaCl2溶液,F点向G点迁移[已知Ksp(MgCO3)>Ksp(BaCO3)]
C.常温下,Ksp(BaCO3)为1.0×10-9
D.常温下,CO的pKh1=7.6
解析:题干信息标明为“常温下”,故温度不变,沉淀溶解平衡常数不变,A项错误;用相同浓度、相同体积的MgCl2溶液替代BaCl2溶液,恰好完全反应时,二者消耗的Na2CO3溶液体积相等,但由于碳酸钡的溶度积小于碳酸镁,所以滴定终点时pMgc(Ur-)
D.当pH=7时,2c(Na+)=c(Ur-)+c(Cl-)
解析:Ksp(NaUr)=c(Na+)·c(Ur-),因尿酸钠悬浊液中c(Na+)=c(Ur-),故c(Ur-)=7.0×10-3 mol·L-1,A项错误;在M→N的变化过程中,通入HCl,生成HUr,故NaUrNa++Ur-平衡右移,c(Na+)增大,由温度不变,Ksp(NaUr)不变可知,c(Ur-
9
)减小,故该过程中的值增大,B项错误;当c(HUr)=c(Ur-)时,根据Ka(HUr)=2.0×10-6,可求出此时溶液中c(H+)=2.0×10-6 mol·L-1,溶液呈酸性,根据物料守恒有c(Na+)=c(Ur-)+c(HUr),根据电荷守恒有c(H+)+c(Na+)=c(Ur-)+c(Cl-)+c(OH-),故c(HUr)+c(H+)=c(Cl-)+c(OH-),因c(HUr)=c(Ur-),故存在c(Ur-)+c(H+)=c(Cl-)+c(OH-),因混合液呈酸性,所以c(H+)>c(OH-), 故c(Ur-)2.5×10-4 mol·L-1时,开始有BaCO3沉淀生成。图中c(CO)=2.5×10-4mol·L-1时,c(Ba2+)=1.0×10-5mol·L-1,则有Ksp(BaCO3)=c(Ba2+)·c(CO)=2.5×10-4×1.0×10-5=2.5×10-9。
③BaSO4饱和溶液中存在溶解平衡:BaSO4(s)Ba2+(aq)+SO(aq),加入Na2CO3,Ba2+与CO生成BaCO3沉淀,促使BaSO4的溶解平衡正向移动,溶液中c(SO)增大,c(Ba2+)减小,则MP为c(SO)的变化曲线,MN为c(Ba2+)的变化曲线。反应BaSO4(s)+CO(aq)BaCO3(s)+SO(aq)的平衡常数K====0.04。
④当溶液中c(CO)=1×10-3 mol·L-1时,K==0.04,则有c(SO)=0.04×10-3mol·L-1=4×10-5mol·L-1,故溶解BaSO4的物质的量为4×10-5mol·L-1×1 L=4×10-5 mol。
9
相关文档
- 重庆市万州区(六校联考)2021届新高2021-07-0810页
- 广西南宁市第三中学2019-2020学年2021-07-0820页
- 黄冈第一轮化学_第五章物质结构元2021-07-0811页
- 2017 年度高一期中考试化学试题2021-07-088页
- 2020届高考化学二轮复习专题十三物2021-07-0817页
- 2020-2021学年新教材化学人教版必2021-07-085页
- 广东省深圳市高级中学2019-2020学2021-07-0821页
- 2021版高考化学一轮复习核心素养测2021-07-089页
- 2021版化学名师讲练大一轮复习鲁科2021-07-082页
- 2020-2021学年新教材化学人教版必2021-07-084页