- 144.63 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时3 氧化还原反应的应用
考点1 氧化还原反应在物质转化中的应用
1.(原创题)由过氧化氢分子中氧元素的化合价可知,H2O2具有( )。
A.氧化性 B.还原性
C.酸性 D.氧化性和还原性
答案:D
解析:H2O2中氧元素为-1价,既可以升高到0价,又可以降低到-2价,故在氧化还原反应中既有氧化性又有还原性。
2.(原创题)下列工业生产和生活中,涉及氧化还原反应的是( )。
①高炉炼铁 ②炼铜时用铁把铜从CuSO4溶液中置换出来
③工业上用碳还原SiO2制粗硅 ④电解氧化铝制铝 ⑤钢铁腐蚀 ⑥水果保鲜 ⑦水滴石穿 ⑧漂白粉消毒
A.①②③④ B.⑤⑥⑦⑧
C.①②③④⑤⑧ D.①②③④⑤⑥⑧
答案:D
解析:⑦中涉及的CaCO3+CO2+H2OCa(HCO3)2为非氧化还原反应。
3.(2018·河北武邑中学月考)化工厂常用浓氨水检验氯气管道是否漏泄,反应的化学方程式为3Cl2+8NH36NH4Cl+N2,当有10.65 g Cl2被消耗时,被氧化的氨的质量为( )。
A.3.4 g B.1.7 g C.6.8 g D.0.85 g
答案:B
解析:n(Cl2)=10.6571 mol=0.15 mol,
NH3的氧化产物为N2,每生成1 mol N2,被氧化的氨的物质的量为2 mol,设生成N2 x mol,
- 8 -
3Cl2+8NH36NH4Cl+N2
3 1
0.15 mol x mol
30.15=1x,解得x=0.05,
故被氧化的氨的质量为(0.05×2×17) g=1.7 g,故选B。
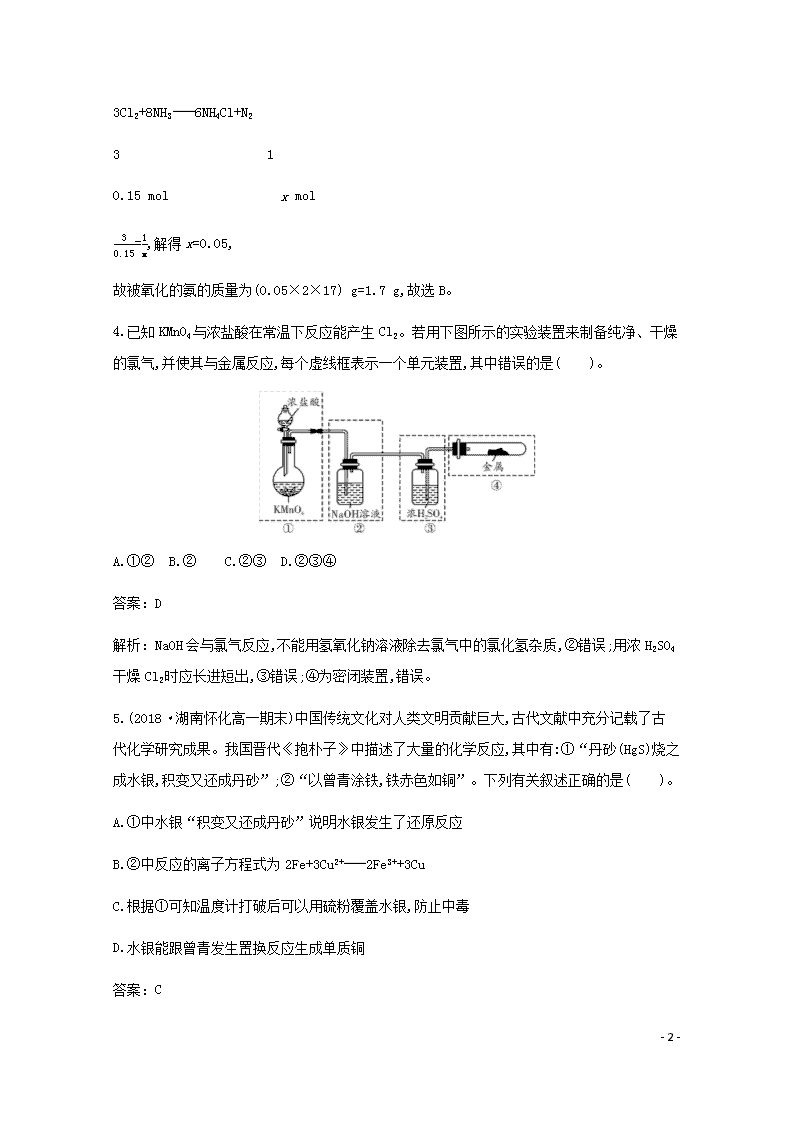
4.已知KMnO4与浓盐酸在常温下反应能产生Cl2。若用下图所示的实验装置来制备纯净、干燥的氯气,并使其与金属反应,每个虚线框表示一个单元装置,其中错误的是( )。
A.①② B.② C.②③ D.②③④
答案:D
解析:NaOH会与氯气反应,不能用氢氧化钠溶液除去氯气中的氯化氢杂质,②错误;用浓H2SO4干燥Cl2时应长进短出,③错误;④为密闭装置,错误。
5.(2018·湖南怀化高一期末)中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。我国晋代《抱朴子》中描述了大量的化学反应,其中有:①“丹砂(HgS)烧之成水银,积变又还成丹砂”;②“以曾青涂铁,铁赤色如铜”。下列有关叙述正确的是( )。
A.①中水银“积变又还成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为2Fe+3Cu2+2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
答案:C
- 8 -
解析:水银是汞,属于金属,Hg→HgS应是水银发生了氧化反应,故A项错误;铁和Cu2+发生置换反应生成Fe2+,正确的离子方程式应是Fe+Cu2+Fe2++Cu,故B项错误;S和Hg反应生成HgS,因此用硫粉覆盖温度计打破后流出的水银,可以防止中毒,故C项正确;根据金属活动性顺序,Cu排在Hg的前面,因此Hg不能置换出Cu,故D项错误。
考点2氧化还原反应在能量转化中的应用
6.(2018·黑龙江哈尔滨期中)下列四个化学反应中,理论上不能获得电能的是( )。
A.2Al+2NaOH+2H2O2NaAlO2+3H2↑
B.2H2+O22H2O
C.Zn+CuSO4Cu+ZnSO4
D.Na2CO3+2HCl2NaCl+H2O+CO2↑
答案:D
解析:D项中的反应不是氧化还原反应,不能设计成原电池。
7.(2019·江苏南京月考)有专家指出,如果利用太阳能使燃烧产物CO2、H2O、N2等重新组合成燃料,使之能够实现循环利用,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机。在此构想的物质循环图中太阳能最后转化为( )。
A.化学能 B.热能
C.生物质能 D.电能
答案:B
解析:从题给信息可知,利用太阳能可以使燃烧产物CO2、H2O、N2等重新组合成燃料,而燃料转化为燃烧产物并放出热量,如此循环,由此可知太阳能最终转化为热能,B项正确。
8.(2019·江西抚州月考)下列选项中属于乙醇作为燃料的优点的是( )。
- 8 -
①燃烧时发生氧化反应 ②充分燃烧的产物不污染环境 ③乙醇是一种可再生能源 ④燃烧时放出大量热量
A.①②③ B.①②④
C.①③④ D.②③④
答案:D
解析:理想燃料应该从能源是否可以再生、单位质量的燃料燃烧放出热量的多少、是否环保等方面进行综合考虑。有机物燃烧时都发生氧化反应,并不是乙醇作为燃料的优点。
考点3利用氧化还原反应制备物质
9.将足量的二氧化锰与40 mL 10 mol·L-1浓盐酸反应产生的氯气同0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气相比[MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O]( )。
A.前者产生的Cl2多 B.一样多
C.后者产生的Cl2多 D.无法比较
答案:C
解析:随着反应的进行,浓盐酸的浓度逐渐减小,而二氧化锰不能氧化稀盐酸,所以足量的二氧化锰与40 mL 10 mol·L-1浓盐酸反应产生的氯气少于0.1 mol;0.1 mol二氧化锰与足量的浓盐酸反应产生的氯气为0.1 mol,故C正确。
10.下列方程式中正确的是( )。
A.向水中通入氯气:H2O+Cl22H++ClO-+Cl-
B.氯气通入冷的氢氧化钠溶液中:Cl2+OH-Cl-+ClO-+H2O
C.制备漂白粉:2Ca(OH)2+2Cl2Ca(ClO)2+CaCl2+2H2O
D.漂白液失效:2HClO2Cl-+2H2O
答案:C
- 8 -
解析:A项中HClO不能拆分,错误:B项电荷不守恒,错误;D项漂白液失效发生的反应是2HClO2Cl-+2H++O2↑,错误;C项正确。
11.判断正误,正确的打“”,错误的打“✕”。
(1)氯气在饱和食盐水中的溶解度小于在纯水中的溶解度。 ( )
答案:√
(2)足量的MnO2与40 mL 10 mol·L-1浓盐酸在加热条件下反应转移0.2 mol电子。 ( )
答案:×
(3)用NaOH溶液吸收多余的Cl2时,导管不能伸到液面以下的原因是防止倒吸。 ( )
答案:√
(4)实验室制Cl2的离子方程式为MnO2+4HClMn2++2Cl-+Cl2↑+2H2O。 ( )
答案:×
(5)制取氯气时要缓缓加热,温度过高会导致HCl大量挥发。 ( )
答案:√
(6)一套完整的制气装置包括:发生装置→净化装置→收集装置→尾气处理装置。 ( )
答案:√
12.(2019·辽宁大连期中)完成下列题目已知:
(1)实验室制取Cl2的化学方程式为MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O,其中MnO2发生了 反应,是 剂;每4分子氯化氢中只有 分子发生了 反应,盐酸是 剂。
答案:还原 氧化 2 氧化 还原
解析:4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑中,Mn元素的化合价由+4价降低为+2价,则MnO2发生了还原反应,是氧化剂,Cl元素的化合价由-1价升高为0价,则HCl为还原剂,每4分子氯化氢中只有2分子发生了氧化还原反应,盐酸是还原剂。
- 8 -
(2)室温下KMnO4与浓盐酸反应制取氯气的化学方程式如下:
2KMnO4+16HCl(浓)2KCl+2MnCl2+8H2O+5Cl2↑
请在上式中用单线桥法表示出不同元素的原子间得失电子的情况。
答案:
解析:反应中KMnO4为氧化剂,Mn元素的化合价由+7价降低到+2价,得到5个电子,Cl元素化合价升高,被氧化,当有2 mol KMnO4参加反应,转移电子10 mol。
(3)用CuCl2作催化剂,在450 ℃时用空气中的O2跟HCl反应也能制得氯气,其化学方程式为4HCl+O22H2O+2Cl2。从氯元素化合价的变化看,以上三种制氯气方法的共同点是 ;
比较以上三个反应,可以认为氧化剂的氧化能力从强到弱的顺序为 。
答案:将氯元素从-1价氧化到0价得到Cl2 KMnO4>MnO2>O2
解析:比较氧化剂氧化能力的强弱时,若氧化产物价态相同,可根据反应的难易程度进行判断:第一个反应需加热;第二个反应在室温即可发生;第三个反应需高温催化剂。故氧化性顺序:KMnO4>MnO2>O2。
13.(2019·名师原创)已知H2O2的性质与用途具有多样性。请回答下列问题。
(1)已知H2O2具有弱酸性,写出H2O2的电离方程式: 。
答案:H2O2H++HO2- HO2-H++O22-
解析:H2O2为弱电解质,电离方程式要用“”;
(2)实验室可用H2O2在MnO2作催化剂的条件下制备O2,写出该反应的化学方程式: ,当生成1 mol O2时,转移电子为 mol。
答案:2H2O22H2O+O2↑ 2
解析:H2O2既是氧化剂又是还原剂,1 mol H2O2发生反应转移1 mol电子,故生成1 mol O2时,转移2 mol电子;(3)KMnO4是常用氧化剂,H2O2与之反应,H2O2为还原剂。
- 8 -
(3)在酸性条件下,KMnO4溶液可以与H2O2反应,已知变化过程中存在KMnO4转化Mn2+的过程,则该反应的离子方程式为 ,H2O2发生 反应,该反应 是还原剂, 是氧化剂。
答案:2MnO4-+5H2O2+6H+2Mn2++5O2↑+8H2O 氧化 H2O2 KMnO4
14.(2019·嘉兴七校联考)实验室常用二氧化锰和浓盐酸共热的方法制取氯气,反应中二氧化锰被还原为MnCl2。
A
B
C
根据要求回答下列问题:
(1)A、B、C三套装置中,应选用的装置是 (填“A”“B”“C”)。
答案:B
解析:A无加热装置,C装置用的是长颈漏斗,生成的Cl2会逸出,故选B;
(2)写出实验室用上述方法制取氯气的化学方程式: 。
- 8 -
答案:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(3)为了防止氯气污染环境,图中所示的溶液甲为 ,在该溶液中发生反应的化学方程式为 。
答案:氢氧化钠溶液 2NaOH+Cl2NaCl+NaClO+H2O
解析:Cl2可以与NaOH溶液反应,用NaOH吸收尾气较好;
(4)利用该原理和装置进行实验,制得的氯气中往往含有的杂质有 ,可依次通入 中除去。
答案:HCl和H2O 饱和食盐水、浓硫酸
解析:Cl2中含有HCl和水蒸气,用饱和食盐水和浓硫酸依次除去。
- 8 -
相关文档
- 辽宁省沈阳市城郊市重点联合体20192021-07-087页
- 【化学】河南省洛阳市2019-2020学2021-07-0816页
- 2019届高考化学二轮复习浙江选考化2021-07-0816页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 江西省宜春九中2019-2020学年高一2021-07-0815页
- 2019高考化学高分突破二轮复习专题2021-07-0815页
- 高考化学四海八荒易错集专题08化学2021-07-0832页
- 高中化学第五章化工生产中的重要非2021-07-085页
- 【化学】浙江省台州市书生中学20192021-07-087页
- 2021高考化学全国通用一轮习题:第三2021-07-085页