- 1.24 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
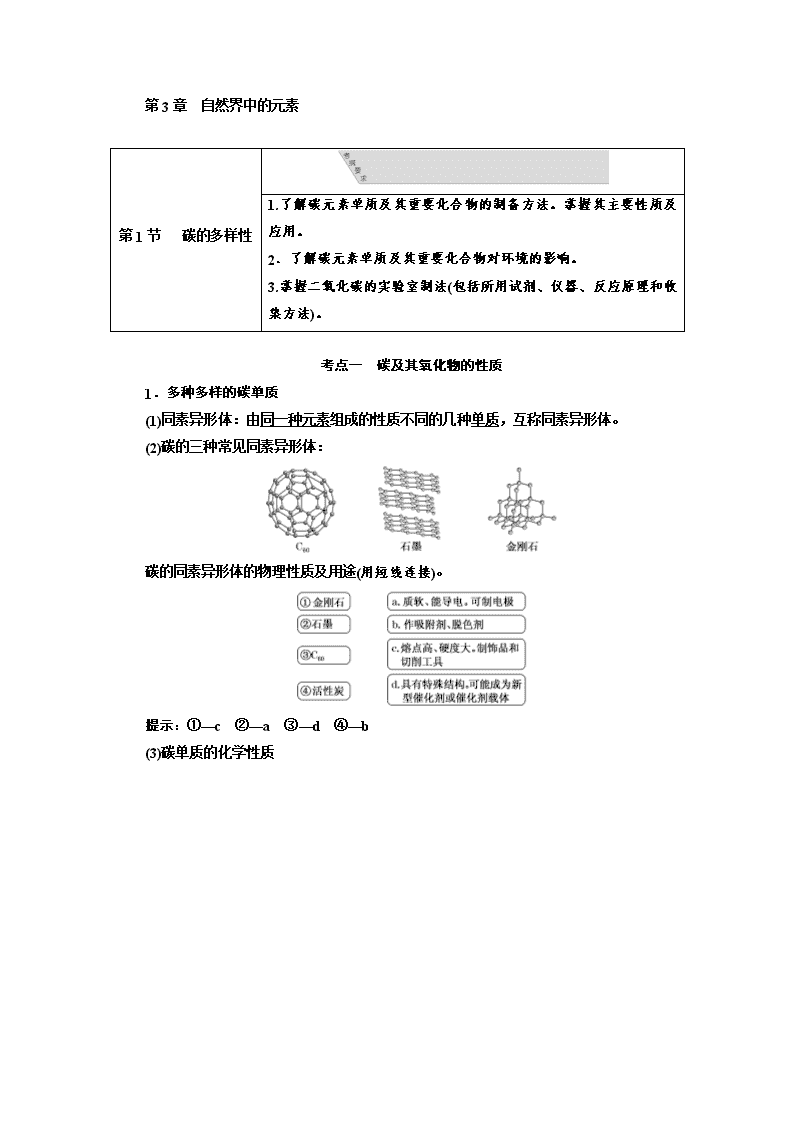
第3章 自然界中的元素
第1节 碳的多样性
1.了解碳元素单质及其重要化合物的制备方法。掌握其主要性质及应用。
2.了解碳元素单质及其重要化合物对环境的影响。
3.掌握二氧化碳的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
考点一 碳及其氧化物的性质
1.多种多样的碳单质
(1)同素异形体:由同一种元素组成的性质不同的几种单质,互称同素异形体。
(2)碳的三种常见同素异形体:
碳的同素异形体的物理性质及用途(用短线连接)。
提示:①—c ②—a ③—d ④—b
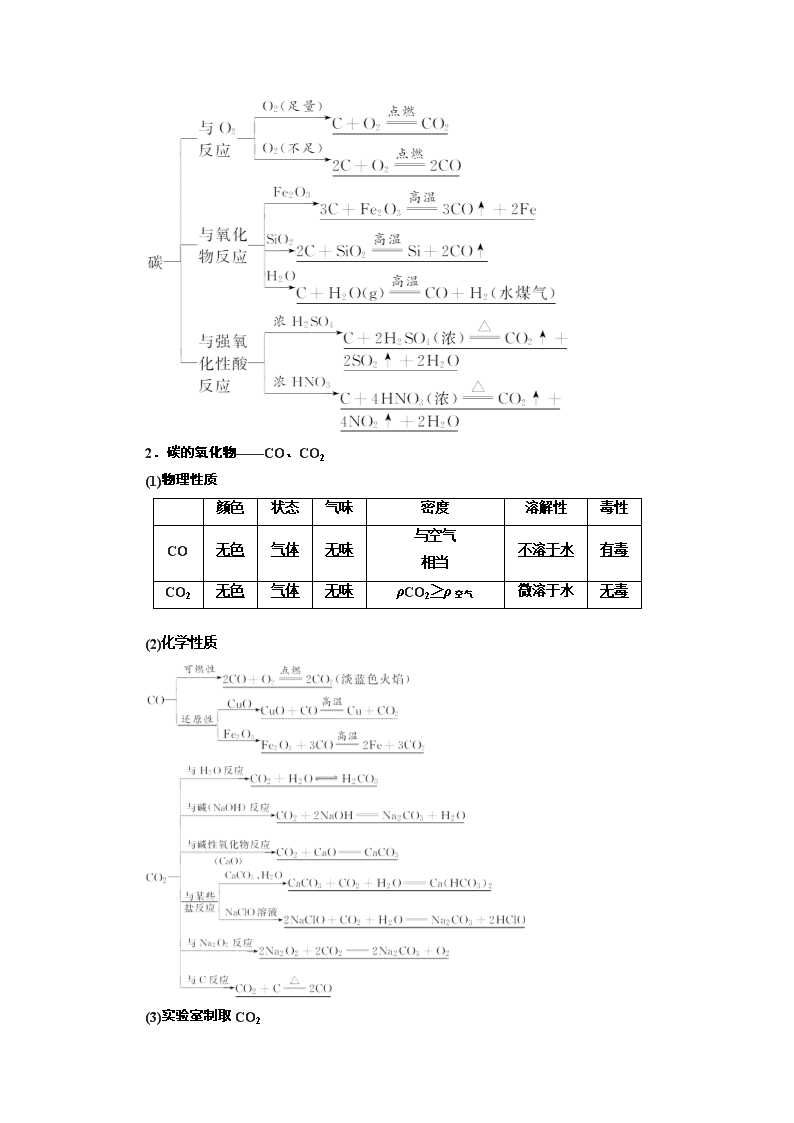
(3)碳单质的化学性质
2.碳的氧化物——CO、CO2
(1)物理性质
颜色
状态
气味
密度
溶解性
毒性
CO
无色
气体
无味
与空气
相当
不溶于水
有毒
CO2
无色
气体
无味
ρCO2>ρ空气
微溶于水
无毒
(2)化学性质
(3)实验室制取CO2
①原理:CaCO3+2HCl===CaCl2+CO2↑+H2O。
②发生装置:启普发生器。
(4)用途
CO:燃料、冶炼金属的还原剂。
CO2:化工原料、灭火剂,干冰用作制冷剂、人工降雨。
[题点全练]
题点(一) 碳及其氧化物的性质及应用
1.判断正误(正确的打“√”,错误的打“×”)。
(1)碳的各种单质互称为碳的同素异形体(√)
(2)碳元素的各种单质结构虽然不同,但性质差别不大(×)
(3)碳元素的单质性质不同,其用途相同(×)
(4)碳元素的单质只有金刚石、石墨和C60(×)
(5)将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2(×)
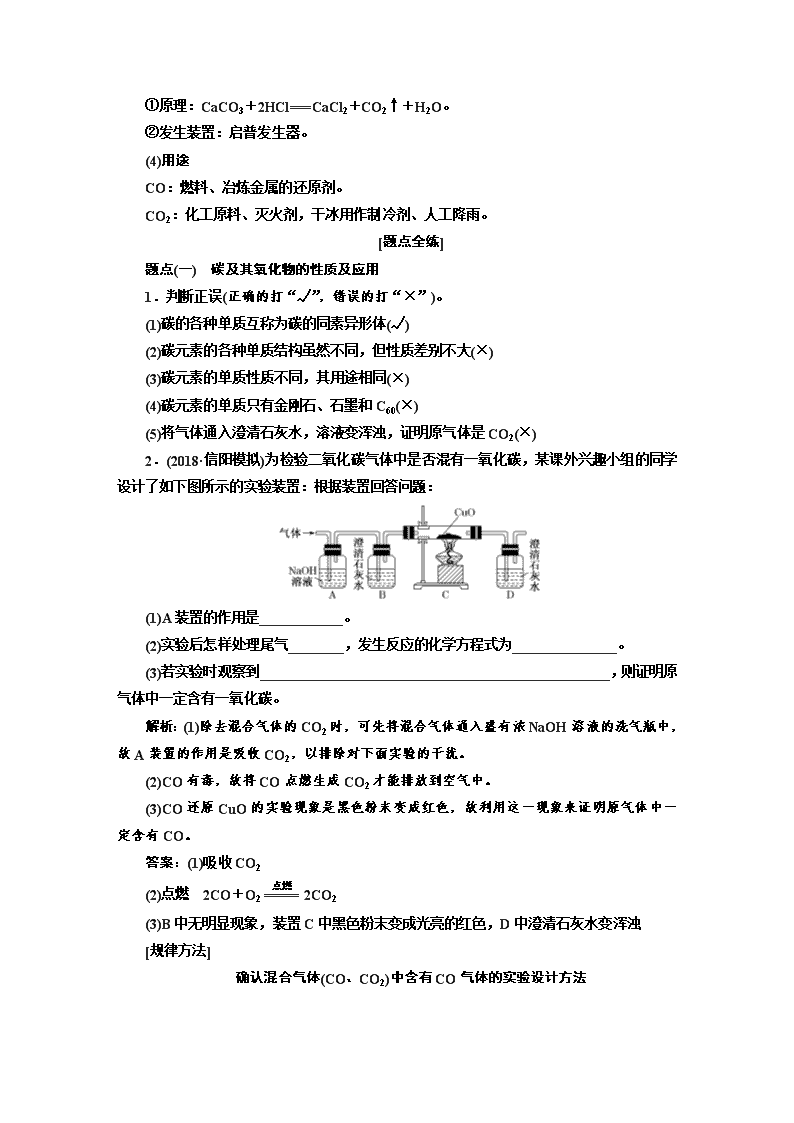
2.(2018·信阳模拟)为检验二氧化碳气体中是否混有一氧化碳,某课外兴趣小组的同学设计了如下图所示的实验装置:根据装置回答问题:
(1)A装置的作用是____________。
(2)实验后怎样处理尾气________,发生反应的化学方程式为_______________。
(3)若实验时观察到__________________________________________________,则证明原气体中一定含有一氧化碳。
解析:(1)除去混合气体的CO2时,可先将混合气体通入盛有浓NaOH溶液的洗气瓶中,故A装置的作用是吸收CO2,以排除对下面实验的干扰。
(2)CO有毒,故将CO点燃生成CO2才能排放到空气中。
(3)CO还原CuO的实验现象是黑色粉末变成红色,故利用这一现象来证明原气体中一定含有CO。
答案:(1)吸收CO2
(2)点燃 2CO+O22CO2
(3)B中无明显现象,装置C中黑色粉末变成光亮的红色,D中澄清石灰水变浑浊
[规律方法]
确认混合气体(CO、CO2)中含有CO气体的实验设计方法
各装置的作用是:
A——除去混合气体中的CO2气体
B——检验混合气体中CO2是否除尽
C——CO还原CuO:CO+CuOCu+CO2
D——验证CO的氧化产物CO2
E——除去尾气中的CO2气体
F——除去尾气中的CO气体、防止污染环境
确定混合气体中含有CO气体的实验现象是:
C中的物质由黑色变成红色,B中无明显现象,D中的澄清石灰水变浑浊。
题点(二) CO2与碱反应产物的判断及现象分析
3.标准状况下,将3.36 L CO2气体通入200 mL 1.00 mol·L-1 NaOH溶液中,充分反应后溶液中c(CO)与c(HCO)的比值为(不考虑CO、HCO的水解)( )
A.1∶1 B.1∶2
C.2∶1 D.1∶3
解析:选B 设CO、HCO的物质的量分别为x、y,则有解得x=0.05 mol,y=0.1 mol。
4.将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(V)的关系正确的是( )
解析:选D 依次发生的反应为Ca(OH)2+CO2===CaCO3↓+H2O,2KOH+CO2===K2CO3+H2O,K2CO3+CO2+H2O===2KHCO3,CaCO3+CO2+H2O===Ca(HCO3)2。
[规律方法] CO2与碱反应产物的定量判断
以CO2与NaOH溶液反应为例:
CO2+2NaOH===Na2CO3+H2O
CO2+NaOH===NaHCO3
当n(OH-)∶n(CO2)的值不同时产物如下:
题点(三) 碳元素单质及其化合物间的转化关系
5.甲气体可发生如下变化:
甲气体乙气体丙气体乙气体丁固体。则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
解析:选C 以丙气体为突破口,丙通过灼热的CuO后,生成的乙气体可与澄清石灰水反应生成固体,说明乙是CO2,则反推丙是CO,则甲是O2,丁是CaCO3。
6.甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有转化关系: 甲乙丙。下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH 溶液,则丁可能是CO2
解析:选C A项正确,所发生的反应为2C+O2(不足)2CO,2CO+O22CO2,C+CO22CO。B项正确,所发生的反应为SO2(过量)+NH3·H2O===NH4HSO3,NH4HSO3+NH3·H2O===(NH4)2SO3+H2O,(NH4)2SO3+H2O+SO2===2NH4HSO3。C项中,若甲为Fe,丁为盐酸,则乙为FeCl2,FeCl2与盐酸不反应,故C错误。D项正确,所发生的反应为2NaOH+CO2===Na2CO3+H2O,Na2CO3+H2O+CO2===2NaHCO3,NaOH+NaHCO3===Na2CO3+H2O。
考点二 碳酸钠与碳酸氢钠
(一)碳酸钠与碳酸氢钠的性质及用途
1.物理性质
名称
碳酸钠
碳酸氢钠
化学式
Na2CO3
NaHCO3
俗名
纯碱或苏打
小苏打
颜色、状态
白色粉末
细小白色晶体
水溶性
易溶于水
水中易溶,但比Na2CO3
的溶解度小
2.化学性质
(1)Na2CO3
与足量盐酸反应
Na2CO3+2HCl===2NaCl+CO2↑+H2O
与Ca(OH)2溶液反应
Na2CO3+Ca(OH)2===CaCO3↓+2NaOH
与BaCl2溶液反应
Na2CO3+BaCl2===BaCO3↓+2NaCl
(2)NaHCO3
与盐酸反应
NaHCO3+HCl===NaCl+CO2↑+H2O
与Ca(OH)2溶液反应
过量
HCO+Ca2++OH-===CaCO3↓+H2O
少量
2HCO+Ca2++2OH-===CaCO3↓+CO+2H2O
与BaCl2溶液反应
现象
受热分解
2NaHCO3Na2CO3+CO2↑+H2O
(3)相互转化
Na2CO3NaHCO3
3.主要用途
(1)碳酸钠:用于造纸、制造玻璃、制皂、洗涤等;
(2)碳酸氢钠:用于发酵、医药、灭火剂等。
(二)Na2CO3、NaHCO3、NaOH及其混合物与盐酸反应的图像分析
1.向Na2CO3溶液中逐滴加入盐酸
图像
图像特点
离子方程式
消耗盐酸的体积:Oa段ab段
Oa段:;
ab段:HCO+H+===CO2↑+H2O
2.向NaHCO3溶液中逐滴加入盐酸
图像
图像特点
离子方程式
从O点开始即产生CO2气体
HCO+H+===CO2↑+H2O
3.向Na2CO3、NaHCO3混合溶液中逐滴加入盐酸
图像
图像特点
离子方程式
[n(Na2CO3)∶n(NaHCO3)=1∶1]
消耗盐酸体积:Oa段ab段
Oa段:CO+H+===HCO;
ab段:HCO+H+===CO2↑+H2O
4.向NaOH、Na2CO3混合物中逐滴加入盐酸
图像
图像特点
离子方程式
[n(NaOH)∶n(Na2CO3)=1∶1]
消耗盐酸体积:Oa段ab段
Oa段:H++OH-===H2O、CO+H+===HCO;
ab段:HCO+H+===CO2↑+H2O
(三)Na2CO3、NaHCO3的鉴别与除杂
1.Na2CO3、NaHCO3的鉴别方法
2.Na2CO3、NaHCO3的除杂方法
依据二者性质的差异确定除杂方法(后者为杂质)
序号
混合物
除杂方法
①
Na2CO3(s)、NaHCO3
加热法
②
NaHCO3(aq)、Na2CO3
足量CO2
③
Na2CO3(aq)、NaHCO3
适量NaOH溶液
(四)联合制碱法——侯氏制碱法
1.原料
食盐、氨气、二氧化碳——合成氨厂用水煤气制取氢气时的废气;其反应为C+H2O(g)高温,CO+H2,CO+H2O(g)CO2+H2。
2.工艺流程
3.反应原理
(1)产生NaHCO3的反应:
NH3+NaCl+CO2+H2O===NaHCO3↓+NH4Cl。
(2)产生Na2CO3的反应:
2NaHCO3Na2CO3+CO2↑+H2O。
4.循环使用的物质:CO2、饱和食盐水。
[题点全练]
题点(一) Na2CO3、NaHCO3的除杂与鉴别
1.为除去括号内的杂质,所选用的试剂或方法不正确的是( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入过量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
解析:选D Ba(OH)2与Na2CO3和Na2SO4均发生化学反应生成白色沉淀,不符合除杂要求。
2.某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图所示。
(1)只根据图Ⅰ所示实验,不能够达到实验目的的原因是
________________________________________________________________________。
(2)图Ⅱ、Ⅲ
所示实验均能鉴别这两种物质,其反应的化学方程式为________________________________________________________________________。
(3)若用实验Ⅱ验证碳酸钠和碳酸氢钠的热稳定性,则试管B中装入的固体最好是________________________________________________________________________(填化学式)。
解析:(1)NaHCO3、Na2CO3都与盐酸反应放出CO2,不能达到目的。
(2)Ⅱ、Ⅲ都是利用NaHCO3受热易分解的性质进行鉴别。
(3)试管B中装入碳酸氢钠,试管A中装入碳酸钠,这样直接加热的碳酸钠温度高,不分解,不能使澄清石灰水变浑浊,而间接加热的碳酸氢钠分解,使澄清石灰水变浑浊,表明了碳酸氢钠受热易分解。
答案:(1)无论是Na2CO3还是NaHCO3均可以与盐酸反应产生CO2,两者的反应现象相同,故达不到鉴别目的
(2)2NaHCO3△,Na2CO3+H2O+CO2↑,
CO2+Ca(OH)2===CaCO3↓+H2O (3)NaHCO3
题点(二) Na2CO3、NaHCO3、NaOH及其混合液与盐酸反应的图像
3.将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
解析:选C 向NaOH与Na2CO3的混合溶液中滴加盐酸,盐酸首先与NaOH反应,然后与Na2CO3反应转化为NaHCO3:CO+H+===HCO,之后与HCO反应生成CO2,因n(OH-)=n(CO)=0.01 mol,故加入0.02 mol HCl后开始有气体生成。结合各种物质的量分析图像可知,选项C符合题意。
4.(2018·长沙模拟)向体积均为10 mL且物质的量浓度相同的两份NaOH溶液中分别通入一定量的CO2得到溶液甲和乙。向甲、乙两溶液中分别滴加0.1 mol·L-1盐酸。此时反应生成CO2体积(标准状况)与所加盐酸体积间的关系如图所示。则下列叙述中正确的是( )
A.原NaOH溶液的物质的量浓度为0.5 mol·L-1
B.当0V(ab)(即Oa段消耗盐酸的体积大于ab段消耗盐酸的体积)
溶液中的溶质为Na2CO3和NaOH
(4)若V(Oa)
相关文档
- 2020届高考化学一轮复习化学反应速2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0816页
- 2020届高考化学一轮复习化学平衡图2021-07-0825页
- 2020届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学平衡图2021-07-0811页
- 2020届高考化学一轮复习化学常用计2021-07-089页
- 2020届高考化学一轮复习化学能与热2021-07-087页
- 2021届高考化学一轮复习化学平衡及2021-07-0815页
- 2020届高考化学一轮复习化学平衡常2021-07-0811页