- 1.55 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
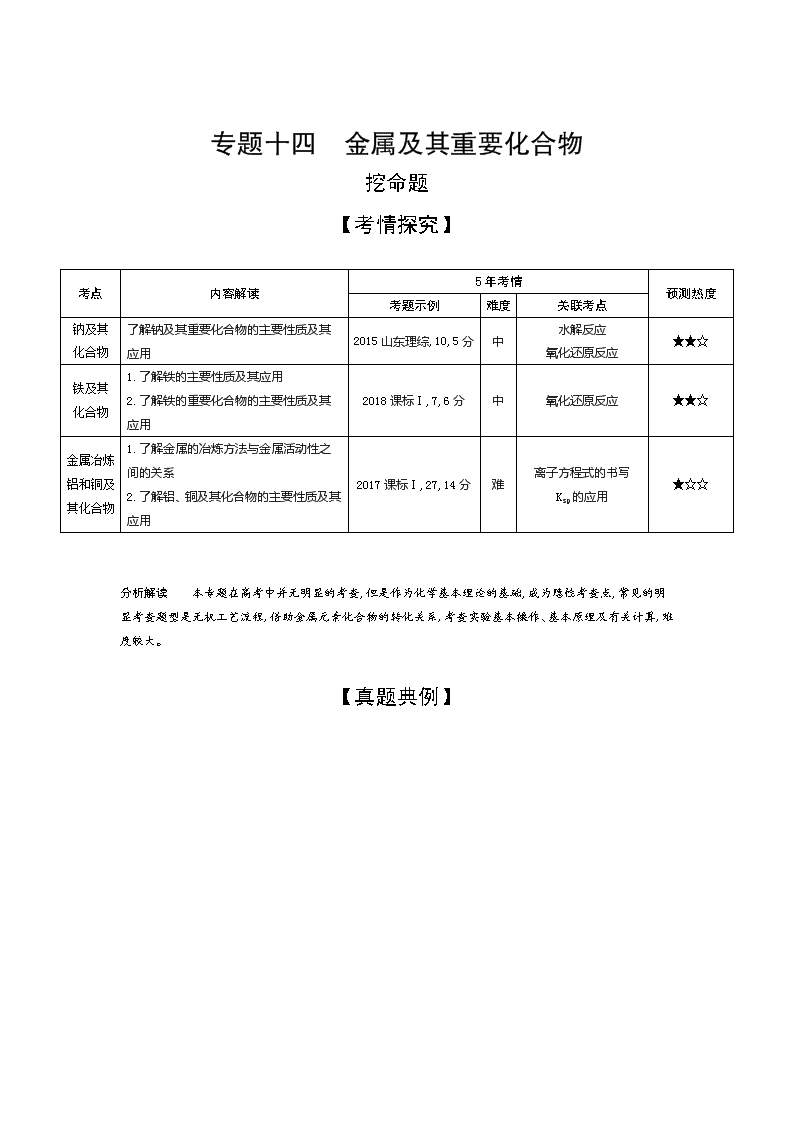
专题十四 金属及其重要化合物
挖命题
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
钠及其
化合物
了解钠及其重要化合物的主要性质及其应用
2015山东理综,10,5分
中
水解反应
氧化还原反应
★★☆
铁及其
化合物
1.了解铁的主要性质及其应用
2.了解铁的重要化合物的主要性质及其应用
2018课标Ⅰ,7,6分
中
氧化还原反应
★★☆
金属冶炼
铝和铜及
其化合物
1.了解金属的冶炼方法与金属活动性之间的关系
2.了解铝、铜及其化合物的主要性质及其应用
2017课标Ⅰ,27,14分
难
离子方程式的书写
Ksp的应用
★☆☆
分析解读 本专题在高考中并无明显的考查,但是作为化学基本理论的基础,成为隐性考查点,常见的明显考查题型是无机工艺流程,借助金属元素化合物的转化关系,考查实验基本操作、基本原理及有关计算,难度较大。
【真题典例】
破考点
【考点集训】
考点一 钠及其化合物
1.(2019届山东临沂教学质量检测,4)下列有关物质的性质与用途均正确,且具有对应关系的是( )
A.氧化铁能与酸反应,可用于制作红色涂料
B.生石灰能与水反应,可用于干燥氯气
C.SiO2具有导电性,可用于制作光导纤维和光电池
D.Na2O2与CO2反应放出氧气,可用作呼吸面具的供氧剂
答案 D
2.(2018山东潍坊二模,10)实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示(已知:PdCl2溶液遇CO能产生黑色的Pd),下列说法错误的是( )
A.装置①的仪器还可以制取H2、NH3等气体
B.装置⑤中石灰水变浑浊后,再点燃酒精灯
C.装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀,发生的反应是PdCl2+CO+H2O Pd↓+CO2+2HCl
答案 C
3.(2017山东泰安期中,23)某化学兴趣小组设计实验,测定Na2CO3与NaHCO3混合物中Na2CO3的质量分数。
甲方案:实验步骤为①称量空坩埚的质量为A g ②称量装有试样的坩埚质量为B g ③加热 ④冷却 ⑤称量坩埚和残余物的质量为C g ⑥重复③至⑤操作,直至恒重,质量为D g。
(1)坩埚中发生反应的化学方程式为 。
(2)计算Na2CO3质量分数必须用到的测定数据为 (填“A”“B”“C”或“D”)。
乙方案:准确称取0.300 0 g样品,放入锥形瓶中,加入适量水溶解,滴入2滴酚酞试液,用0.100 0 mol·L-1的标准盐酸滴定至溶液由粉红色刚好变为无色,达到滴定终点时产物为NaHCO3。重复上述操作两次,平均消耗盐酸的体积为20.00 mL。
(3)配制上述盐酸标准溶液100 mL,若用2.0 mol·L-1盐酸进行配制,需用滴定管量取该盐酸 mL;定容时俯视刻度线,将导致配制的溶液浓度 (填“偏高”“偏低”或“没有影响”)。
(4)样品中Na2CO3的质量分数为 (用百分数表示,精确到0.1%)。
丙方案:称取m g样品,选用如图所示部分装置测定样品与硫酸反应生成的气体体积。
(5)某同学按以下方法检查装置A的气密性:在分液漏斗中加入适量水,按图示连接好装置,关闭止水夹a,夹住橡胶管c,打开活塞b。若装置不漏气,则观察到的现象
为 。实验时,装置A中c的作用为 、 。
(6)为了提高测定的准确性,应选用装置A和 (填写字母标号)进行实验。
答案 (1)2NaHCO3 Na2CO3+H2O+CO2↑ (2)A、B、D (3)5.00 偏高 (4)70.7% (5)水流下一段时间后不再流出,且持续一段时间 便于分液漏斗中的液体流下 减小液体流下引起的气体体积误差 (6)C
考点二 铁及其化合物
1.(2018山东济宁统考,15)将0.2 mol·L-1的KI溶液和0.05 mol·L-1 Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I- 2Fe2++I2的是( )
A.向混合液中滴入KSCN溶液,溶液变血红色
B.向混合液中滴入AgNO3溶液,有黄色沉淀生成
C.向混合液中滴入K3[Fe(CN)6]溶液,有蓝色沉淀生成
D.向混合液中滴入淀粉溶液,溶液变蓝色
答案 A
2.(2018山东淄博部分学校二模,26)乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O,相对分子质量:288}可由乳酸与FeCO3反应制得,它易溶于水,是一种很好的补铁剂。
Ⅰ.制备碳酸亚铁:装置如图所示。
(1)仪器B的名称是 。
(2)实验操作如下:关闭活塞2,打开活塞1、3,加入适量稀硫酸反应一段时间,其目的是 ,然后关闭活塞1,接下来的操作是 。C中发生反应的离子方程式为 。
Ⅱ.制备乳酸亚铁:
向纯净的FeCO3固体加入足量乳酸溶液,在75 ℃下搅拌使之充分反应。
(3)该反应的化学方程式为 。为防止乳酸亚铁变质,在上述体系中还应加入 。反应结束后,将所得溶液隔绝空气低温蒸发、冷却结晶、过滤、洗涤、干燥得乳酸亚铁晶体。该晶体存放时应注意 。
Ⅲ.乳酸亚铁晶体纯度的测定:
(4)两位同学分别用不同方案进行测定:
①甲同学通过KMnO4滴定法测定样品中Fe2+的含量计算样品纯度,所得纯度总是大于100%,其原因可能是 。
②乙同学经查阅文献后改用(NH4)4Ce(SO4)4滴定法测定样品中Fe2+的含量计算样品纯度(反应中Ce4+还原为Ce3+),称取6.00 g样品配制成250.00 mL溶液,取25.00 mL用0.10 mol·L-1(NH4)4Ce(SO4)4标准溶液滴定至终点,消耗标准液20.00 mL。则产品中乳酸亚铁晶体的纯度为 (以质量分数表示)。
答案 (1)蒸馏烧瓶
(2)排尽装置内的空气,防止二价铁被氧化 关闭活塞3,打开活塞2 Fe2++2HCO3- FeCO3↓+CO2↑+H2O
(3)2CH3CH(OH)COOH+FeCO3 [CH3CH(OH)COO]2Fe+CO2↑+H2O 适量铁粉 密封保存
(4)①乳酸根中的羟基(—OH)能被酸性高锰酸钾溶液氧化,导致消耗高锰酸钾的量偏多 ②96%
考点三 金属冶炼 铝和铜及其化合物
1.(2018山东泰安二模,7)央视栏目《国家宝藏》不仅彰显民族自信、文化自信,还蕴含着许多化学知识。下列说法不正确的是 ( )
A.战国“曾侯乙编钟”属于青铜制品,青铜是一种铜锡合金
B.宋《莲塘乳鸭图》缂丝中使用的丝,主要成分是蛋白质
C.北宋王希孟《千里江山图》中的绿色颜料铜绿,主要成分是碱式碳酸铜
D.清乾隆时期的“瓷母”是指各种釉彩大瓶,其主要 成分是二氧化硅
答案 D
2.(2017山东青岛二模,28)下面是工业上以含金、银、铂、铜的金属废料提取金、银、铂的工艺流程。
已知:溶液Ⅰ中铂和金形成化合物为H[AuCl4]和H2[PtCl6]。浓盐酸的物质的量浓度为12 mol/L,密度为1.179 g/cm3;浓硝酸的质量分数约为65%,密度约为1.4 g/cm3。
(1)写出NH4Cl的电子式: 。
(2)操作Ⅰ中金属废料应该连接电源的 极,若另一极采用纯铜,该过程的工业名称为 。
(3)依据信息和所学知识,王水配制的具体操作为 。
(4)通入SO2的作用是 ,SO2不能通入过量的原因是 。
(5)阳极泥与王水反应,硝酸被还原为NO,请写出其中一个反应的化学方程式: 。
(6)由银制备银—氯化银参比电极的工作原理如图所示。一段时间后与A连接的电极就会被氯化银覆盖,当乙池中产生0.2 g气体时,甲池溶液质量变化为 。
答案 (1)H··N··HH····H+[··Cl······]- (2)正 粗铜的精炼
(3)取一体积浓硝酸慢慢倒入到三体积浓盐酸中,不断用玻璃棒搅拌
(4)将金从溶液中还原出来 防止金属铂被还原
(5)Au+HNO3+4HCl H[AuCl4]+NO↑+2H2O或3Pt+4HNO3+18HCl 3H2[PtCl6]+4NO↑+8H2O或3Ag+HNO3+3HCl 3AgCl↓+NO↑+2H2O
(6)减少7.3 g
炼技法
【方法集训】
方法 化学工艺流程题解题策略
1.(2018山东聊城一模,27)铅的单质、氧化物、盐在现代工业中有着重要用途。
Ⅰ.(1)铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化物PbO2、类似Fe3O4的Pb3O4。Pb3O4 与HNO3发生非氧化还原反应生成一种盐和一种铅氧化物,其反应的化学方程式为 。
Ⅱ.以含铅废料(主要含Pb、PbO、PbO2、PbSO4)为原料制备高纯PbO,其主要流程如下:
(2)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成1 mol PbSO4 时转移电子的物质的量为 mol。
(3)已知:PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq) NaHPbO2(aq),其溶解度曲线如图所示:
结合上述信息,完成由粗品PbO(所含杂质不溶于NaOH溶液)得到高纯PbO的操作:将粗品PbO溶解在一定量 (填“35%”或“10%”)的NaOH 溶液中,加热至110 ℃,充分溶解后, (填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)工业上利用硫化氢除去滤液A 中少量的Pb2+,发生的反应为Pb2++H2S PbS↓+2H+,该反应的平衡常数为 (H2S的Ka1=1.5×10-7,Ka2=7.0×10-15,PbS的Ksp=8.4×10-28)。
(5)将粗品PbO溶解在盐酸和NaCl的混合溶液中,得到含Na2PbCl4的电解液,电解Na2PbCl4溶液生成Pb的装置如图所示:
①阴极的电极反应式为 ;
②当有2.07 g Pb生成时,通过质子交换膜的n(H+)= 。
答案 (1)Pb3O4+4HNO3 2Pb(NO3)2+PbO2+2H2O
(2)1 (3)35% 趁热过滤
(4)1.25×106
(5)①PbCl42-+2e- Pb+4Cl- ②0.02 mol
2.(2017山东潍坊二模,27)金属钛被誉为“21世纪金属”。工业上用钛矿石(FeTiO3,含少量FeO、Al2O3、SiO2等杂质)制得海绵钛的流程如下。
回答下列问题:
(1)要提高酸浸时钛矿石的溶解速率,请提供可行的措施: ,酸浸时主要反应的化学方程式为 。
(2)副产品中含有杂质。要将副产品进一步提纯,请结合下图的绿矾溶解度曲线完成提纯过程:
将副产品溶于稀硫酸中,加入足量的铁粉,充分搅拌后,用NaOH溶液调节反应液的pH约为5,过滤沉淀后得到FeSO4溶液, ,过滤,用冰水洗涤,低温干燥,得到FeSO4·7H2O晶体。
(3)高温时,由TiO2转化为TiCl4的化学方程式为 。在一定条件下,将足量TiO2(s)和固体炭放入密闭容器中,再通入Cl2进行反应至平衡,当改变外界条件时,TiCl4(g)体积分数φ(TiCl4)变化的趋势如下图所示,由图判断:
①该反应的ΔH 0(填“>”或“<”)。
②在750 ℃、100 MPa和800 ℃、200 MPa下Cl2的转化率分别为α1、α2,则α1 α2(填“>”“<”或“=”)。
(4)常温下,H2TiO3的沉淀溶解平衡为H2TiO3(s) TiO2+(aq)+2OH-(aq),其溶度积常数Ksp=1.0×10-29 mol3·L-3。若在TiOSO4溶液中加入NaOH溶液调pH使TiO2+完全沉淀(当离子浓度小于或等于10-5 mol·L-1时可认为已完全沉淀),则此时溶液的pH至少为 。
答案 (1)粉碎矿石,加热反应物 2H2SO4+FeTiO3 TiOSO4+FeSO4+2H2O
(2)加热浓缩得到60 ℃饱和溶液,冷却至室温(或0 ℃)结晶
(3)TiO2+2Cl2+2CTiCl4+2CO ①< ②> (4)2
过专题
【五年高考】
A组 山东省卷、课标卷题组
考点一 钠及其化合物
1.(2015山东理综,10,5分)某化合物由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气体和沉淀产生。下列化合物中符合上述条件的是( )
A.AlCl3 B.Na2O C.FeCl2 D.SiO2
答案 A
2.(2014课标Ⅱ,9,6分)下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
答案 B
考点二 铁及其化合物
3.(2018课标Ⅰ,7,6分)磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。采用湿法冶金工艺回收废旧磷酸亚铁锂电池正极片中的金属,其流程如下:
下列叙述错误的是( )
A.合理处理废旧电池有利于保护环境和资源再利用
B.从“正极片”中可回收的金属元素有Al、Fe、Li
C.“沉淀”反应的金属离子为Fe3+
D.上述流程中可用硫酸钠代替碳酸钠
答案 D
4.(2016课标Ⅱ,28,15分)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol·L-1的溶液。在FeCl2溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取2 mL FeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mL FeCl2溶液中先加入0.5 mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是 。
(4)丙组同学取10 mL 0.1 mol·L-1 KI溶液,加入6 mL 0.1 mol·L-1 FeCl3溶液混合。分别取2 mL此溶液于3支试管中进行如下实验:
①第一支试管中加入1 mL CCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③第三支试管中加入1滴KSCN溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在I-过量的情况下,溶液中仍含有
(填离子符号),由此可以证明该氧化还原反应为 。
(5)丁组同学向盛有H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为 ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成。产生气泡的原因是 ;生成沉淀的原因是 (用平衡移动原理解释)。
答案 (15分)(1)防止Fe2+被氧化
(2)2Fe2++Cl2 2Fe3++2Cl-
(3)隔绝空气(排除氧气对实验的影响)
(4)Fe2+ Fe3+ 可逆反应
(5)2Fe2++H2O2+2H+ 2Fe3++2H2O Fe3+催化H2O2分解产生O2 H2O2分解反应放热,促进Fe3+的水解平衡正向移动
5.(2015课标Ⅰ,27,14分)硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
回答下列问题:
(1)写出Mg2B2O5·H2O与硫酸反应的化学方程式 。为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有 (写出两条)。
(2)利用 的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是 。(写化学式)
(3)“净化除杂”需先加H2O2溶液,作用是 。然后再调节溶液的pH约为5,目的是 。
(4)“粗硼酸”中的主要杂质是 (填名称)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为 。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程 。
答案 (1)Mg2B2O5·H2O+2H2SO4 2H3BO3+2MgSO4(2分) 提高反应温度、减小铁硼矿粉粒径(2分)
(2)Fe3O4 SiO2和CaSO4(1分,2分,共3分)
(3)将Fe2+氧化成Fe3+ 使Fe3+与Al3+形成氢氧化物沉淀而除去(每空1分,共2分)
(4)(七水)硫酸镁(1分)
(5)Na+[H··B··HH····H]-(2分)
(6)2H3BO3 B2O3+3H2O、B2O3+3Mg 2B+3MgO(2分)
考点三 金属冶炼 铝和铜及其化合物
6.(2015课标Ⅰ,10,6分)下列实验中,对应的现象以及结论都正确且两者具有因果关系的是( )
选项
实验
现象
结论
A.
将稀硝酸加入过量铁粉中,充分反应后滴加KSCN溶液
有气体生成,溶液呈血红色
稀硝酸将Fe氧化为Fe3+
B.
将铜粉加入1.0 mol·L-1 Fe2(SO4)3溶液中
溶液变蓝、有黑色固体出现
金属铁比铜活泼
C.
用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热
熔化后的液态铝滴落下来
金属铝的熔点较低
D.
将0.1 mol·L-1 MgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1 mol·L-1 CuSO4溶液
先有白色沉淀生成,后变为浅蓝色沉淀
Cu(OH)2的溶度积比Mg(OH)2的小
答案 D
7.(2017课标Ⅰ,27,14分)Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备。工艺流程如下:
回答下列问题:
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为 。
(2)“酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式 。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃
30
35
40
45
50
TiO2·xH2O转化率/%
92
95
97
93
88
分析40 ℃时TiO2·xH2O转化率最高的原因 。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为 。
(5)若“滤液②”中c(Mg2+)=0.02 mol·L-1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1.0×10-5 mol·L-1,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
答案 (1)100 ℃、2 h,90 ℃、5 h
(2)FeTiO3+4H++4Cl- Fe2++TiOCl42-+2H2O
(3)低于40 ℃,TiO2·xH2O转化反应速率随温度升高而增加;超过40 ℃,双氧水分解与氨气逸出导致TiO2·xH2O转化反应速率下降
(4)4 (5)Fe3+恰好沉淀完全时,c(PO43-)=1.3×10-221.0×10-5 mol·L-1=1.3×10-17mol·L-1,c3(Mg2+)·c2(PO43-)值为0.013×(1.3×10-17)2=1.7×10-40
相关文档
- 2020届高考化学一轮复习化学反应速2021-07-0813页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 2020届高考化学一轮复习化学反应速2021-07-0816页
- 2020届高考化学一轮复习化学平衡图2021-07-0825页
- 2020届高考化学一轮复习化学反应速2021-07-089页
- 2021届高考化学一轮复习化学平衡图2021-07-0811页
- 2020届高考化学一轮复习化学常用计2021-07-089页
- 2020届高考化学一轮复习化学能与热2021-07-087页
- 2021届高考化学一轮复习化学平衡及2021-07-0815页
- 2020届高考化学一轮复习化学平衡常2021-07-0811页