- 603.74 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
非选择题专项练(三)
三、非选择题:本题共 5 小题,共 60 分。
16.(2020 山东枣庄三模)(10 分)CO2 和 CH4 是两种主要的温室气体,以 CH4 和 CO2 为原料制造
更高价值的化学产品是用来缓解温室效应的研究方向,回答下列问题:
(1)工业上 CH4-H2O 催化重整是目前大规模制取合成气(CO 和 H2 混合气称为合成气)的重要方
法,其原理为:
反应Ⅰ:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
反应Ⅱ:CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41 kJ·mol-1
CH4(g)和 H2O(g)反应生成 CO2(g)和 H2(g)的热化学方程式
是 。
(2)将 1 mol CH4(g)和 1 mol H2O(g)加入恒温恒压的密闭容器中(温度 298 K、压强 100 kPa)发生
反应Ⅰ,不考虑反应Ⅱ的发生,该反应中,正反应速率 v 正=k 正×p(CH4)·p(H2O),p 为分压(分压=总
压×物质的量分数),若该条件下 k 正=4.5×10-4 kPa-1·s-1,当 CH4 分解 20%时,v 正= kPa·s-1。
(3)将 CO2 和 CH4 在一定条件下反应可制得合成气,在 1 L 密闭容器中通入 CH4 与 CO2,使其物
质的量浓度均为 1.0 mol·L-1,在一定条件下发生反应:CH4(g)+CO2(g) 2CO(g)+2H2(g),测得
CH4 的平衡转化率与温度及压强的关系如下图所示:
①压强 p1、p2、p3、p4 由小到大的关系为 。
②对于气相反应,用某组分(B)的平衡压强 p(B)代替物质的量浓度 c(B)也可表示平衡常数(记作
Kp),如果 p4=2 MPa,求 x 点的平衡常数 Kp= (用平衡分压代替平衡浓度计算)。
③下列措施中能使平衡正向移动的是 (填字母)。
a.升高温度
b.增大压强
c.保持温度、压强不变,充入 He
d.恒温、恒容,再充入 1 mol CO2 和 1 mol CH4
(4)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将 CO2 转化为气体燃料
CO(电解质溶液为稀硫酸),该装置工作时,M 为 (填“正”或“负”)极,导线中通过 2 mol 电
子后,假定体积不变,M 极电解质溶液的 pH (填“增大”“减小”或“不变”),N 极电解质溶
液变化的质量 Δm= g。
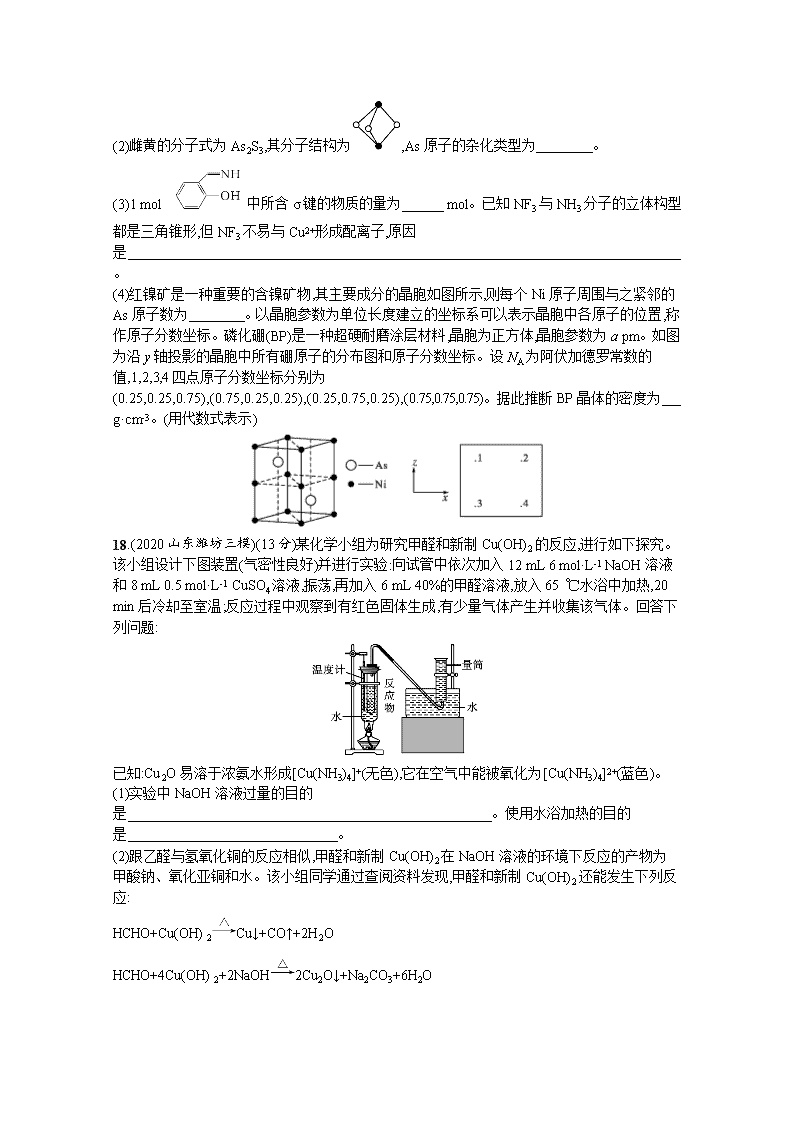
17.(2020 山东省实验中学线上诊断)(12 分)氮族元素在化学领域具有重要的地位。请回答下列
问题:
(1)基态氮原子的价电子排布图为 ;第二周期的元素中,第一电离能介于 B 和 N
之间的元素有 种。
(2)雌黄的分子式为 As2S3,其分子结构为 ,As 原子的杂化类型为 。
(3)1 mol 中所含 σ 键的物质的量为 mol。已知 NF3 与 NH3 分子的立体构型
都是三角锥形,但 NF3 不易与 Cu2+形成配离子,原因
是
。
(4)红镍矿是一种重要的含镍矿物,其主要成分的晶胞如图所示,则每个 Ni 原子周围与之紧邻的
As 原子数为 。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称
作原子分数坐标。磷化硼(BP)是一种超硬耐磨涂层材料,晶胞为正方体,晶胞参数为 a pm。如图
为沿 y 轴投影的晶胞中所有硼原子的分布图和原子分数坐标。设 NA 为阿伏加德罗常数的
值,1,2,3,4 四点原子分数坐标分别为
(0.25,0.25,0.75),(0.75,0.25,0.25),(0.25,0.75,0.25),(0.75,0.75,0.75)。据此推断 BP 晶体的密度为
g·cm-3。(用代数式表示)
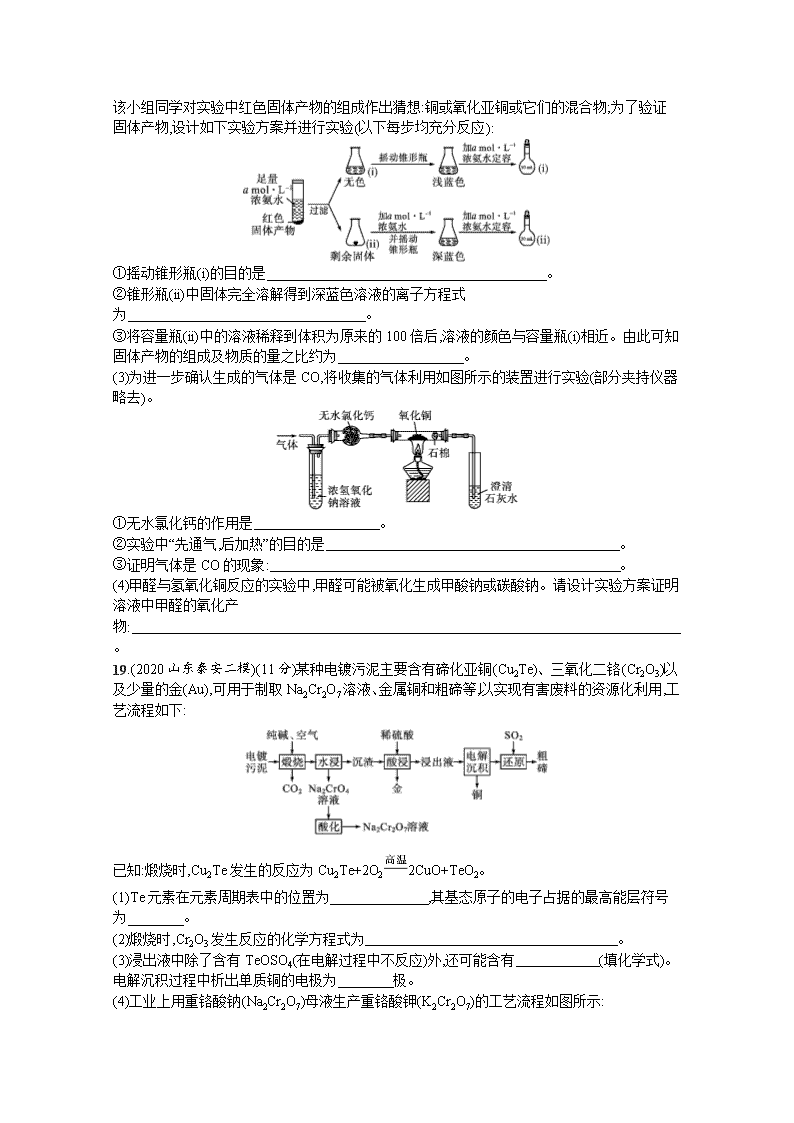
18.(2020 山东潍坊三模)(13 分)某化学小组为研究甲醛和新制 Cu(OH)2 的反应,进行如下探究。
该小组设计下图装置(气密性良好)并进行实验:向试管中依次加入 12 mL 6 mol·L-1 NaOH 溶液
和 8 mL 0.5 mol·L-1 CuSO4 溶液,振荡,再加入 6 mL 40%的甲醛溶液,放入 65 ℃水浴中加热,20
min 后冷却至室温;反应过程中观察到有红色固体生成,有少量气体产生并收集该气体。回答下
列问题:
已知:Cu2O 易溶于浓氨水形成[Cu(NH3)4]+(无色),它在空气中能被氧化为[Cu(NH3)4]2+(蓝色)。
(1)实验中 NaOH 溶液过量的目的
是 。使用水浴加热的目的
是 。
(2)跟乙醛与氢氧化铜的反应相似,甲醛和新制 Cu(OH)2 在 NaOH 溶液的环境下反应的产物为
甲酸钠、氧化亚铜和水。该小组同学通过查阅资料发现,甲醛和新制 Cu(OH)2 还能发生下列反
应:
HCHO+Cu(OH)2 Cu↓+CO↑+2H2O
HCHO+4Cu(OH)2+2NaOH 2Cu2O↓+Na2CO3+6H2O
该小组同学对实验中红色固体产物的组成作出猜想:铜或氧化亚铜或它们的混合物;为了验证
固体产物,设计如下实验方案并进行实验(以下每步均充分反应):
①摇动锥形瓶(i)的目的是 。
②锥形瓶(ii)中固体完全溶解得到深蓝色溶液的离子方程式
为 。
③将容量瓶(ii)中的溶液稀释到体积为原来的 100 倍后,溶液的颜色与容量瓶(i)相近。由此可知
固体产物的组成及物质的量之比约为 。
(3)为进一步确认生成的气体是 CO,将收集的气体利用如图所示的装置进行实验(部分夹持仪器
略去)。
①无水氯化钙的作用是 。
②实验中“先通气,后加热”的目的是 。
③证明气体是 CO 的现象: 。
(4)甲醛与氢氧化铜反应的实验中,甲醛可能被氧化生成甲酸钠或碳酸钠。请设计实验方案证明
溶液中甲醛的氧化产
物:
。
19.(2020 山东泰安二模)(11 分)某种电镀污泥主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以
及少量的金(Au),可用于制取 Na2Cr2O7 溶液、金属铜和粗碲等,以实现有害废料的资源化利用,工
艺流程如下:
已知:煅烧时,Cu2Te 发生的反应为 Cu2Te+2O2 2CuO+TeO2。
(1)Te 元素在元素周期表中的位置为 ,其基态原子的电子占据的最高能层符号
为 。
(2)煅烧时,Cr2O3 发生反应的化学方程式为 。
(3)浸出液中除了含有 TeOSO4(在电解过程中不反应)外,还可能含有 (填化学式)。
电解沉积过程中析出单质铜的电极为 极。
(4)工业上用重铬酸钠(Na2Cr2O7)母液生产重铬酸钾(K2Cr2O7)的工艺流程如图所示:
通过冷却结晶能析出大量 K2Cr2O7 的原因
是
。
(5)测定产品中 K2Cr2O7 含量的方法如下:称取试样 2.50 g 配成 250 mL 溶液,取 25.00 mL 置于
锥形瓶中,加入足量稀硫酸和几滴指示剂,用 0.100 0 mol·L-1(NH4)2Fe(SO4)2 标准液进行滴定。滴
定过程中发生反应的离子方程式为 。若三次实验
消耗(NH4)2Fe(SO4)2 标准液的体积平均为 25.00 mL,则所得产品中 K2Cr2O7 的纯度为
%(保留三位有效数字)。
20.(2019 山东烟台 3 月诊断)(14 分)化合物 E(碘他拉酸)可用于 CT 检查、动静脉造影等,其一种
合成路线如下:
C
(1)A 中含有的含氧官能团为 ,①~④中不属于取代反应的是 。
(2)C 的结构简式为 ;药品中碘他拉酸的含量通常采用测定药品中碘量的方法确定,
则测定碘量需要用到的试剂为 。
(3)B 有多种同分异构体,满足下列条件的同分异构体的结构简式为 。
①苯环上有五个取代基 ②1 mol 能与 2 mol NaHCO3 发生反应 ③能发生银镜反应 ④核磁
共振氢谱只有 4 个峰
(4)已知:①苯胺( )易被氧化,
② 。
请以甲苯和(CH3CO)2O 为原料制备 ,写出相应的合成路线流程图(无机试剂任
选,合成路线流程图示例见本题题干)。
参考答案
非选择题专练(三)
16.答案(1)CH4(g)+2H2O(g) CO2(g)+4H2(g) ΔH=+165.4 kJ·mol-1 (2)0.5
(3)①p1ⅢA 族、ⅤA 族>ⅥA 族,因此第一电离能在
B 和 N 之间的元素是 Be、C、O,共有 3 种。
(2)As 原子最外层有 5 个电子,根据 As2S3 的分子结构可以得出 As 形成 3 个 σ
键,并且还有 1 个孤对电子,因此 As 的杂化类型为 sp3。
(3)两个成键原子之间只能形成 1 个 σ 键,1mol 中含有 σ 键物质的量
为 15mol;F 的电负性比 N 大,N—F 成键电子对向 F 偏移,导致 NF3 中 N 原子核对
其孤对电子的吸引能力增强,难以形成配位键,故 NF3 不易与 Cu2+形成配离子。
(4)以顶点为中心,结合晶体图像分析可知,晶体中每个 Ni 原子周围与之紧邻的
As 原子个数为 6;BP 是一种超硬耐磨涂层,以及四点的坐标,推出 BP 应是原子晶体,
则晶胞的质量为 4
푁A
×42g,晶体体积为(a×10-10)3cm3,则晶胞的密度是 4 × 42
푁A × 푎3 × 10-30
g·cm-3 或4 × 42 × 1030
푁A × 푎3 g·cm-3。
18.答案(1)提供碱性溶液环境或 OH-与 Cu(OH)2 反应生成[Cu(OH)4]2- 受热均匀便
于控制温度
(2)①有利于溶液与空气中的氧气接触
②2Cu+8NH3·H2O+O2 2[Cu(NH3)4]2++4OH-+6H2O
③n(Cu2O)∶n(Cu)=1∶200
(3)①吸收水蒸气 ②排尽装置中的空气,防止加热时发生爆炸
③黑色粉末变为红色,澄清石灰水变浑浊
(4)取少量反应后的澄清溶液置于试管中,滴入过量的盐酸,若无气泡产生,说明
甲醛被氧化成甲酸钠,若有气泡产生,说明甲醛被氧化为碳酸钠
解析根据题干信息分析可知,实验中向试管依次加入 12mL6mol·L-1NaOH 溶液和
8mL0.5mol·L-1CuSO4 溶液,碱过量,振荡发生反应 Cu2++2OH- Cu(OH)2↓,碱性条件
下再加入 6mL40%的甲醛溶液,放入 65℃水浴中加热,发生反应
2Cu(OH)2+HCHO+NaOH Cu2O↓+3H2O+HCOONa,也可能发生反应
HCHO+Cu(OH)2 Cu↓+CO↑+2H2O、HCHO+4Cu(OH)2+2NaOH
2Cu2O↓+Na2CO3+6H2O,因此红色固体可能是 Cu2O 和 Cu 的混合物,气体为 CO,可
根据已知“Cu2O 易溶于浓氨水”验证固体产物,根据 CO 具有还原性验证气体为 CO。
(1)由上述分析可知,实验中 NaOH 溶液过量的目的是提供碱性溶液环境或
OH-与 Cu(OH)2 反应生成[Cu(OH)4]2-,水浴加热的目的是使受热均匀便于控制温度。
(2)①已知[Cu(NH3)4]+在空气中能被氧化为[Cu(NH3)4]2+,摇动锥形瓶(ⅰ)有利于
溶液与空气中的氧气接触;②剩余固体为 Cu,与浓氨水反应生成深蓝色的四氨合铜
离子,反应的离子方程式为 2Cu+8NH3·H2O+O2 2[Cu(NH3)4]2++4OH-+6H2O。③将
容量瓶(ⅱ)中的溶液稀释到体积为原来的 100 倍后,溶液的颜色与容量瓶(ⅰ)相近,
说明(ⅱ)中的溶液的浓度是(ⅰ)中的溶液的 100 倍,又
Cu2O~2[Cu(NH3)4]2+,Cu~[Cu(NH3)4]2+,则有 n(Cu2O)∶n(Cu)=1∶200。
(3)①无水氯化钙可吸收 CO 气体中混有的水蒸气。②CO 与空气混合加热可能
会爆炸,有安全隐患,因此实验中“先通气,后加热”的目的是为了排尽装置中的空气,防
止加热时发生爆炸。③CO 具有还原性,可与黑色的 CuO 发生氧化还原反应生成红
色的铜,并生成 CO2 气体,因此证明气体是 CO 的现象为黑色粉末变为红色,澄清石
灰水变浑浊。
(4)在题给实验中甲醛可能被氧化的产物为甲酸钠或碳酸钠,碳酸钠可与盐酸反
应生成 CO2 气体,而甲酸钠不可以,因此证明溶液中甲醛的氧化产物时,可取少量反
应后的澄清溶液置于试管中,滴入过量的盐酸,若无气泡产生,说明甲醛被氧化成甲
酸钠,若有气泡产生,说明甲醛被氧化为碳酸钠。
19.答案(1)第五周期ⅥA 族 O (2)2Cr2O3+3O2+4Na2CO3 4Na2CrO4+4CO2
(3)CuSO4 阴
(4)低温条件下,K2Cr2O7 的溶解度在整个体系中最小,且 K2Cr2O7 的溶解度随温
度的降低而显著减小
(5)Cr2O2-
7 +6Fe2++14H+ 2Cr3++6Fe3++7H2O 49.0
解析某种电镀污泥中主要含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量的金
(Au),可以用于制取 Na2Cr2O7 溶液、金属铜、粗碲等。根据流程图,煅烧时 Cu2Te 发
生的反应为 Cu2Te+2O2 2CuO+TeO2,Cr2O3 与纯碱和空气中的氧气反应生成
Na2CrO4,Na2CrO4 酸化后生成 Na2Cr2O7 溶液;沉渣中主要含有 CuO、TeO2 以及少量
的金(Au),用稀硫酸溶解后,浸出液中主要含有铜离子和 TeOSO4,电解时铜离子放电
生成铜,溶液中含有 TeOSO4,TeOSO4 与二氧化硫发生氧化还原反应生成粗碲。
(1)Te 是 52 号元素,原子核外电子排布为 2、8、18、18、6,可见 Te 元素在元素
周期表中的位置为第五周期ⅥA 族,最高能层为第 5 能层,故其基态原子的电子占
据的最高能层符号为 O。
(2)煅烧时,Cr2O3 与 O2 及 Na2CO3 发生反应产生 Na2CrO4 和 CO2,反应的化学方
程式为 2Cr2O3+3O2+4Na2CO3 4Na2CrO4+4CO2。
(3)根据上述分析,浸出液中除了含有 TeOSO4(在电解过程中不反应)外,还可能
含有 CuSO4,Cu2+转化为铜单质发生还原反应,电解沉积过程中析出单质铜的电极为
阴极。
(4)在低温条件下 K2Cr2O7 的溶解度在整个体系中最小,且 K2Cr2O7 的溶解度随
温度的降低而显著减小,因此通过冷却结晶能析出大量 K2Cr2O7。
(5)氧化还原滴定过程中发生 Fe2+与 Cr2O2-
7 的反应,其中 Cr2O2-
7 被还原为
Cr3+,Fe2+被氧化为 Fe3+,根据电子守恒、电荷守恒及原子守恒,可得该反应的离子方
程式为 Cr2O2-
7 +6Fe2++14H+ 2Cr3++6Fe3++7H2O。反应中消耗 Fe2+的物质的量
n(Fe2+)=c·V=0.1000mol·L-1×0.025L=0.0025mol,根据离子方程式 Cr2O2-
7 +6Fe2++14H+
2Cr3++6Fe3++7H2O 可知,n(Cr2O2-
7 )=1
6n(Fe2+)=0.0025
6 mol,则所得样品中 K2Cr2O7 的
纯度=
0.0025mol
6 × 294g·mol-1
2.50g × 25.0mL
250mL
×100%=49.0%。
20.答案(1)硝基、羧基、酯基 ②
(2) NaOH 溶液、稀硝酸、AgNO3 溶液
(3) 、
(4)
或
解析(1)A 中含有的含氧官能团为硝基、羧基、酯基,反应②发生的是把硝基还原为
氨基的反应。
(2)②发生的是加氢还原反应,把硝基还原为氨基,故 C 的结构简式为
;化合物 E(碘他拉酸 )在 NaOH 溶液中水解生成
NaI,在水解液中加入稀硝酸、AgNO3 溶液产生黄色沉淀,过滤、洗涤、干燥、称量
沉淀,根据沉淀的质量可计算含碘量,则测定碘量需要用到的试剂为 NaOH 溶液、稀
硝酸、AgNO3 溶液。
(3)B 的分子式为 C9H8NO5,它的同分异构体满足:①苯环上有五个取代基;②
1mol 能与 2molNaHCO3 发生反应,说明含 2 个羧基;③能发生银镜反应,说明含醛基;
④核磁共振氢谱只有 4 个峰,说明有 4 种不同环境的氢原子,则结构简式为
、 。
(4)以甲苯和(CH3CO)2O 为原料制备 ,合成路线流程图为:
或
。