- 1.27 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
福建省莆田第一中学2019-2020学年高二上学期期中考试
化学试题
1.对化学反应速率和平衡的研究具有十分重要的意义,下列认识正确的是
A. 用冰箱冷藏食物,能使其永远不腐败变质
B. 尾气转化催化剂可以完全消除汽车尾气污染
C. 调整反应条件无法使可逆反应正向进行到底
D. 化学反应速率越快可逆反应正向进行的程度越大
【答案】C
【解析】
【详解】A. 用冰箱冷藏食物,可以减小腐败变质的化学反应速率,故可以对食物进行短期内的保鲜,但是不可能使其永远不腐败变质,A认识不正确;
B. 尾气的转化是有一定限度的,故尾气转化催化剂不可能完全消除汽车尾气污染,B认识不正确;
C. 调整反应条件可以使化学平衡尽可能地向正反应方向移动,但是无法使可逆反应正向进行到底,C认识正确;
D. 化学反应速率表示化学反应进行快慢,这与可逆反应正向进行的程度没有关系,可逆反应进行的程度由平衡常数决定,D认识不正确。
综上所述,认识正确的是C。
2.下列化学反应属于吸热反应的是
A. 木炭燃烧 B. 铝热反应 C. 氯化铵与消石灰反应 D. 氢氧化钠与硝酸反应
【答案】C
【解析】
【详解】A.木炭燃烧是放热反应,故A不选;
B.铝热反应是放热反应,故B不选;
C. 氯化铵与消石灰反应是吸热反应,故C选;
D.氢氧化钠和硝酸反应是中和反应,是放热反应,故D不选。
答案选C。
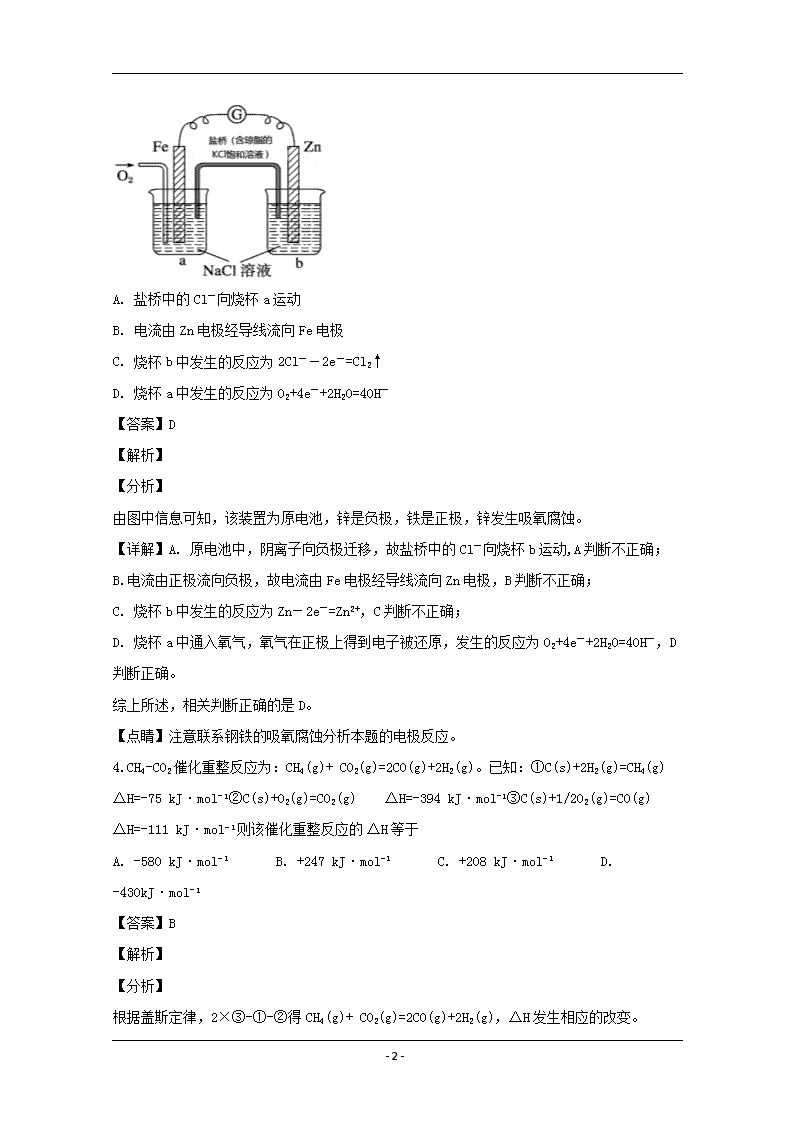
3.根据如图所示,下列判断中正确的是
- 24 -
A. 盐桥中的Cl-向烧杯a运动
B. 电流由Zn电极经导线流向Fe电极
C. 烧杯b中发生的反应为2Cl--2e-=Cl2↑
D. 烧杯a中发生的反应为O2+4e-+2H2O=4OH-
【答案】D
【解析】
【分析】
由图中信息可知,该装置为原电池,锌是负极,铁是正极,锌发生吸氧腐蚀。
【详解】A. 原电池中,阴离子向负极迁移,故盐桥中的Cl-向烧杯b运动,A判断不正确;
B.电流由正极流向负极,故电流由Fe电极经导线流向Zn电极,B判断不正确;
C. 烧杯b中发生的反应为Zn-2e-=Zn2+,C判断不正确;
D. 烧杯a中通入氧气,氧气在正极上得到电子被还原,发生的反应为O2+4e-+2H2O=4OH-,D判断正确。
综上所述,相关判断正确的是D。
【点睛】注意联系钢铁的吸氧腐蚀分析本题的电极反应。
4.CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g)。已知:①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1②C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1③C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1则该催化重整反应的ΔH等于
A. -580 kJ·mol−1 B. +247 kJ·mol−1 C. +208 kJ·mol−1 D. -430kJ·mol−1
【答案】B
【解析】
【分析】
根据盖斯定律,2×③-①-②得CH4(g)+ CO2(g)=2CO(g)+2H2(g),△H发生相应的改变。
- 24 -
【详解】已知:①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
②C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
③C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
根据盖斯定律,2×③-①-②得CH4(g)+ CO2(g)=2CO(g)+2H2(g),△H=2×(-111 kJ·mol−1)-(-75 kJ·mol−1)-(-394 kJ·mol−1)=+247 kJ·mol−1,答案选B。
5.在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)C(g)+D(g),下列描述中不能表明该反应已达到平衡状态的是
A. 混合气体的密度不变 B. 单位时间内生成nmolD,同时生成nmolC
C. 容器中的温度不再变化 D. C(g)的物质的量浓度不变
【答案】B
【解析】
【详解】A. 反应物中有固体,在反应过程中固体转化为气体,气体的质量变大,而容器的体积不变,故混合气体的密度是变量,当混合气体的密度不变时,表明各组分的浓度保持不变,故A能表明该反应已达到平衡状态;
B. 单位时间内生成nmolD,同时生成nmolC,只说明了正反应速率,不能说明正反应速率等于逆反应速率,故B不能表明该反应已达到平衡状态;
C. 化学反应一定会伴随着能量变化,由于该容器为绝热的,故在反应过程中容器内的温度会有变化,当容器中的温度不再变化时,说明正反应速率等于逆反应速率,故C能表明该反应已达到平衡状态;
D. C(g)的物质的量浓度不变,说明正反应速率等于逆反应速率,故D能表明该反应已达到平衡状态。
综上所述,不能表明该反应已达到平衡状态的是B。
【点睛】绝热容器内不与外界进行热交换,可逆反应在建立化学平衡的过程中一定会伴随着能量变化,要么放热,要么吸热,总之,在反应过程中,容器内的温度会发生变化。当正反应速率等于逆反应速率时,容器内的温度不再发生变化。
6.下列操作或现象正确的是
①对二次电池进行充电
- 24 -
②验证Na2O2溶于水的热效应
③中和热的测定
④金属铁的腐蚀
A ②④ B. ①②③ C. ①④ D. ①②③④
【答案】A
【解析】
【详解】①对二次电池进行充电时,二次电池的正极要与充电电源的正极相连作阳极,①的操作不正确;
②由图中信息可知,装有红墨水的U形管右侧液面升高,说明Na2O2溶于水是入热的,故②验证Na2O2溶于水的热效应的操作与现象是正确的;
③中和热的测定装置中,小烧杯和大烧杯的口不在同一水平,这样操作会使热量损失变大,实验误差过大,故③操作不正确;
④金属铁的腐蚀属于吸氧腐蚀,氧气参与原电池反应导致瓶内气压减小,故U形管的左侧液面升高,④的操作和现象正确。
综上所述,操作或现象正确的是②④,故选A。
7.对可逆反应2A(s)+3B(g)C(g)+2D(g)ΔH<0,在一定条件下达平衡,下列有关叙述正确的是①增加A的量,平衡向正反应方向移动②升高温度,平衡向逆反应方向移动,v正减小③压强增大一倍,平衡不移动,v正、v逆不变④增大B的浓度,v正>v逆⑤加入催化剂,平衡向正反应方向移动
A. ①② B. ④ C. ③ D. ④⑤
【答案】B
【解析】
【分析】
- 24 -
对可逆反应2A(s)+3B(g)C(g)+2D(g)ΔH<0,该反应为放热反应,在一定条件下达平衡.
【详解】①增加A的量,其浓度不发生变化,故平衡不移动,①不正确;
②升高温度,化学平衡向吸热反应方向移动,故平衡向逆反应方向移动,但是v正增大,②不正确;
③压强增大一倍,平衡不移动,v正、v逆增大,③不正确;
④在平衡状态下,增大B的浓度,正反应速率加快,故v正>v逆,④正确;
⑤加入催化剂,化学反应速率加快,但是化学平衡不移动,⑤不正确。
综上所述,有关叙述正确的是④,故选B。
8.向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g) B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
【答案】D
【解析】
【分析】
t1时△c(A)=0.15mol/L-0.06mol/L=0.09mol/L、△c(C)=0.11mol/L-0.05mol/L=0.06mol/L,化学方程式中A与C的计量数之比为0.09:0.06=3:2。
【详解】A. t0~t1阶段 △c(A)=0.15mol/L-0.06mol/L=0.09mol/L,若t1=15s,则t0~t1阶段 v(A)==0.006 mol·L-1·s-1,故A错误;
B. 起始时加入0.3mol A,据图可知,起始时A的物质的量浓度为0.15mol/L,说明容器的体积为2L,t0~t1阶段消耗A的物质的量为0.09mol/L×2=0.18mol,此过程中放出a
- 24 -
kJ热量,则3molA完全反应时放出的热量为kJ=16.7a kJ,该反应的热化学方程式为:3A(g)B(g)+2C(g) ΔH=-16.7a kJ·mol-1,故B错误;
C. 起始时加入0.3mol A,据图可知,起始时A的物质的量浓度为0.15mol/L,说明容器的体积为2L,达到平衡时,A的物质的量浓度减少0.09mol/L,由方程式3A(g) B(g)+2C(g)可知,B的物质的量浓度应增加0.03mol/L,所以起始时B的物质的量浓度为(0.05-0.03)mol/L=0.02mol/L,起始时B的物质的量为0.02mol/L×2L=0.04mol,故C错误;
D. 据图可知,到t1时各物质的物质的量浓度不再改变,说明反应达到了平衡状态,t0~t1阶段消耗A的物质的量为0.09mol/L×2=0.18mol,则A的转化率为:×100%=60%,故D正确,答案选D。
【点睛】本题考查化学平衡图象的分析与判断,题目难度一般,易错点为B项,注意实际放出热量与热化学方程式书写之间的关系。
9.下列图示与对应的叙述相符的是
A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol-1
B. 图2表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大
C. 图3表示某吸热反应在无催化剂(a)和有催化剂(b)时反应的能量变化
- 24 -
D. 图4表示某可逆反应的速率随时间的变化关系,t0时刻改变的条件可能是使用了催化剂
【答案】D
【解析】
【详解】A.由 图1可知,2mol H2与1mol O2完全反应生成气态水,放出483.6kJ的能量,但是无法判断生成液态水所放出的能量,故无法判断H2的燃烧热是多少,A不相符;
B. 2A(g)+2B(g)3C(g)+D(s)正反应气体分子数减少,增大压强化学平衡向正反应方向移动,反应物的百分含量减小,而图2中乙和甲在平衡状态的反应物的百分含量相同,故B不相符;
C. 由图3中的信息可知,该反应中的反应物的总能量大于生成物的总能量,故该反应为放热反应,因此C与对应的叙述不相符;
D. 由图4中的信息可知,该反应在平衡状态下改变条件后,正反应速率和逆反应速率均增大了,且增大的程度相同,正反应速率仍然等于逆反应速率,化学平衡不发生移动,因此,t0时刻改变的条件可能是使用了催化剂,D与相应的叙述相符。
综上所述,图示与相应的叙述相符的是D。
10.以氨气代替氢气研发氨燃料电池是当前科研的热点。如图是两种氨燃料电池,下列说法正确的是
- 24 -
A. 随着反应的进行,两个装置中电解质不断减少,需及时补充电解质
B. 工作时,图1中OH-移向Y极
C. 两个原电池中均生成1molN2时,移动到负极阴离子均为6mol
D. 两个装置中负极的电极反应式不同,图2的为2NH3+3O2--6e-=N2+3H2O
【答案】D
【解析】
【分析】
以氨气代替氢气研发的氨燃料电池,不论电解质是什么物质,电池反应的产物均为氮气和水。
【详解】A. 氨气的氧化产物是氮气和水,产物不与电解质反应,故随着反应的进行,两个装置中电解质不会减少,不需补充电解质,A不正确;
B. 工作时,图1中X为负极,OH-移向X极,B不正确;
C. 两个原电池中均生成1molN2时,图1中移动到负极的阴离子(OH-)为6mol,图2中移动到负极的阴离子(O2-)为3mol,C不正确;
D. 两个装置中负极的电极反应式不同,图1中的负极的电极反应式为2NH3+6OH--6e-=N2+6H2O,图2的为2NH3+3O2--6e-=N2+3H2O,D正确。
综上所述,相关说法正确的是D。
11.下列关于金属腐蚀与防护的说法不正确的是
A. 图①,放置于干燥空气中的铁钉不易生锈
- 24 -
B. 图②,若将钢闸门与电源的正极相连,可防止钢闸门腐蚀
C. 图②,若断开电源,钢闸门将发生吸氧腐蚀
D. 图③,若金属M比Fe活泼,可防止输水管腐蚀
【答案】B
【解析】
【详解】A.形成原电池需要电解质溶液,所以干燥空气中不易形成原电池,则铁钉不易生锈,故A正确;
B. 与原电池的正极相连作阳极,活泼金属作阳极时,金属失电子易被腐蚀,所以若将钢闸门与电源的正极相连,不能防止钢闸门腐蚀,故B错误;
C.中性、碱性和弱酸性条件下易发生吸氧腐蚀,所以钢闸门会发生吸氧腐蚀,故C正确;
D. 若金属M比Fe活泼,M、Fe形成原电池时,Fe作正极,M失电子作负极,Fe被保护,故D正确;
答案选B。
12.如图是关于可逆反应(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是
A. 升高温度
B. 降低压强
C. 增大反应物浓度,同时使用正催化剂
D. 增大反应物浓度,同时减小生成物浓度
【答案】D
【解析】
【详解】A、升高温度,正逆反应速率都增大,平衡向逆反应方向移动,逆反应速率应在正反应速率的上方,故A错误;
B、降低压强,正逆反应速率都降低,故B错误;
C、增大反应物浓度,同时使用正催化剂,正逆反应速率都增大,平衡向正反应移动,正反应速率应在逆速率的上方,故C错误;
- 24 -
D、增大反应物浓度,同时减小生成物浓度,瞬间正反应速率增大,逆反应速率减小,平衡向正反应移动,所以D选项是正确的。
故答案选D。
13.下列说法中有明显错误的是( )
A. 对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B. 升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C. 活化分子之间发生的碰撞一定为有效碰撞
D. 加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
【答案】C
【解析】
【详解】A. 增大压强体系体积减小,对于有气体参加的反应,可使单位体积内活化分子数增加,反应速率增大,故A正确;
B. 升高温度,反应体系中物质的能量升高,一般可使活化分子的百分数增大,因而反应速率增大,故B正确;
C. 由于活化分子之间的碰撞分为有效碰撞和无效碰撞,故C错误;
D. 催化剂可使反应需要的能量减小,使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率,故D正确。
故选C。
【点睛】活化分子是指具有发生化学反应所需最低能量状态的分子。分子之间发生化学反应,首先必须互相接触(或碰撞)但并非每次碰撞都能发生反应,只有能量较大的分子互相碰撞才能发生反应。这些能量超过某一数值而能发生化学反应的分子就是活化分子。活化分子的浓度是决定反应速度的一个重要因素。活化分子浓度越大则反应速度越快。
14.硼化钒(VB2)—空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2+ 11O2 =4B2O3+ 2V2O5,下列说法正确的是
- 24 -
A. 电极a为电池负极,发生还原反应
B. 每消耗1molVB2转移6mol电子
C. 电池工作时,OH
向电极a移动
D. VB2极发生的电极反应为:2VB2+22OH−-22e−=V2O5+2B2O3+11H2O
【答案】D
【解析】
【详解】A.硼化钒-空气燃料电池中,VB2在负极失电子,氧气在正极上得电子,所以a为正极,A错误;
B.负极上是VB2失电子发生氧化反应,每消耗1mol VB2转移电子,B错误;
C.原电池中,阴离子向负极移动,阳离子向正极移动,所以溶液中的OH-向另一极移动,C错误;
D.负极上是VB2失电子发生氧化反应,则VB2极发生的电极反应为:2VB2+ 22OH−-22e−=V2O5+ 2B2O3+ 11H2O,D正确;
答案选D。
【点晴】掌握原电池的工作原理是解答的关键,原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。解答时注意把握电极反应式的书写,正确判断离子的定向移动。
15.向一个绝热恒容密闭容器中通入CO(g)和H20(g),—定条件下使反应C0(g)+H20(g)C02(g)+H2(g)达到平衡,正反应速率随时间变化的曲线如图所示,由图可得出的结论正确的是
- 24 -
A. 反应物浓度:a点小于c点
B. 该反应的正反应可能为放热反应
C. c点达到平衡状态
D. △t1=△t2时,H2的产率:a〜b段大于b〜c段
【答案】B
【解析】
【分析】
由化学方程式可知该反应是一个反应前后气体体积不变的可逆反应,由于容器恒容,因此压强不影响反应速率,所以在本题中只考虑温度和浓度的影响,结合图象可知反应速率先增大再减小,因为只要开始反应,反应物浓度就要降低,反应速率应该降低,但此时正反应速率却是增大的,说明此时温度是影响反应的主要因素,由于容器是绝热的,因此只能是放热反应,从而导致容器内温度升高,反应速率加快。
【详解】A. a到c时反应物浓度随时间不断减小,起始时反应物浓度最大,所以反应物浓度:a点大于c点,故A错误;
B. 由上述分析可知,该反应的正反应为放热反应,故B正确;
C. 化学平衡状态的标志是各物质的浓度不再改变,其实质是正反应速率等于逆反应速率,c点对应的正反应速率显然还在改变,故c点一定未达到平衡状态,故C错误;
D. 据图可知,随着反应的进行,正反应速率增大,生成氢气的产率逐渐增大,△t1=△t2时,H2的产率:a~b段小于b~c段,故D错误,答案选B。
【点睛】本题考查化学反应速率和平衡图象,解题时要注意该反应的特点及反应限制条件,尤其要特别关注“绝热恒容密闭容器”这句话表达的含义,再结合图象中曲线变化的趋势判断反应为放热反应,为本题的难点也是易错点。
16.2SO2(g)+O2(g)2SO3
- 24 -
(g)ΔH<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,充分反应达到平衡,下列说法正确的是
A. 乙中SO3的体积分数大于丙
B. 转化率:α甲(SO2)+α乙(SO3)=1
C. 乙和丙中的SO2的生成速率相同
D. 甲和丙中反应的化学平衡常数相同
【答案】A
【解析】
【详解】A. 乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,随反应进行气体体积增大,达到平衡时乙中压强大于丙中压强,相对于丙,乙相当于增大压强,平衡正向移动,三氧化硫体积分数增大,所以乙中SO3的体积分数大于丙,故A正确;
B. 假设甲容器恒温恒容,充入6molSO2和3molO2,乙容器恒温恒容,充入6molSO3,两容器等效,甲和乙将达到相同的平衡状态,转化率:α甲(SO2)+α乙(SO3)=1,但甲容器是绝热容器,且该反应是放热反应,温度升高平衡逆向进行,则甲中二氧化硫转化率减小,α甲(SO2)+α乙(SO3)<1,故B错误;
C. 乙容器恒温恒容,充入6molSO3,丙容器恒温恒压,充入6molSO3,随反应进行气体体积增大,达到平衡时乙中压强大于丙中压强,相对于丙,乙相当于增大压强,压强越大,反应速率越快,则乙中SO2的生成速率大于丙,故C错误;
D. 该反应为放热反应,甲是绝热恒容,充入6molSO2和3molO2生成SO3放出热量,丙是恒温恒压,容器温度始终不变,所以甲容器中温度高于丙,因平衡常数随温度变化,所以甲和丙中化学平衡常数不同,故D错误,答案选A。
17.已知一定温度下,X(g)+2Y(g)mZ(g);ΔH=-akJ/mol(a>0)现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A. a=b B. 2a<c C. m>3 D. m<3
【答案】D
【解析】
【详解】X(g)+2Y(g)mZ(g) ΔH
- 24 -
=-akJ/mol(a>0),该反应为放热反应。现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达平衡状态时,放出热量ckJ,且2b<c。假设原容器的体积为1L,现在重新取一个2L的容器,在相同的温度下向其中通入2molX和4molY,则在该容器中达到平衡时与甲容器是等效的,因为此容器中的投料是甲的2倍,故该容器中反应放出的热量为2bkJ,在此基础上,增大压强将容器的体积压缩到1L,等重新建立平衡状态后,与容器乙的平衡等效,则此容器中共放出的热量为ckJ,因为正反应为放热反应,且2b<c,说明加压后平衡向正反应方向移动,则正反应为气体分子数减少的方向,故m<3,即D关系正确,故选D。
【点睛】本题利用建模的方法,选建立一个与甲等效的平衡,然后通过加压转化为与乙等效,分析加压对化学平衡的影响,从而确定平衡移动的方向和相关化学计量数的关系。
18.甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应的CO的转化率与CH3OH的转化率相同
【答案】C
【解析】
A. 70~80℃,反应未达到平衡,升高温度反应速率增大,相同时间内,表现为CO转化率随温度升高而增大,故A正确;B. 85~90℃反应达到了平衡,该反应是放热反应,升高温度,平衡逆向移动,CO转化率降低,故B正确;C.
- 24 -
该反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,d点的平衡常数>e点的平衡常数,故C错误;D.根据方程式,与方程式中的化学计量数之比相等,因此a点对应的CO的转化率与CH3OH的转化率相同,故D正确;故选C。
19.化学电源在生产生活中有着广泛的应用,电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
(1)写出放电时负极的电极反应式:______________________________;
(2)铅蓄电池放电时,溶液的pH将_________(填“增大”、“减小”或“不变”)。当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为___________。
(3)放电完后,对该电池进行充电,在连接电源的负极一端生成________。(填“Pb”或“PbO2”)
【答案】 (1). Pb-2e-+SO42-=PbSO4 (2). 增大 (3). 0.5mol (4). Pb
【解析】
【分析】
由放电时总反应Pb+PbO2+2H2SO4=2PbSO4+2H2O可知,Pb为负极,PbO2为正极。
【详解】(1)放电时负极Pb失去电子发生氧化反应,电极反应式为Pb-2e-+SO42-=PbSO4;
(2)铅蓄电池放电时,发生反应Pb+PbO2+2H2SO4=2PbSO4+2H2O,硫酸的浓度减小,故溶液的pH将增大。从电池总反应分析,该反应中电子转移的物质的量与参加反应的硫酸的物质的量相等,因此,当外电路上有0.5mol电子通过时,溶液中消耗H2SO4的物质的量为0.5mol。
(3)放电完后,对该电池进行充电,连接电源的负极一端是阴极,阴极发生还原反应,PbSO4被还原为Pb。
【点睛】根据电池的总反应进行分析,还原剂在负极发生氧化反应,氧化剂在正极发生还原反应。
20.在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃
700
800
850
1000
1200
K
2.6
1.7
1.0
0.9
0.6
- 24 -
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO
H2O
CO2
H2
0.5mol
8.5mol
2.0mol
2.0mol
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
【答案】 (1). (2). 放热 (3). B、D (4). B (5). 不变 (6). 压强增大使水蒸气液化,平衡向右移动 (7). 8V2(mol·L-1)-2 (8). 平衡向逆反应方向移动
【解析】
【分析】
- 24 -
根据平衡常数随温度的变化规律分析反应的热效应,根据化学平衡状态的特征分析达到化学平衡状态的标志,根据平衡移动原理分析化学平衡影响化学平衡移动的因素,根据浓度商与平衡常数的关系分析平衡移动的方向。
【详解】(1)根据化学平衡常数的定义,可以写出该反应的K的表达式为;
(2)由表中数据可知,该反应的平衡常数随着温度的升高而减小,说明升高温度后化学平衡向逆反应方向移动,故该反应的正反应为放热反应;
(3)A.该反应在建立化学平衡的过程中,气体的分子数不发生变化,故容器内的压强也保持不变,因此,无法根据容器中压强不再变化判断该反应是否达到平衡;
B.混合气体中CO浓度不再变化,说明正反应速率等于逆反应速率,该反应达到化学平衡状态;
C.由于容器的体积和混合气体的质量在反应过程中均保持不变,故混合气体的密度一直保持不变,因此,无法根据混合气体的密度不再变化判断该反应是否到达化学平衡状态;
D.由表中数据可知,该反应在850℃时K=1,当c(CO2)=c(CO)=c(H2)=c(H2O) 时,=1=K,故可以据此判断该反应到达化学平衡状态。
综上所述,可以作为该反应在850℃时已经达到化学平衡状态的标志的是B、D。
(4)当温度为850℃,由于反应前后气体的分子数不变,故可以根据某时刻该温度下的密闭容器中各物质的物质的量的数据求出Qc==>1(该温度下的平衡常数),因此,此时上述的反应正在向逆反应方向进行,故v(正)<v(逆),选B。
(5)在700℃通过压缩体积增大气体压强,由于反应前后气体的分子数不变,则该化学平衡不移动,故H2(g)的转化率不变;工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,根据平衡移动原理分析,其可能原因是:压强增大使水蒸气液化,正反应成为气体分子数减少的方向,故化学平衡向右移动。
Ⅱ. (6)在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。设氮气的变化量为x mol,则氢气和氨气的变化量分别为3x和2x,,解之得x=2,则N2(g)、H2(g)、NH3
- 24 -
(g)的平衡量分别为8mol、4mol、4mol。由于该条件下每1mol气体所占的体积为VL,则在平衡状态下,气体的总体积为16VL,故该条件下该反应的平衡常数为8V2(mol·L-1)-2。上述反应平衡时,再充入10mol的N2,则容器的体积变为26VL,此时,Qc=9.4V2(mol·L-1)-2>K,故平衡向逆反应方向移动。
21.某课外小组分别用如图所示装置对原电池和电解池原理进行实验探究。
请回答:
Ⅰ.用图1所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是____(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为___。
(3)实验过程中,SO42-___(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有___。
Ⅱ.用图2所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH___(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O、___。
- 24 -
(6)若在X极收集到672mL气体,在Y极收集到168mL气体(均已折算为标准状况下的气体体积),则Y电极(铁电极)质量减少___g。
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为___。
【答案】 (1). A (2). 2H++2e-=H2↑ (3). 从右向左 (4). 滤纸上M极附近有红褐色斑点产生 (5). 增大 (6). 4OH--4e-=2H2O+O2↑ (7). 0.28 (8). 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】
【分析】
图1装置左侧是原电池,发生的电极反应式,锌电极:,铜电极: ;右侧为电解池,电解液为溶液, 电极为阳极,电极反应式为: , 电极为阴极,电极反应式为:;图2装置电极为阳极,电极反应式为:Fe-6e-+8OH-=FeO42-+4H2O、4OH--4e-=2H2O+O2↑, 电极为阴极,电极反应式为:。
【详解】I.(1)电极反应不变的情况下,只有在金属活动顺序表中活泼性低于铜才可以替代Cu作电极,只有铝的活泼性大于铜,因此选铝;
(2)电极为阴极,考虑阳离子的放电顺序,该环境中阳离子为 ,根据放电顺序, 发生反应,电极反应式为: ;
(3) 在溶液中从正极移向负极,所以从右向左移动;电极为阳极,电极反应式为:, ,被氧化成 ,所以可以看到,在电极附近有红褐色斑点产生;
故答案为:A;2H++2e-=H2↑;从右向左;滤纸上M极附近有红褐色斑点产生;
II.(4) 图2装置中X极为阴极,电极反应式为:,消耗氢离子,所以X极区溶液的pH增大;
(5)Y极为阳极,碱性环境溶液不浑浊,则Fe-6e-+8OH-=FeO42-+4H2O,且(6)中涉及到Y极有气体产生,所以溶液中的阴离子OH-也会放电,发生电极反应:4OH--4e-=2H2O+O2↑;
- 24 -
(6)X极的气体,Y极气体,X极得到电子,Y极生成气体失去,则铁失去电子,则铁的质量减少;
(7)在碱性锌电池中,用高铁酸钾作为正极材料,电池总反应:2K2FeO4+3Zn=Fe2O3+ZnO+2K2ZnO2,根据氧化还原反应特点,该电池正极发生还原反应:2FeO42-+6e-+5H2O=Fe2O3+10OH-;
故答案为:增大;4OH--4e-=2H2O+O2↑;0.28;2FeO42-+6e-+5H2O=Fe2O3+10OH-。
【点睛】灵活根据题前题后信息解题,(5)需要根据已知信息及(6)中涉及到Y极有气体产生来分析电极反应,在计算中要巧用关系式解题,简单又快捷。
22.研究+6价铬盐不同条件下微粒存形式及氧化性,某小组同学进行如下实验:
已知:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+△H=+13.8kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是_____________________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?__________(“是”或“否”),理由是____________________________________________________。
(3)对比试管a、b、c的实验现象,可知pH增大_____(选填“增大”,“减小”,“不变”);
(4)分析如图试管c继续滴加KI溶液、过量稀H2SO4的实验现象,说明+6价铬盐氧化性强弱为Cr2O72-__________CrO42-
- 24 -
(填“大于”,“小于”,“不确定”);写出此过程中氧化还原反应的离子方程式_________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验
ⅰ
ⅱ
ⅲ
ⅳ
是否加入Fe2(SO4)3
否
否
加入5g
否
是否加入H2SO4
否
加入1mL
加入1mL
加入1mL
电极材料
阴、阳极均为石墨
阴、阳极均为石墨
阴、阳极均为石墨
阴极为石墨,阳极为铁
Cr2O72-的去除率/%
0.922
12.7
20.8
57.3
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。
【答案】 (1). 溶液变黄色 (2). 否 (3). Cr2O72-(橙色)+H2OCrO42-(黄色)+2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果 (4). 减小 (5). 大于 (6). Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O (7). Cr2O72-+6e-+14H+=2Cr3++7H2O (8). 阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率
【解析】
【分析】
- 24 -
根据平衡移动原理分析对比实验;注意从图中找出关键信息。
【详解】(1)由Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+及平衡移动原理可知,向重铬酸钾溶液中加入氢氧化钠溶液后,可以减小溶液中的氢离子浓度,使上述平衡向正反应方向移动,因此,试管c和b(只加水,对比加水稀释引起的颜色变化)对比,试管c的现象是:溶液变为黄色。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。我认为不需要再设计实验证明,故填否。理由是:Cr2O72-(橙色)+H2OCrO42-(黄色)+2H+正向是吸热反应,浓H2SO4溶于水会放出大量的热量而使溶液的温度升高,上述平衡将正向移动,溶液会变为黄色。但是,实际的实验现象是溶液的橙色加深,说明上述平衡是向逆反应方向移动的,橙色加深只能是因为增大了c(H+)的结果。
(3)对比试管a、b、c的实验现象,可知随着溶液的pH增大,上述平衡向正反应方向移动,减小,而 增大,故减小。
(4)向试管c继续滴加KI溶液,溶液的颜色没有明显变化,但是,加入过量稀H2SO4后,溶液变为墨绿色,增大氢离子浓度,上述平衡向逆反应方向移动,CrO42-转化为Cr2O72-,Cr2O72-可以在酸性条件下将I-氧化,而在碱性条件下,CrO42-不能将I-氧化,说明+6价铬盐氧化性强弱为:Cr2O72-大于CrO42-;此过程中发生的氧化还原反应的离子方程式是Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O。
(5)①实验ⅱ中,Cr2O72-在阴极上放电被还原为Cr3+,硫酸提供了酸性环境,其电极反应式是Cr2O72-+6e-+14H+=2Cr3++7H2O。
②由实验ⅲ中Fe3+去除Cr2O72-的机理示意图可知,加入Fe2(SO4)3溶于水电离出Fe3+,在直流电的作用下,阳离子向阴极定向移动,故Fe3+更易在阴极上得到电子被还原为Fe2+,Fe2+在酸性条件下把Cr2O72-还原为Cr3+。如此循环往复,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率。由此可知,实验iv中Cr2O72-去除率提高较多的原因是:阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,故在阴阳两极附近均在大量的Fe2+,Fe2+循环利用提高了Cr2O72-的去除率。
【点睛】本题中有很多解题的关键信息是以图片给出的,要求我们要有较强的读图能力,能从图中找出解题所需要的关键信息,并加以适当处理,结合所学的知识解决新问题。
- 24 -
- 24 -
- 24 -
相关文档
- 【化学】辽宁省葫芦岛市第八高级中2021-07-0813页
- 【化学】江苏省大丰市新丰中学20192021-07-0812页
- 【化学】陕西省吴起高级中学2019-22021-07-0814页
- 【化学】江苏省南京师范大学苏州实2021-07-0815页
- 【化学】黑龙江省牡丹江市第三高级2021-07-0815页
- 【化学】甘肃省临夏中学2019-20202021-07-0821页
- 【化学】江苏省苏州市张家港高级中2021-07-0817页
- 【化学】云南省河口县第一中学20192021-07-0810页
- 【化学】河北省武邑中学2019-20202021-07-0819页
- 江西省新余市八校2019-2020学年高2021-07-0822页