- 2.12 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专题五 微观结构与物质的多样性
第十三单元 原子结构
考试说明
1.了解元素、核素和同位素的含义。
2.了解原子的构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.了解原子核外电子排布规律。掌握原子结构示意图表示方法。
【考点互动探究】
考点一 原子结构 核素 同位素
知识梳理
1.原子的构成
原子
2.原子结构及离子结构中各种微粒间的关系
(1)原子内的等量关系
①质子数=________________=______________。
②质量数=________+________。
(2)离子内的等量关系
①阳离子的核外电子数=质子数________电荷数。
②阴离子的核外电子数=质子数________电荷数。
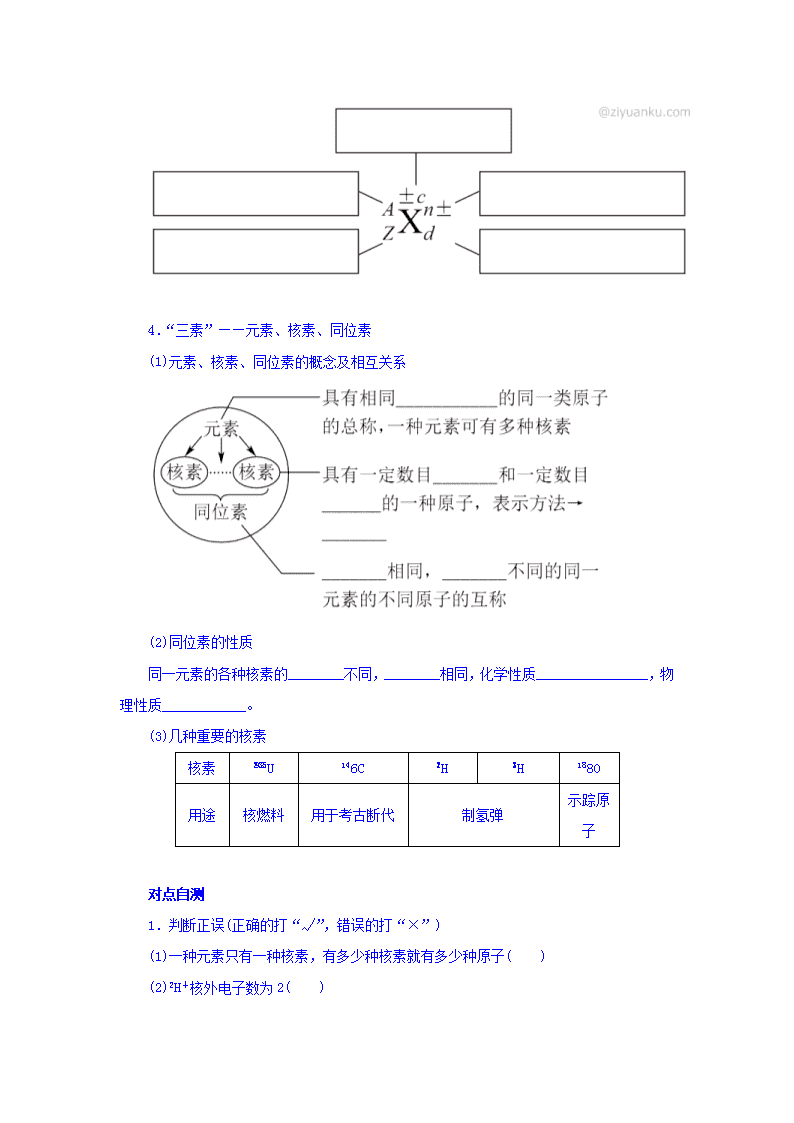
3.微粒符号周围数字的含义
4.“三素”——元素、核素、同位素
(1)元素、核素、同位素的概念及相互关系
(2)同位素的性质
同一元素的各种核素的________不同,________相同,化学性质________________,物理性质____________。
(3)几种重要的核素
核素
U
6C
H
H
8O
用途
核燃料
用于考古断代
制氢弹
示踪原子
对点自测
1.判断正误(正确的打“√”,错误的打“×”)
(1)一种元素只有一种核素,有多少种核素就有多少种原子( )
(2)2H+核外电子数为2( )
(3)质子数为35、中子数为45的溴原子:Br( )
(4)12C和14N核内中子数相差2( )
(5)【2015·海南卷】等物质的量的水与重水含有的中子数相同( )
(6) 16O与18O间的相互转化为化学变化( )
(7)1HO的摩尔质量为 20 g·mol-1( )
(8)2.0 g HO与D2O的混合物中所含中子总数为NA( )
2.(1)18O中的质子数为________,中子数为________。
(2)I中的中子数与质子数之差为________。
(3)一个D3O+中的质子数为________,电子数为_____________,中子数为________。
(4)一个CO中的质子数为________,电子数为________________。
题组训练
题组一 “三素”“四量”概念辨析
1.美国夏威夷联合天文中心的科学家发现了新的氢微粒,该微粒是由3个氢原子核(只含质子)和2个电子构成的,关于这种微粒的下列说法中正确的是( )
A.是氢元素的一种新的同素异形体
B.是氢元素的一种新的同位素
C.该微粒比普通氢分子多一个氢原子核
D.该微粒的组成可用H3表示
2.某元素(X)构成的双原子单质分子有三种,其相对分子质量分别为158、160、162,在天然单质中,这三种单质的物质的量之比为1∶1∶1,由此推断以下结论正确的是( )
A.此元素有3种不同的同位素
B.其中一种同位素质量数为80
C.其同位素79X占原子总数的
D.单质X2的平均相对分子质量为162
3.现有下列9种微粒:H、H、C、C、N、Fe2+、Fe3+、O2、O3。按要求完成以下各题:
(1)H、H、H分别是氢元素不同核素,它们互称为________。
(2)互为同素异形体的微粒是____________。
(3)对于X,按下列要求各举一例(
每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):
①Z、n、b相同而A不同: __________________________________________________;
②A、n、b相同而Z不同: __________________________________________________;
③A、Z、b相同而n不同: __________________________________________________;
④Z、n、A相同而b不同: _________________________________________________。
规律小结 “四量”的比较
原子质量
原子的相对原子质量
元素的相对原子质量
原子的质量数
定义
指某元素的某种核素的一个原子的真实质量
一个原子的真实质量与一个C 原子质量的的比值
该元素各种核素的相对原子质量与其在自然界中所占原子个数百分比的乘积之和
一个原子的质子数与中子数的和
实例
一个O原子的质量是2.657×10-26 kg
O的相对原子质量约为16
Ar=Ar1·a%+Ar2·b%+…(其中a%+b%+…=1)
O的质量数为16
题组二 粒子中微粒数的确定
1.下列各项中的两个分子核外电子总数不同的是( )
A.H2O2和CH3OH B.HNO2和HClO
C.H2O和CH4 D.HCl和F2
2.假设R元素无同位素,其原子的质量数为A,Rm-的核外电子数为x,则W g Rm-所含中子的物质的量为( )
A.(A-x+m) mol B.(A-x-m) mol
C.(A-x+m) mol D.(A-x-m) mol
规律小结 求一定质量的某物质中微粒数的答题模板
考点二 原子核外电子排布
知识梳理
1.核外电子排布规律
2.原子结构示意图
对点自测
1.判断正误(正确的打“√”,错误的打“×”)
(1)硫离子的结构示意图: ( )
(2)最外层电子数为8的粒子一定是稀有气体元素原子( )
(3)非金属元素原子的核外电子数一般大于或等于4( )
(4)核外电子首先占据能量较高的电子层( )
(5)某原子M层上电子数为L层上电子数的4倍( )
(6)核外电子排布相同的微粒化学性质也相同( )
(7)NH与Na+的质子数与电子数均相同( )
(8)16O和18O是氧元素的两种核素,16O与18O核外电子排布方式不同( )
2.六种粒子的结构示意图分别为
请回答下列问题:
(1)依次写出6种粒子的符号: ____________________________________________。
(2)A、B、C、D、E、F共表示________种元素、________种原子、________种阳离子、________种阴离子。
(3)上述微粒中,阴离子与阳离子可构成两种化合物,这两种化合物的化学式为____________。
题组训练
题组一 核外电子排布的规律
1.在第n电子层中,当它作为原子的最外层时,容纳电子数最多与(n-1)层相同;当它作为原子的次外层时,其最多容纳的电子数比(n-1)层最多容纳的电子数多10个,则此电子层是( )
A.K层 B.L层 C.M层 D.N层
2.【2016·潍坊高三模拟】下列叙述中,正确的是( )
A.两种粒子,若核外电子排布相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元素
D.阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
3.【2016·荆州统考】核电荷数小于18的某元素X,其原子核外电子层数为a,最外层电子数为(2a+1)。下列有关元素X的说法中不正确的是( )
A.元素X的原子核内质子数为(2a2-1)
B.元素X的原子半径一定小于Na的原子半径
C.由元素X形成的某些化合物,可能具有杀菌消毒的作用
D.元素X形成的简单离子,各电子层的电子数均达到2n2(n表示电子层数)
规律小结 短周期元素原子的特征电子排布
(1)原子核中无中子的原子:H。
(2)最外层有1个电子的元素:H、Li、Na。
(3)最外层有2个电子的元素:Be、Mg、He。
(4)最外层电子数等于次外层电子数的元素:Be、Ar。
(5)最外层电子数是次外层电子数2倍的元素:C;是次外层3倍的元素:O;是次外层4倍的元素:Ne。
(6)电子层数与最外层电子数相等的元素:H、Be、Al。
(7)次外层电子数是最外层电子数2倍的元素:Li、Si。
题组二 8电子结构的判断
1.下列物质中所有原子均满足最外层8电子稳定结构的化合物是( )
A.PCl5B.P4
C.CCl4 D.NH3
2.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
A.CH4 B.CH2===CH2
C.CO2 D.N2
3.已知OCN-中的每一种元素都满足8电子稳定结构,则下列说法正确的是( )
A.C的化合价为-4
B.O的化合价为+2
C.N的化合价为+3
D.N的化合价为-3
方法技巧 8电子结构的判断方法
(1)经验规律法:凡符合最外层电子数+|化合价|=8的皆为8电子结构。
(2)试写结构法:判断某化合物中的某元素最外层是否达到8电子稳定结构,应从其结构式或电子式结合原子最外层电子数进行判断,如:
①H2O中O最外层达到8电子稳定结构,而H最外层达到2电子稳定结构;
②N最外层有5个电子,N2中N与N之间形成3个共价键,所以N2中的N最外层达到8电子稳定结构。
题组三 常见电子数相同的微粒
1.下列各组中两种微粒所含电子数不相等的是( )
A.H3O+和OH-
B.CO与N2
C.HNO2和NO
D.CH和NH
2.具有双核10个电子的共价化合物分子的电子式是____________________________;
四核10个电子的共价化合物分子的化学式是__________________________________;
以上两种化合物的热稳定性由小到大的顺序是___________________________________。
3.通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀。
请回答:
(1)用化学符号表示下列4种微粒:
A:____________;B:____________;C:____________;D:____________。
(2)写出A、B、E三种微粒反应的离子方程式:________________________________________________________________________________。
方法技巧 10电子和18电子微粒的思维模板
(1)10电子微粒:以Ne为核心,推断同周期的非金属元素形成的微粒和下一周期的金属元素形成的微粒。
(2)18电子微粒:以Ar
为核心,推断同周期的非金属元素形成的微粒和下一周期的金属元素形成的微粒。
【考例考法直击】
1.【2016·江苏卷】下列有关化学用语表示正确的是( )
A.中子数为10的氧原子: O
B.Mg2+的结构示意图:
C.硫化钠的电子式:
D.甲酸甲酯的结构简式: C2H4O2
2.【2015·上海卷】中国科学技术名词审定委员会已确定第116号元素Lv的名称为。关于Lv的叙述错误的是( )
A.原子序数116 B.中子数177
C.核外电子数116 D.相对原子质量293
3.【2015·全国卷Ⅱ】原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是( )
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a、b、c各自最高和最低化合价的代数和分别为0、4、6
4.【2015·全国卷】ⅠW、X、Y、Z均为短周期主族元素,原子序数依次增加,且原子核外L电子层的电子数分别为0、5、8、8,它们的最外层电子数之和为18。下列说法正确的是( )
A.单质的沸点:W>X
B.阴离子的还原性:W>Z
C.氧化物的水化物的酸性:YY>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
3.【2016·河南三门峡联考】电子层数相同的短周期元素X、Y、Z、W,其中X的最外层电子数比K层少1,Y的最外层电子数比K层多l,Z的单质是一种半导体材料,常用于制造太阳能电池,W的原子半径是同周期中最小的。下列推断中正确的是( )
A.Z的气态氢化物的热稳定性强于W的气态氢化物
B.Z的氧化物与水反应可制得相应的含氧酸
C.X、Y、W的原子半径依次减小,对应的离子半径依次增大
D.X、Y、W的最高价氧化物对应水化物之间互相都能发生反应
易错警示
(1)含元素种数最多的周期是第六、七周期,分别有32种元素;含元素种类最多的族是ⅢB族,共有32种元素。
(2)过渡元素包括7个副族和Ⅷ族,全部都是金属元素,原子最外层电子数一般不超过2。(3)最外层电子数为3~7的原子一定属于主族元素原子,且最外层电子数即为主族的族
序数。
(4)同一周期ⅡA族与ⅢA族的原子序数可能相差1(二、三周期)或11(四、五周期)或
25(六、七周期)。
(5)一般情况下,主族的族序数=最外层电子数=最高正价=8-|最低负价|。
题组二 片断式周期表在元素推断题中的应用
1.【2016·金华十校联考】短周期元素A、B、C,在周期表中所处的位置如图5141所示,A、B、C三种元素原子质子数之和为32。D元素原子的最外层电子数为其次外层电子数的2倍。则下列说法正确的是( )
图5141
A.A、B两种元素的气态氢化物均能与它们的最高价氧化物对应的水化物发生反应,且反应类型相同
B.B的气态氢化物比C的气态氢化物稳定
C.元素D与氢元素形成的气态化合物一定是正四面体型分子
D.元素的原子半径:D>A>C
2.【2016·福建安溪一中期中】短周期元素R、T、Q、W在元素周期表中的相对位置如图5142所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
图5142
A.最简单气态氢化物的热稳定性:R>Q
B.最高价氧化物对应水化物的酸性:QQ>R
D.含T的盐溶液一定显酸性
3.【016·南京模拟】短周期元素X、Y、Z在元素周期表中的位置如图5143所示,下列说法正确的是( )
图5143
A.X、Y、Z三种元素中,X的非金属性最强
B.X的单质的熔点比Z的低
C.Y的最高正化合价为+7
D.Y的气态氢化物的稳定性比Z的气态氢化物的稳定性弱
考点二 元素周期律
知识梳理
1.定义及实质
元素的性质随________的递增而呈________变化的规律。实质是元素原子________________呈周期性变化的结果。
2.具体表现形式(不考虑稀有气体元素)
对点自测
1.判断正误(正确的打“√”,错误的打“×”)
(1)Cl-、S2-、Ca2+、K+半径逐渐减小( )
(2)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(3)离子所带的电荷越多,它的氧化性就一定越强( )
(4)电子层结构相同的粒子化学性质一定相同( )
(5)同一周期元素的原子,半径越小越容易失电子( )
(6)电子层结构相同的离子,其半径随原子序数递增而增大( )
(7)硫与硒(Se)同主族,硒(Se)的最高价氧化物对应水化物的酸性比硫酸弱( )
2.若A、B、C三种主族元素位于元素周期表中如图5144所示位置,则有关的各种性质均可排出顺序(D不能参与排列)。
图5144
(1)原子半径:____________。
(2)金属性:____________。
(3)非金属性:____________。
题组训练
题组一 粒子半径大小比较
1.【2015·海南卷】下列离子中半径最大的是( )
A.Na+ B.Mg2+
C.O2- D.F-
2.下列粒子半径大小的比较正确的是( )
A.Na+<Mg2+<Al3+<O2-
B.S2->Cl->Na+>Al3+
C.Na<Mg<Al<S
D.Cs<Rb<K<Na
3.图5145表示一些元素原子半径规律性的变化示意图。由此图不能得出下列结论的是(不考虑稀有气体元素)( )
A.当电子层数相同时,核电荷数越小,原子半径越大
B.当最外层电子数相同时,质子数越多,原子半径越大
C.原子半径最小的是H,原子半径最大的是Fr
D.原子电子层数越多,对应的原子半径越大
图5145
规律小结 微粒半径大小的比较
(1)同一周期主族元素,原子序数越大,原子半径越小。例如:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)。
(2)同一主族元素原子,电子层数越多,原子半径越大。例如:r(I)>r(Br)>r(Cl)>r(F)。
(3)不同周期、不同主族元素的原子,原子半径可根据同主族与同周期原子半径的比较规律解决。例如:比较r(K)与r(Mg),可利用同主族r(K)>r(Na),然后利用同周期r(Na)>r(Mg)可得出r(K)>r(Mg)。
(4)同种元素的粒子,电子数越多,半径越大。例如:r(Cl-)>r(Cl);r(Fe)>r(Fe2+)>r(Fe3+)。
(5)电子层结构相同的离子,核电荷数越大,半径越小。例如:r(O2-)>r(F-)>r(Na+)>
r(Mg2+)>r(Al3+)。
(6)同主族元素的离子,电子层数越多,半径越大。例如:r(K+)>r(Na+)>r(Li+);r(S2-)>
r(O2-)。
(7)所带电荷、电子层数都不相同的离子,可选一种离子参照比较。例如:比较r(K+)与r(Mg2+)的大小,可选 r(Na+)作参照:r(K+)>r(Na+),r(Na+)>r(Mg2+),故r(K+)>r(Mg2+)。
题组二 金属性、非金属性强弱的比较和应用
1.【2016·赤峰一中模拟】下列说法正确的是( )
A.SiH4比CH4稳定
B.O2-半径比F-小
C.Na和Cs属于ⅠA族元素,Cs失电子能力比Na强
D.P和As属于ⅤA族元素,H3PO4酸性比H3AsO4弱
2.【2016·荆门三校联考】下列实验不能达到实验目的的是( )
序号
实验操作
实验目的
A
Cl2、Br2分别与H2反应
比较氯、溴元素的非金属性强弱
B
向MgCl2、AlCl3溶液中分别通入氨气
比较镁、铝元素的金属性强弱
C
测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH
比较碳、硫元素的非金属性强弱
D
Fe、Cu分别与稀盐酸反应
比较铁、铜元素的金属性强弱
规律小结 金属性和非金属性强弱的判断方法
三
表
元素周期表
金属性“右弱左强,上弱下强,右上弱左下强”;非金属性“左弱右强,下弱上强,左下弱右上强”
金属活动性
顺序表
按K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au的顺序,金属性减弱
非金属活动
性顺序表
按F O Cl Br I 非金属性逐渐减弱
三
反
应
置换反应
强的置换弱的,适合金属也适合非金属
与水或
酸反应
越剧烈,或最高价氧化物对应水化物的碱性越强,则金属性越强
与氢气
反应
越容易,生成的气态氢化物的稳定性越强,或最高价氧化物对应的水化物的酸性越强,则非金属性越强
两
池
原电池
一般负极材料的金属性强于正极
电解质
在阳极首先放电的阴离子,其对应元素的非金属性弱;在阴极首先放电的阳离子,其对应元素的金属性弱
题组三 元素周期表和元素周期律的综合应用
1.X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图5146所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
图5146
A.X的最常见气态氢化物的水溶液显酸性
B.最高价氧化物对应水化物的酸性W比Z强
C.Z的单质与氢气反应比Y单质与氢气反应剧烈
D.X的原子半径小于Y
2.【2016·潍坊模拟】下列根据元素周期表和元素周期律得出的推断中正确的是( )
A.金属元素原子最外层电子数越少,该金属失电子能力越强
B.若存在简单阴离子R2-,则R一定位于ⅥA族
C.aA2+、bB+、cC3-三种离子具有相同的电子层结构,则原子序数c>a>b
D.铅位于周期表中金属和非金属的交界处,可作半导体材料
规律小结
(1)元素推断题的一般模式:
分析题中条件→元素的位置→
(2)同一元素的“位、构、性”思考模型
【考例考法直击】
1.【2016·上海卷】已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是( )
A.原子半径:X>Y>Z>W
B.W的含氧酸的酸性比Z的含氧酸的酸性强
C.W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D.若W与X原子序数差为5,则形成化合物的化学式为X3W2
2.【2016·全国卷Ⅰ】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L-1r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图5147所示。
图5147
下列说法正确的是( )
A.原子半径的大小WX>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
3.【2015·北京卷】下列有关性质的比较,不能用元素周期律解释的是( )
A.酸性:H2SO4>H3PO4
B.非金属性:Cl>Br
C.碱性:NaOH>Mg(OH)2
D.热稳定性:Na2CO3>NaHCO3
4.【2015·上海卷】不能作为判断硫、氯两种元素非金属性强弱的依据是( )
A.单质氧化性的强弱
B.单质沸点的高低
C.单质与氢气化合的难易
D.最高价氧化物对应的水化物酸性的强弱
5.【2015·福建卷】短周期元素X、Y、Z、W在元素周期表中的相对位置如图5148所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
图5148
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
第十五单元 微粒之间的作用力及其物质的多样性
考试说明
1.了解化学键的定义。了解离子键、共价键的形成。
2.掌握电子式、分子式、结构式和结构简式等表示方法。
【考点互动探究】
考点一 化学键
知识梳理
1.化学键
(1)概念:使_____________________________________________________的强烈作用力。
(2)分类
图5151
2.离子键与共价键的比较
化学键
离子键
共价键
极性键
非极性键
概念
带________离子之间的相互作用
________间通过________形成的相互作用
形成条件
________元素与___________元素形成
________元素与________元素形成
成键粒子
________
________
________
成键实质
________间的静电作用
________与________间的静电作用
构成的物质
________化合物
________
________
3.离子化合物与共价化合物
项目
离子化合物
共价化合物
定义
含有________的化合物
只含有________的化合物
构成微粒
________
________
化学键类型
一定含有________,可能含有________
只含有________
物质类别
①强碱
②绝大多数盐
③金属氧化物
①含氧酸
②弱碱
③气态氢化物
④非金属氧化物
⑤极少数盐,如AlCl3
对点自测
1.判断正误(正确的打“√”,错误的打“×”)
(1)形成离子键的阴、阳离子间只存在静电吸引力( )
(2)非金属元素组成的化合物中只含共价键( )
(3)某些金属与非金属原子间能形成共价键( )
(4)原子最外层只有一个电子的元素跟卤素结合时,所形成的化学键一定是离子键( )
(5)所有的物质中均含化学键,因此有化学键断裂的一定是化学变化( )
2.有以下9种物质,请用物质的序号填空:
①Ne ②HCl ③P4 ④H2O2 ⑤Na2S ⑥NaOH⑦Na2O2 ⑧NH4Cl ⑨AlCl3
(1)不存在化学键的是____________。
(2)只存在共价键的是____________。
(3)只存在离子键的是____________。
(4)既存在离子键又存在共价键的是____________。
(5)属于离子化合物的是____________,属于共价化合物的是____________。
题组训练
题组一 化学键的判断
1.【2016·长春一中月考】下列说法正确的是( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.含有离子键的化合物一定是离子化合物
C.所有金属与所有非金属之间都能形成离子键
D.在化合物Na2O2中,阴、阳离子的个数比为1∶1
2.下列说法正确的是( )
A.非金属单质中一定存在共价键
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.含共价键的化合物不一定是共价化合物
D.溶于水能导电的化合物就是离子化合物
规律小结 物质中化学键的存在规律
题组二 共价化合物和离子化合物
1.【2016·中国人民大学附中一模】下列关于化学键与化合物的叙述正确的是( )
①离子化合物中一定含有金属元素 ②共价化合物中一定不含有金属元素 ③离子化合物中一定含有离子键 ④离子化合物中一定不含有共价键 ⑤离子化合物中可能含有共价键 ⑥共价化合物中可能含有离子键 ⑦共价化合物中一定不含有离子键
A.①⑤⑥⑦ B.②③④
C.③⑤⑦ D.②③⑥⑦
2.下列物质中含有相同的化学键类型的是( )
A.NaCl、HCl、H2O、NaOH
B.Cl2、Na2S、HCl、SO2
C.HBr、CO2、H2O、CS2
D.Na2O2、H2O2、H2O、O3
方法技巧 离子化合物和共价化合物的判断方法
(1)
根据化学键的类型判断:凡含有离子键的化合物,一定是离子化合物;只含有共价键的化合物,是共价化合物。
(2)根据化合物的类型来判断:大多数碱性氧化物、强碱和盐都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸都属于共价化合物。
(3)根据化合物的性质来判断:一般熔点、沸点较低的化合物是共价化合物;熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导电的化合物是共价化合物,如HCl。
考点二 电子式
知识梳理
1.微粒的电子式书写
概
念
在元素符号周围,用“·”或“×”来表示原子的最外层电子(价电子)的式子
书
写
粒子的
种类
电子式的
表示方法
注意事项
举例
原子
元素符号周围标有价电子
价电子少于4时以单电子分布,多于4时多出部分以电子对分布
H
阳离子
单核
离子符号
右上方标明电荷
Na+
多核
元素符号紧邻铺开,周围标清电子分布
用“”,并标明电荷
阴离子
单核
元素符号周围合理分布价电子及所得电子
用“”,右上方标明电荷
多核
元素符号紧邻铺开,合理分布价电子及所得电子
相同原子不得加和,用“”,右上方标明电荷
单质及化合物
离子
化合物
用阳离子电子式和阴离子电子式组成
同性不相邻,离子合理分布
单质
及共价化
原子不加和,无“”,不标明电荷
合物
各原子紧邻铺开,标明价电子及成键电子情况
2.结构式、结构简式
结构式就是把电子式中的共用电子对用短线表示,未成键电子省略不写,用短线“-”来表示1个共价键,用“—”(单键)、“”(双键)“”(三键)将所有原子连接起来,如等。
结构简式:①表示单键的“—”可以省略,将与碳原子相连的其他原子写在其旁边,在右下角注明其个数;②表示碳碳双键的“”、碳碳三键的“”不能省略;③醛基、羧基可简化成、,如。结构式或结构简式不能表示有机物的真实结构。如从结构简式看,中的碳链是直线形的,而实际上是锯齿形的。
对点自测
1.判断正误(正确的打“√”,错误的打“×”)
(1)形成离子键的阴、阳离子间只存在静电吸引力( )
(2)某些金属与非金属原子间能形成共价键( )
(3)某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键一定是离子键( )
(4)Na2S的电子式为 ( )
(5)Na2O的电子式为 ( )
(6)HClO的电子式为 ( )
(7)OH—的电子式为 ( )
(8)MgBr2的电子式为 ( )
(9)硫的原子结构示意图:( )
(10)中子数为20的氩原子:Ar( )
(11)乙烯的结构简式C2H4( )
(12)丙烷的分子结构球棍模型示意图:( )
2.写出下列微粒的电子式。
(1)Na______________,Cl______________。
(2)Na+____________,Cl-____________。
(3)NH____________,OH-____________。
(4)O2______________,N2______________,
CH4______________,NH3______________,
H2O______________,H2O2______________,
CO2______________。
(5)NH4Cl________________,NaOH____________,
MgO____________,MgCl2______________,
Na2O______________,Na2O2______________。
题组训练
1.下列对物质的结构组成表示正确的是( )
A.HClO的结构式为H—Cl—O
B.硫离子的结构示意图为
C.二氧化碳的电子式为
D.过氧化钠的电子式为
2.【2016·长沙高三模拟】下列表达方式正确的是( )
A.CS2的电子式为
B.MgCl2的电子式为
C.S2-的结构示意图为
D.中子数为20的氯原子为20Cl
3.下列化学用语正确的是( )
A.H2O的结构式:H—O—H
B.乙酸的分子式:CH3COOH
C.H2CO3的电离方程式:H2CO3===2H++CO
D.Al3+的原子结构示意图为
4.(1)【2016·全国卷Ⅱ】联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料。联氨分子的电子式为__________,其中氮的化合价为________。
(2)【2015·全国卷Ⅰ】硼氢化钠(NaBH4)是离子化合物,电子式为__________。
(3)【2015·浙江卷】H2O2的电子式为______________。N2的电子式为__________。
易错警示 电子式书写常见的六大误区
1.漏写未参与成键的电子,如N2误写为N⋮⋮N,应写为∶N⋮⋮N∶。
2.化合物类型不清楚,漏写或多写及错写电荷数,如NaCl误写为应写为;HF误写为,应写为。
3.书写不规范,错写共用电子对,如N2的电子式为∶N⋮⋮N∶,不能写成∶N∶∶∶N∶,更不能写成。
4.不考虑原子间的结合顺序,如HClO的电子式为。
5.不考虑原子最外层有几个电子,均写成8电子结构,如CH的电子式为。
6.不考虑AB2型离子化合物中2个B是分开写还是一起写。如CaBr2、CaC2
的电子式分别为。
考点三 化学键与物质的变化
知识梳理
1.化学反应的本质
图5152
2.物质的溶解或熔化与化学键变化的关系
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,________被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,发生电离,其分子内共价键被破坏,如______________等。
②有些共价化合物溶于水后,发生电离,其分子内的共价键被破坏,如__________等。
③某些共价化合物溶于水后,其分子内的化学键不被破坏,如________________等。
(3)单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的__________被破坏,如Cl2、F2等。
对点自测
判断正误(正确的打“√”,错误的打“×”)
(1)固体溶于水时,一定破坏了化学键( )
(2)气体溶于水时,化学键没有被破坏( )
(3)冷却蔗糖的饱和溶液析出晶体时有化学键的形成 ( )
(4)化学变化中有化学键的断裂,有化学键断裂的变化一定是化学变化( )
(5)加热碘固体时,碘分子间的化学键被破坏( )
(6)加热熔化NaCl固体时无新物质生成,化学键没有被破坏 ( )
题组训练
1.【2016·山东淄博六中期中】从化学键的观点看,化学反应的实质是“旧键的断裂与新键的形成”,据此你认为下列变化属于化学反应的是( )
A.对空气进行降温加压
B.金刚石变成石墨
C.NaCl熔化
D.碘溶于CCl4中
2.【2016·河北唐山一中模拟】在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将SO2通入水中
B.烧碱溶于水
C.将HCl通入水中
D.硫酸氢钠溶于水
3.【2016·湖北黄石高三调研】下列反应过程中,同时有离子键、极性键和非极性键的断裂和形成的反应是( )
A.NH4ClNH3↑+HCl↑
B.NH3+CO2+H2O,))NH4HCO3
C.2NaOH+Cl2,FNaCl+NaClO+H2O
D.2Na2O2+2CO2,F2Na2CO3+O2
易错警示 化学键断裂或形成与物质变化理解中的易错点
(1)化学变化中一定有化学键的断裂和形成。
(2)有化学键断裂或形成的变化不一定是化学变化。如NaCl熔化、HCl溶于水等,只有旧化学键的断裂没有新化学键的形成;从溶液中析出晶体时,无化学键的断裂但有化学键的形成,均未发生化学变化。
【考例考法直击】
1.【2016·上海卷】下列各组物质的熔点均与所含化学键的键能有关的是( )
A.CaO与CO2 B.NaCl与HCl
C.SiC与SiO2 D.Cl2与I2
2.【2016·全国卷Ⅲ】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X
的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是( )
A.简单离子半径:W< XZ
3.【2016·江苏卷】短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于ⅠA族,W与X属于同一主族。下列说法正确的是( )
A.元素X、W的简单阴离子具有相同的电子层结构
B.由Y、Z两种元素组成的化合物是离子化合物
C.W的简单气态氢化物的热稳定性比Y的强
D.原子半径:r(X)<r(Y)<r(Z)<r(W)
4.【2015·浙江卷】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。下列说法正确的是( )
X
Y
Z
W
T
A.X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C.YX2晶体熔化、液态WX3汽化均需克服分子间作用力
D.根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
5.【2015·海南卷】a、b、c、d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是( )
A.d元素的非金属性最强
B.它们均存在两种或两种以上的氧化物
C.只有a与其他元素生成的化合物都是离子化合物
D.b、c、d分别与氢形成的化合物中化学键均为极性共价键
专题提升五 位—构—性在元素推断题中的综合应用
考情剖析
元素推断题是综合考查物质结构、元素周期律、元素周期表、元素化合物性质的重要题型,该类题型具有综合性强、形式灵活、命题角度广等特点。主要以两类题型呈现。第一种题型:在选择题中结合原子结构、元素周期表、元素及化合物的知识考查元素推断,如2016年全国卷Ⅱ第9题,2016年全国卷Ⅲ第12题、2015年全国卷Ⅰ第12题、2015年全国卷Ⅱ第9题、2014年新课标全国卷Ⅰ第10题;第二种题型:在非选择题中结合元素周期表中“位、构、性”的关系及利用物质结构和性质综合考查,如2016年全国卷Ⅰ第13题。
【题型分类突破】
题型一 由微粒(原子或离子)结构、元素位置特征推断
【解题策略】 正确推断元素的常用方法
(1)根据原子或离子的结构示意图推断:
①由原子结构等确定元素在周期表中的位置和元素的种类:电子层数=周期数,最外层电子数=主族序数;如果已知离子的结构示意图,则将其转化为原子结构示意图来确定。
②电子层结构相同的微粒:阴离子对应的元素在具有相同电子层结构的稀有气体元素的前面,阳离子对应的元素在具有相同电子层结构的稀有气体元素的下一周期的左边位置,简称“阴前阳下”。
(2)根据元素主要化合价的特征关系推断:
①根据等式确定元素在周期表中的位置:最高正化合价数=最外层电子数=主族序数(O、F除外)。
②如果已知负化合价(或阴离子的符号),则须用等式先求出最高正化合价(除O、F外):最高正化合价=8-|最低负化合价|,再确定元素在周期表中的位置。
(3)根据原子半径的递变规律推断:同周期主族元素中左边元素的原子半径比右边元素的原子半径大,同主族中下边元素的原子半径比上边元素的原子半径大。
(4)由元素周期表中短周期的特殊结构推断:
①元素周期表中第一周期只有两种元素H和He,H所在的第ⅠA
族为元素周期表的左侧边界,第ⅠA族左侧无元素分布;
②He为0族元素,0族元素为元素周期表的右侧边界,0族元素右侧没有元素分布。
例1【2016·全国卷Ⅱ】a、b、c、d为短周期元素,a的原子中只有1个电子,b2-和c+离子的电子层结构相同,d与b同族。下列叙述错误的是( )
A.a与其他三种元素形成的二元化合物中其化合价均为+1
B.b与其他三种元素均可形成至少两种二元化合物
C.c的原子半径是这些元素中最大的
D.d与a形成的化合物的溶液呈弱酸性
变式题【2016·宁夏银川九中高三模拟】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y 元素的+3价阳离子的核外电子排布与氖原子相同,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
A.气态氢化物的稳定性:X”“=”或“<”表示)。
(4)用电子式表示B和C形成化合物的过程:________________________________________________________________________
________________________________________________________________________。
(5)A元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5,则该物质的结构式为____________。
7.【2016·山东菏泽一中月考】A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族元素,B和C的最外层电子数之和与E的最外层电子数相同,A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为__________,D元素的原子结构示意图为____________。
(2)由A、B、C三种元素形成的化合物的电子式为______________,这种化合物形成的晶体中所含的化学键类型有____________。
(3)由A、B、D三种元素形成的一种化合物和A、B两种元素形成的一种化合物能发生氧化还原反应,反应的化学方程式: ____________________________________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1∶1∶1,在 25 ℃时,将该盐溶于水,测得溶液pH>7,理由是____________________________________________ (
用离子方程式表示);
将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,则该过程的总反应方程式为________________________________________________________________________。
相关文档
- 2021届高考化学一轮复习化学计算中2021-07-086页
- 2021届高考化学一轮复习化学反应速2021-07-0810页
- 2020届高考化学一轮复习化学工艺流2021-07-086页
- 2020届高考化学一轮复习化学与技术2021-07-0823页
- 2021届高考化学一轮复习化学实验的2021-07-0812页
- 2021届高考化学一轮复习化学平衡常2021-07-088页
- 2020届高考化学一轮复习化学平衡常2021-07-0826页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0810页
- 2020版高考一轮复习化学通用版学案2021-07-0811页
- 2020届高考化学一轮复习化学键作业2021-07-088页