- 207.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业19 化学反应速率及其影响因素
时间:45分钟
一、选择题
1.(2020·安徽安庆一中期中)“活化分子”是衡量化学反应速率快慢的重要依据,下列说法中不正确的是( A )
A.活化分子之间的碰撞一定是有效碰撞
B.增大反应物的浓度,可使单位体积内的活化分子增多,反应速率加快
C.对于有气体参加的反应,通过压缩容器增大压强,可使单位体积内的活化分子增多,反应速率加快
D.催化剂能降低反应的活化能,使活化分子百分数增加
解析:本题考查活化能、活化分子对反应速率的影响。活化分子之间的碰撞必须有合适的取向才能引发化学反应,才是有效碰撞,A错误;增大反应物的浓度,活化分子的浓度增大,使单位体积内的活化分子增多,反应速率加快,B正确;对于有气体参加的反应,通过压缩容器增大压强,气体的浓度增大,单位体积内的活化分子增多,反应速率加快,C正确;加入催化剂,反应的活化能降低,活化分子增多,活化分子百分数增加,反应速率加快,D正确。
2.(2020·四川成都实验中学模拟)下列有关反应速率的说法正确的是( A )
A.氢气与氮气能够缓慢反应生成氨,使用合适催化剂可提高反应速率
B.等质量的锌粉和锌片与相同体积、相同浓度的盐酸反应,反应速率相等
C.用铁片与硫酸制备氢气时,使用浓硫酸可以加快产生氢气的速率
D.二氧化硫催化氧化反应的ΔH<0,所以升高温度,反应速率减小
解析:催化剂能加快化学反应速率,A项正确;质量相同时,锌粉与盐酸的接触面积大,反应速率快,B项错误;常温下铁遇浓硫酸钝化,C项错误;升高温度,活化分子的百分数增大,分子间的碰撞频率提高,分子间有效碰撞的几率提高,反应速率增大,D项错误。
3.(2020·河北廊坊省级示范高中联考)在一定条件下,将X和Y气体通入1L的恒容密闭容器中进行反应:aX(g)+bY(g)mZ(g),0~5 s内反应速率如下:v(X)=0.1 mol·L-1·s-1、v(Y)=0.3 mol·L-1·s-1、v(Z)=0.2 mol·L-1·s-1,则a、b、m的值分别为( C )
A.1、2、3 B.3、2、1
C.1、3、2 D.3、1、2
解析:根据反应速率之比等于化学计量数之比,可得a∶b∶m
8
=0.1∶0.3∶0.2=1∶3∶2,故本题选C。
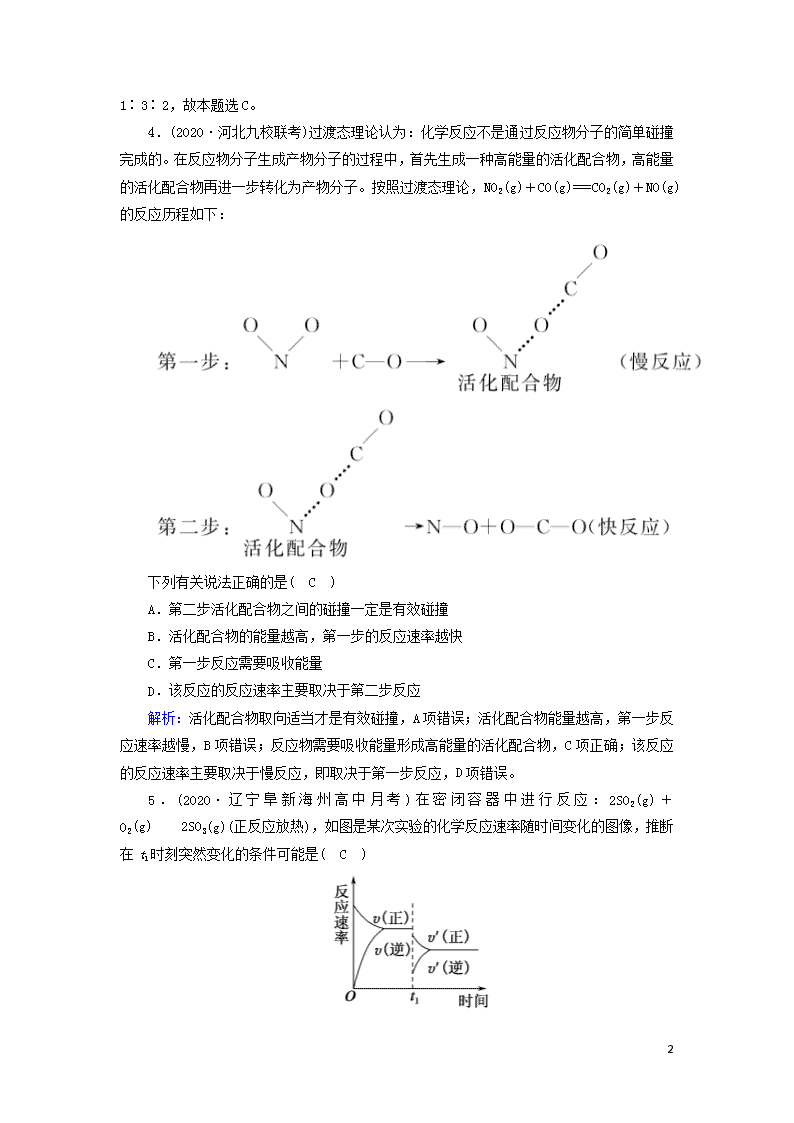
4.(2020·河北九校联考)过渡态理论认为:化学反应不是通过反应物分子的简单碰撞完成的。在反应物分子生成产物分子的过程中,首先生成一种高能量的活化配合物,高能量的活化配合物再进一步转化为产物分子。按照过渡态理论,NO2(g)+CO(g)===CO2(g)+NO(g)的反应历程如下:
下列有关说法正确的是( C )
A.第二步活化配合物之间的碰撞一定是有效碰撞
B.活化配合物的能量越高,第一步的反应速率越快
C.第一步反应需要吸收能量
D.该反应的反应速率主要取决于第二步反应
解析:活化配合物取向适当才是有效碰撞,A项错误;活化配合物能量越高,第一步反应速率越慢,B项错误;反应物需要吸收能量形成高能量的活化配合物,C项正确;该反应的反应速率主要取决于慢反应,即取决于第一步反应,D项错误。
5.(2020·辽宁阜新海州高中月考)在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图像,推断在t1时刻突然变化的条件可能是( C )
8
A.催化剂失效 B.减小生成物的浓度
C.降低体系温度 D.增大容器的体积
解析:催化剂只能同等程度地增大或减小正、逆反应速率,A项错误;减小生成物的浓度,正反应速率瞬时不变,逆反应速率瞬时减小,B项错误;正反应放热,降低温度,正、逆反应速率都减小,平衡正向移动,C项正确;增大容器的体积,正、逆反应速率都减小,但平衡逆向移动,D项错误。
6.(2020·浙江台州质检)在四氯化碳溶液中,N2O5按下式分解:2N2O5===4NO2+O2。取2 L该溶液测得在67 ℃时c(N2O5)随时间的变化如下表:
t/min
0
1
2
3
4
c(N2O5)/(mol·L-1)
1.00
0.71
0.50
0.35
0.25
根据表中数据,下列说法不正确的是( B )
A.其他条件不变时,化学反应速率随浓度的减小而减小
B.前2 min,以NO2表示的平均反应速率是0.25 mol·L-1·min-1
C.前4 min,生成O2的物质的量为0.75 mol
D.若升高温度,1 min时测得c(N2O5)<0.71 mol·L-1
解析:本题考查化学反应速率的计算及温度、浓度对反应速率的影响。由表中数据可知,随着反应的进行,每分钟内c(N2O5)的变化量逐渐减小,则其他条件不变时,化学反应速率随浓度的减小而减小,A正确;前2 min内,c(N2O5)减小0.50 mol·L-1,则c(NO2)增加1.00 mol·L-1,故有v(NO2)==0.50 mol·L-1·min-1,B错误;前4 min内,c(N2O5)减小0.75 mol·L-1,则反应中消耗N2O5为0.75 mol·L-1×2 L=1.50 mol,故前4 min生成的O2为0.75 mol,C正确;升高温度,反应速率加快,1 min内消耗的N2O5增加,故1 min时测得c(N2O5)<0.71 mol·L-1,D正确。
7.(2020·吉林长春五中调研)一定量的锌粒与足量稀硫酸反应,向反应混合液中加入某些物质,下列判断正确的是( C )
A.加入少量水,生成H2的速率减小,H2的体积减小
B.加入NH4HSO4固体,生成H2的速率不变,H2的体积不变
C.加入CH3COONa固体,生成H2的速率减小,H2的体积不变
D.滴加少量CuSO4溶液,生成H2的速率增大,H2的体积不变
解析:本题考查化学反应速率的影响因素。锌粒与稀硫酸反应的原理是Zn+2H+===Zn2++H2 ↑。加入少量水,c(H+)减小,生成H2的速率减小,由于锌粒和H+的物质的量不变,则生成H2的体积不变,A错误;加入NH4HSO4固体,c(H+)增大,生成H2的速率增大,但Zn少量,则生成H2的体积不变,B错误;加入CH3COONa固体,CH3COO-与H+反应生成CH3COOH,c(H+)减小,生成H2的速率减小,随着反应进行,CH3COOH会继续电离产生H+
8
,直到锌粒反应完全,则生成H2的体积不变,C正确;滴加少量CuSO4溶液,Zn与CuSO4发生置换反应生成Cu,形成原电池,生成H2的速率增大,由于消耗了锌,生成H2的体积减小,D错误。
8.(2020·河南洛阳联考)已知化学反应:NO2+CONO+CO2,①当t<250 ℃时,v=k·c2(NO2),②当t>250 ℃时,v=k·c(NO2)·c(CO)。以上两式中v为反应速率,k为速率常数(一定温度下为定值)。下列叙述正确的是( D )
A.当NO2和CO的浓度相等时,升高或降低温度,反应速率不变
B.因反应前后气体分子数目不变,故改变压强反应速率不变
C.t>250 ℃时,增大NO2的浓度为原来的2倍,反应速率一定变为原来的4倍
D.当温度低于250 ℃时,改变CO的浓度,反应速率基本不变
解析:升高温度,反应速率加快,降低温度,反应速率减慢,A项错误;该反应前后气体分子数目不变,改变压强,平衡不移动,但反应速率对应改变,B项错误;增大NO2的浓度为原来的2倍,若t>250 ℃,根据v=k·c(NO2)·c(CO)可知,反应速率变为原来的2倍,C项错误;当温度低于250 ℃时,根据v=k·c2(NO2)可知,一定温度下,反应速率只与c(NO2)有关,改变CO的浓度,反应速率不变,D项正确。
9.(2020·河北唐山一中冲刺)恒容条件下,1 mol SiHCl3发生如下反应:2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)。已知:v正=v消耗(SiHCl3)=k正x2(SiHCl3),v逆=2v消耗(SiH2Cl2)=k逆x(SiH2Cl2)·x(SiCl4),k正、k逆分别为正、逆反应速率常数(仅与温度有关),x为物质的量分数。如图是不同温度下x(SiHCl3)随时间的变化。下列说法正确的是( C )
A.该反应为放热反应,v正aT1。又T2 K下达到平衡时SiHCl3的物质的量分数比T1
8
K时小,说明升温平衡向正反应方向移动,由此推知该反应为吸热反应,A错误;各物质的化学反应速率之比等于化学方程式中相应化学计量数之比,化学平衡状态时,v消耗(SiHCl3)=2v消耗(SiCl4),B错误;2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g)的反应前后分子数不变,即反应开始至达到平衡的过程中混合气体总物质的量始终为1 mol,由图像知,T2 K下达到平衡时SiHCl3的物质的量分数为0.75,则此时SiH2Cl2和SiCl4的物质的量分数均为0.125,因为平衡时v正=v逆,v正=k正x2(SiHCl3)=0.752k正,v逆=k逆x(SiH2Cl2)·x(SiCl4)=0.1252k逆,则0.752k正=0.1252k逆,==,因k正和k逆只与温度有关,反应进行到a点时,v正=k正x2(SiHCl3)=0.82k正,v逆=k逆x(SiH2Cl2)·x(SiCl4)=0.12k逆,=×=×=,C正确;恒温恒容条件下再充入1 mol SiHCl3,相当于增大压强,而2SiHCl3(g)SiH2Cl2(g)+SiCl4(g)是反应前后气体分子数不变的反应,所以改变压强,平衡不移动,再次达到平衡时x(SiH2Cl2)不变,D错误。
10.(2020·山东临沂四中月考)为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是( B )
A.图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B.若图甲所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C.用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D.检查图乙所示装置的气密性,可关闭A处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
解析:本题通过实验探究催化剂对反应速率的影响。其他条件相同,产生气泡快,说明反应速率快,催化剂的催化效果好,A正确;图甲中分别加入FeCl3、CuSO4溶液,c(Fe3+)和c(Cu2+)相同,但所含阴离子不同,故反应速率为①>②,并不能说明Fe3+比Cu2+对H2O2分解催化效果好,B错误;利用题图乙装置,通过测定产生O2的体积及所需时间,确定反应速率,C正确;检查题图乙所示装置的气密性,关闭A处旋塞,将注射器活塞拉出一定距离,一段时间后松开活塞,若活塞恢复原位,则该装置的气密性良好,否则,气密性不好,D正确。
二、非选择题
11.(2020·河南平顶山六校联盟联考)某实验小组以H2O2
8
分解为例,研究浓度、催化剂、溶液的酸碱性对反应速率的影响。在常温下按照如下方案完成实验。
编号
反应物
催化剂
Ⅰ
10 mL 2% H2O2溶液+1 mL水
无
Ⅱ
10 mL 5% H2O2溶液+1 mL水
无
Ⅲ
10 mL 5% H2O2溶液
1 mL 0.1 mol·L-1 FeCl3溶液
Ⅳ
10 mL 5% H2O2溶液+少量HCl溶液
1 mL 0.1 mol·L-1 FeCl3溶液
Ⅴ
10 mL 5% H2O2溶液+少量NaOH溶液
1 mL 0.1 mol·L-1 FeCl3溶液
(1)实验Ⅰ和实验Ⅱ的目的是探究反应物浓度对反应速率的影响。
(2)写出实验Ⅲ中发生反应的化学方程式:2H2O22H2O+O2↑。
(3)实验Ⅰ、Ⅱ、Ⅲ的起始反应速率由大到小的顺序为Ⅲ>Ⅱ>Ⅰ(用实验编号表示)。
(4)实验Ⅲ、Ⅳ、Ⅴ中,测得生成氧气的体积(折算成标准状况)随时间变化的关系如图所示。
①分析图示能够得出的结论是碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率。
②实验Ⅲ在t1~t2时间内,以H2O2表示的反应速率为 mol·L-1·s-1。
解析:本题考查化学反应速率的影响因素及化学反应速率的计算。
(1)实验Ⅰ和Ⅱ均未使用催化剂,混合液的总体积均为11 mL,c(H2O2)不同,则实验目的是探究反应物浓度对反应速率的影响。
(2)实验Ⅲ为H2O2在FeCl3催化作用下分解生成H2O和O2的反应,据此写出化学方程式。
(3)实验Ⅰ中,c(H2O2)最小且未使用催化剂,则实验Ⅰ中起始反应速率最小;实验Ⅱ和Ⅲ中c(H2O2)相同,实验Ⅲ中加入FeCl3溶液,则实验Ⅲ的起始反应速率大于实验Ⅱ,故反应速率的大小顺序为Ⅲ>Ⅱ>Ⅰ。
(4)①与实验Ⅲ相比,实验Ⅳ加入少量HCl溶液,实验Ⅴ加入少量NaOH溶液,其他实验条件均相同,由题图可知,反应速率:Ⅴ>Ⅲ>Ⅳ,据此得出结论:碱性环境能加快H2O2分解的速率,酸性环境能减慢H2O2分解的速率。
②实验Ⅲ在t1~t2时间内,生成标准状况下O2的体积为(b-a) mL,则有n(O2)=
8
mol,反应中消耗H2O2的物质的量n(H2O2)=2n(O2)= mol,溶液的总体积为11 mL,故以H2O2表示的反应速率v(H2O2)= mol·L-1·s-1= mol·L-1·s-1。
12.用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的体积,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:
实验序号
A溶液
B溶液
①
20 mL 0.1 mol·L-1 H2C2O4溶液
30 mL 0.01 mol·L-1 KMnO4溶液
②
20 mL 0.2 mol·L-1 H2C2O4溶液
30 mL 0.01 mol·L-1 KMnO4溶液
(1)该实验探究的是浓度因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是②≥①(填实验序号)。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO)=0.005_2 mol·L-1(假设混合溶液的体积为50 mL)。
(3)除通过测定一定时间内CO2的体积来比较反应速率外,本实验还可通过测定KMnO4溶液完全褪色所需时间(或产生相同体积气体所需时间)来比较化学反应速率。
(4)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:①产物Mn2+是反应的催化剂,②反应放热。
解析:(1)对比①②实验中A溶液、B溶液的数据可知,除c(H2C2O4)不同外,其余各量均相同,显然该实验是探究浓度对化学反应速率的影响。实验②中A溶液的c(H2C2O4)比实验①中大,则实验②的化学反应速率快,所得CO2的体积:②≥①。(2)收集到CO2的物质的量为n(CO2)==2×10-4 mol,则有
2MnO+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
2 10
n(MnO) 2×10-4 mol
列式:=,解得n(MnO)=4×10-5 mol。在2 min末,n(MnO
8
)=30×10-3 L×0.01 mol·L-1-4×10-5 mol=2.6×10-4 mol,从而可得c(MnO)==0.005 2 mol·L-1。(3)可以通过测定KMnO4溶液完全褪色所需时间或产生相同体积气体所需时间来比较化学反应速率。(4)t1~t2时间内反应速率变快,其可能原因主要有:①产物Mn2+(或MnSO4)是反应的催化剂;②反应放热,使混合溶液的温度升高。
8
相关文档
- 2020届二轮复习第13题 化学实验基2021-07-0813页
- 【化学】安徽省示范高中培优联盟202021-07-0812页
- 备战2021 高考化学 考点41 化学反2021-07-087页
- 高考化学一轮复习学案课件(人教版):第2021-07-0830页
- 【化学】河北省正定中学2019-20202021-07-0815页
- 高考化学知识点总结2021-07-0842页
- 2020_2021学年高中化学第二章化学2021-07-088页
- 高一化学必修一第一章知识点汇编2021-07-088页
- 年高考化学一轮精品讲练析第7讲《2021-07-0813页
- 山东省菏泽市第一中学等六校2020-22021-07-0817页