- 2.50 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
1
第一章:从实验学化学知识点汇编
1.1 化学实验基本方法
一.化学实验安全
1. 使用药品“三不”
①不用手接触药品②不将鼻孔凑到容器瓶口闻药品气味(用扇闻)③不尝药品味道
2. 用剩药品“三不”
①不放回原瓶(Na、K、CaCO3 除外)②不随意丢弃③不拿出实验室
3. 实验室一般事故的预防和处理方法
4. 实验室安全操作“六防”
内容 可能引起事故的操作 采取的措施
防爆
炸
点燃可燃性气体(如 H2、
CO2、CH4 等)
点燃前先要检验气体的纯度
用 CO、H2 还原 Fe2O3、CuO
等
先通入 CO 或 H2,在装置尾部收集气体检验纯度,若尾部气体
纯净,表示空气已排净,在对装置加热
防暴
沸
加热液体混合物 在混合液中加入碎瓷片
浓硫酸与水、乙醇等混合 稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓注入水中,并不
断搅拌。浓硫酸与密度比它小的液体混合时,都应将浓硫酸
缓缓注入该液体中
防失
火
可燃性物质遇到明火 可燃性物质一定要远离火源,加热易燃物质应小火、缓慢、
均匀加热
防中
毒
制取有毒气体,误食重金
属盐等
制取有毒气体应在通风橱中进行,误食重金属盐应喝豆浆、
牛奶或鸡蛋清解毒
防倒
吸
加热法制取并用排水法收
集气体
先将导管从水中取出,在熄灭酒精灯(如有多个加热装置的
复杂装置,要注意熄灭酒精灯的顺序)
防污
染
对环境有污染的物质的制
取,废弃物的处理
有毒气体应进行尾气处理,固体、液体废弃物要回收或合理
处理后排放
5、药品取用
(1)块状或金属颗粒:一横,二放,三慢立 (2)固体粉末:一斜,二送,三直立
内容 方法
K、Na 起火 用沙子盖灭,不能用水、CO2
酒精灯碰到着火 用沙子或湿抹布盖灭,不能用火泼灭
浓碱沾到皮肤上 大量水冲,再涂上硼酸
浓 H2SO4 沾到皮肤上 用大量水冲,然后涂上 3%~5%的 NaHCO3
苯酚沾到皮肤上 用乙醇擦洗
大量酸洒到桌子上 加适量 NaHCO3 中和,用水冲洗并擦净
大量碱洒到桌子上 加适量醋酸中和,用水擦洗并冲净
酸溅入眼中 应立即用水冲洗,边冲边眨眼睛
重金属盐中毒 饮服大量牛奶、豆浆或蛋清
水银洒出 为防止汞蒸气中毒,应用硫粉覆盖 Hg2++S2-=HgS↓
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
2
(3)液体:拿下瓶塞,倒放桌面上,倾倒时瓶上标签向着手心防止瓶口残留药液留下来腐
蚀标签,同时瓶口紧挨试管口缓慢倾倒 取用块状或颗粒状药品用镊子,粉末状药品用药匙
或纸槽,少量液体用胶头滴管(胶头滴管应在试管口上部悬空,不能插入试管内)
6、物质加热
可直接加热的仪器:试管,坩埚,蒸发皿,燃烧匙
隔石棉网加热的仪器:烧杯,烧瓶,锥形瓶
酒精灯使用:添加酒精不超过容积三分之二,禁止向燃着酒精灯加酒精,禁止用一个酒精灯
点燃另一个酒精灯,用灯帽盖灭,不许用嘴
试管加热前要预热,防止局部受热使试管炸裂。加热试管液体时,液体体积不超过试管容积
三分之一,45°倾斜,管口不对人。
7、药品存放
(1)受热或见光易分解的物质存放在棕色瓶中(浓硝酸,硝酸银)
(2)金属钠保存在煤油中,易和氧气,水反应,白磷着火点低(40 摄氏度)在空气中自燃,
保存在冷水中。
二. 混合物的分离与提纯
1. 过滤(液体与固体间)
★过滤三要素①滤纸紧贴漏斗内壁②二低:滤纸边缘要低于漏斗边缘,液面要低于漏斗边缘
③三靠:玻璃棒紧靠三层滤纸处,玻璃棒紧靠烧杯口,漏斗下端管口紧靠烧杯内壁
2. 沉淀的洗涤:向沉淀中加入蒸馏水至稍浸没沉淀,让水自然滤出(带出可溶性离子)重
复 2~3 次即可
3. 蒸发
①适用:溶剂蒸发、溶质析出
②注意事项 a:液体的量不得超过蒸发皿容量的
3
2
b:加热过程中,用玻璃棒不断搅拌液体,以免液体局部过热而使液滴飞溅
c:出现较多固体时,停止加热,利用余热蒸干溶剂
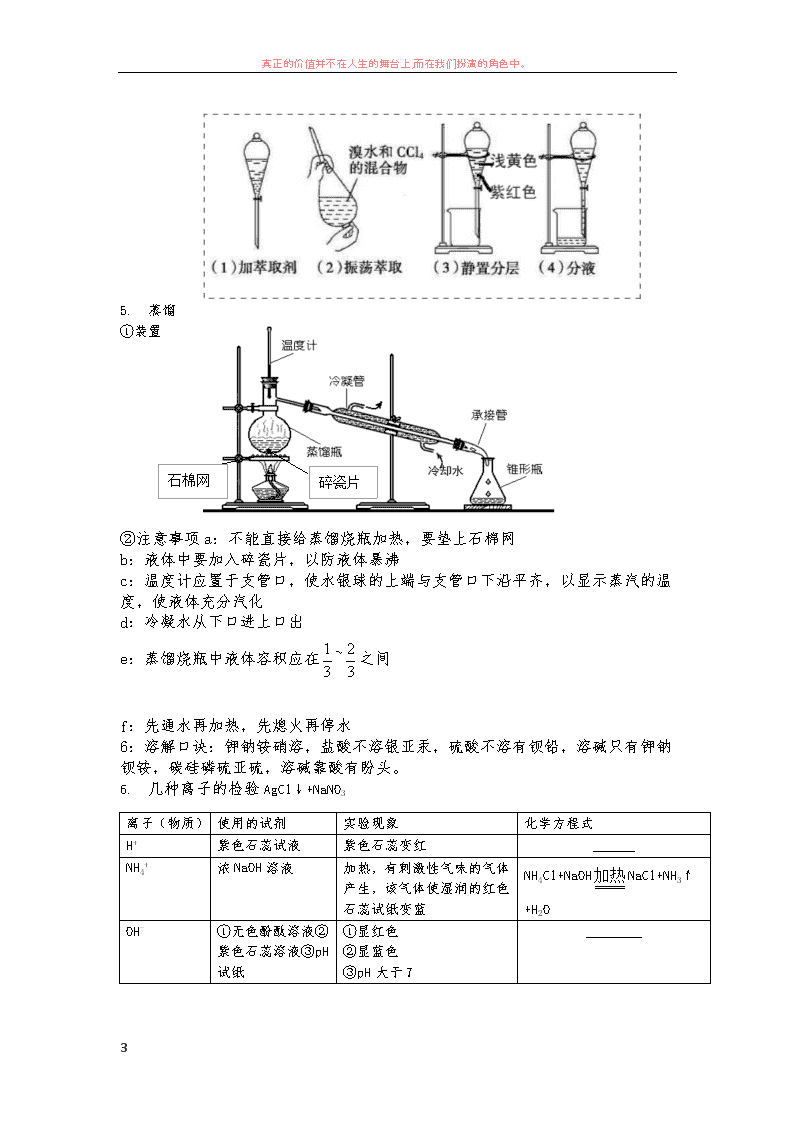
4. 萃取和分液⑴萃取①含义:利用混合物中的一种溶质在互不相溶的溶剂中的溶解度不同,
用一种溶剂(萃取剂)把该溶质从它与另一种溶剂所组成的溶液中提取出来,这种方法叫萃
取
②萃取剂的要求:萃取时,两种溶剂必须互不相溶、不发生化学反应,且要具有一定的密度
差,溶质在萃取剂中的溶解度一定要远大于在原溶剂中的溶解度。
③萃取的仪器:分液漏斗(注意要检查是否漏水,上层溶液从上口出,下层溶液从下口出)
⑵分液
含义:把两种互不相溶的液体(密度不同)分开的操作叫做分液。分液使用的仪器是分液漏
斗。
⑶示例 Br2、I2 在水中的溶解度较小,而在 CCl4、苯等有机溶剂中的溶解度较大。实验室中
常见的萃取示例适用 CCl4、苯等溶剂萃取水溶液中的溴、碘等单质。用 CCl4 从碘水中萃取
单质碘的操作如图所示
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
3
5. 蒸馏
①装置
②注意事项 a:不能直接给蒸馏烧瓶加热,要垫上石棉网
b:液体中要加入碎瓷片,以防液体暴沸
c:温度计应置于支管口,使水银球的上端与支管口下沿平齐,以显示蒸汽的温
度,使液体充分汽化
d:冷凝水从下口进上口出
e:蒸馏烧瓶中液体容积应在
3
1 ~
3
2 之间
f:先通水再加热,先熄火再停水
6:溶解口诀:钾钠铵硝溶,盐酸不溶银亚汞,硫酸不溶有钡铅,溶碱只有钾钠
钡铵,碳硅磷硫亚硫,溶碱靠酸有盼头。
6. 几种离子的检验 AgCl↓+NaNO3
离子(物质) 使用的试剂 实验现象 化学方程式
H+ 紫色石蕊试液 紫色石蕊变红 ______
NH4
+ 浓 NaOH 溶液 加热,有刺激性气味的气体
产生,该气体使湿润的红色
石蕊试纸变蓝
NH4Cl+NaOH加热 NaCl+NH3↑
+H2O
OH- ①无色酚酞溶液②
紫色石蕊溶液③pH
试纸
①显红色
②显蓝色
③pH 大于 7
________
碎瓷片石棉网
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
4
答题模板:检验 SO4
2-:取一定体积的溶液于试管中,先加入一定量的稀盐酸(无明显现象),
再加入 BaCl2。如有白色沉淀产生则原溶液中含有 SO4
2-
1.2 化学计量在实验中的应用
一. 物质的量及其单位
1. 物质的量
①定义:表示含有一定一定数目粒子的集合体。这是一个物理量,只适用于微观粒子,如分
子、原子、质子、中子等
②符号:她是 7 个物理量之一(另外 6 个为:长度、质量、时间、电流、热力学温度、发光
强度),用 n 来表示。
③单位:摩尔,简称摩,用 mol 表示,摩尔只是单位
④规定 1mol 粒子所含的数目为 6.02×1023
2. 阿伏伽德罗常数(测定单分子油膜法)
①定义:科学上规定以 0.012kg12C 中所含的碳原子数称为阿伏伽德罗常数
②单位 mol-
③符号:NA
④公式 n=
AN
N 变形:NA=
n
N ,N=NA×n
例:3.01×1022 个 CO2 的物质的量为 n(CO2)=
AN
N =3.01×1022÷(6.02×1023mol-)=0.05mol
3. 摩尔质量
①定义:科学上规定,单位物质的量的物质所具有的质量叫做该物质的摩尔质量
②符号:M
③单位:g/mol 或 kg/mol
④取值规律:1mol 粒子的质量=相对分子(或原子)质量与 g 的组合→粒子的摩尔质量=相
对分子(或原子)质量与 g 的组合
⑤公式:n=
M
m 变形:M=
n
m ,m=M×n
二. 气体摩尔体积
1. 气体摩尔体积的概念
①在温度及压强相同时,1mol 的固体或液体的体积不相同,1mol 任何气体所占体积在数值
上近似相等
②定义:在一定温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积,符号为
Vm,单位为 L/mol 或 m3/mol
③标准状况(0oC,101KP)下,Vm=22.4L/mol(近似值,描述时前面加“约”)
2. 影响物质体积的因素
决定物质体积的大小的因素有:粒子数目、粒子大小、粒子间的距离
①固体及液体的体积取决于粒子数目及大小
Cl- AgNO3 溶液、稀 HNO3 生成不溶于 HNO3 的白色沉
淀
NaCl+AgNO3—AgCl↓+NaNO3
SO4
2- 先加盐酸酸化,再
加 BaCl2 溶液
加盐酸无现象,加 BaCl2 溶
液后有白色沉淀生成
(NH4)2SO4+BaCl2—BaSO4↓
+2NH4Cl
CO3
2-或 HCO3
- 盐酸、澄清石灰水 产生能使澄清石灰水变浑
浊的无色无味的气体
NaCO3+2HCl—2HCl+CO2↑+H2O
CO2+Ca(OH)2=CaCO3↓+H2O
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
5
②气体的体积取决于粒子数目及粒子间的距离
3. 气体摩尔体积的数目不是固定不变的
4. 阿伏伽德罗定律:在相同的温度和压强下,相同体积的任何气体均含有相同数目的分子
5. 公式:Vm=
n
V
6. 有关气体的相对密度和平均摩尔质量的计算:十字交叉法
三. 阿伏伽德罗定律的推论
PV=nRT(R 为常数),P=
M
ρ RT,PV=
M
m RT
1. 同温同压下,气体分子数(物质的量)与其体积成正比
2. 同问同体积的气体,压强与其分子数成正比
3. 分子数相等,压强相同的气体,体积与其温度成反比
4. 分子数相等,温度相同的气体,压强与其体积成反比
5. 同温同压下,气体的密度与其相对分子质量成正比
四. 物质的量在化学实验中的应用
1. 物质的量浓度
①定义:表示单位体积溶液里所含溶质 B(B 表示各种溶质)的物质的量的物理量
②符号:c(B)
③单位:mol/L
④公式:CB =
液V
nB w=
剂
质
m
m ×100% S(饱和) =
剂
质
m
m ×100g
注意点:①溶液物质的量浓度与其溶液的体积没有任何关系
⑤溶液稀释:C(浓溶液)•V(浓溶液)=C(稀溶液)•V(稀溶液)
或 m(浓)•w(浓)=c(稀)•m(稀)
2.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的
方法,求出所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制
得溶液.
(2)主要操作
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
6
1、检验是否漏水.
2、配制溶液
○1 计算溶质质量,溶解时玻璃棒要悬空—防止异物进入
○2 称量(或量取):天平只能量到 0.1g
○3 溶解及回温:将称量的固体(液体)放入烧杯中,加入水溶解
○4 转移.(引流及洗涤):要用玻璃棒引流,且玻璃棒要悬空,下端要在容量瓶刻度线以
下
○5 洗涤.用蒸馏水洗涤烧杯内壁及玻璃棒 2~3 次,并将其转入容量瓶中
○6 定容.(引流及滴加):向容量瓶中加入水(用玻璃棒引流),至接近刻度线 1cm~2cm
处,再改用胶头滴管加水。(注:滴管不能伸入瓶颈内,一定不能使液面超过刻度线)
○7 摇匀.盖好瓶塞,上下颠倒,摇匀后静置,即使液面降低也不可再加水
○8 装瓶. 将配好的溶液转移到细口瓶中,贴好标签保存
所需仪器:托盘天平、烧杯、玻璃棒、胶头滴管、(X L)容量瓶
注意事项:A 选用与欲配制溶液体积相同的容量瓶.
B 使用前必须检查是否漏水.
C 不能在容量瓶内直接溶解.
D 溶解完的溶液等冷却至室温时再转移.
E 定容:继续往容量瓶中小心地加水,直到液面接近刻度 2-3mm 处,改用胶头滴管加水,
使溶液凹面恰好与刻度相切。
(3)误差分析:(以配制 NaOH 为例)根据公式:C=n/V=m/(M·V)
(4)溶液加水稀释的几个规律:
密度大于 1 的溶液:加等体积水后,溶液溶质质量分数大于原溶液溶质质量分数的一半。 加
等质量水后,溶液物质的量浓度小于原溶液物质的量浓度的一半。
密度小于 1 的溶液::加等体积水后,溶液溶质质量分数小于原溶液溶质质量分数的一半。加
等质量水后,溶液物质的量浓度大于原溶液物质的量浓度的一半。
2. 关于物质的量浓度计算的相关规律
①c 与 w 的换算 c=
M
w1000 (其中 的单位为 g/cm3,c 的单位为 mol/L)
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
7
证明:设溶液体积为 1L,则 m=1000 wV( 的单位为 g/cm3)∴n=
M
m =
M
Vw1000
∴c=
V
n =
M
w1000
②c 与 S(饱和溶液)的换算:c=
)100
1000
SM
S
(
证明:∵S=
(溶剂)
(溶质)
m
m ×100g,且 w=
S
S
100
×100%∴S=
w1
w100 又∵c=
M
w1000
∴c=
)100
1000
SM
S
(
③w=
S
S
100
×100%;S=
w-1
w ×100
④c=
MV
V
22400
1000 ,w=
MV
MV
22400
关系图:
第二章:化学物质及其变化
2.1 物质的分类
一. 简单分类法及其应用
1. 交叉分类法:对物质以不同的标准进行分类。如 Na2CO3 既属于钠盐又属于碳酸盐
2. 树状分类法:对同类事物进行再分类的方法。
二. 分散系及其分类
1.定义:把一种或多种物质分散在另一种(或多种)物质中得到的体系叫做分散系。前者属
于被分散的物质,称作分散质;后者起容纳分散质的作用,称作分散剂。
★实例
气+气 液+气 固+气 气+液 液+液 固+液 固+固
空气 雾(小液粒) 烟(小颗粒) 盐酸 硫酸溶液 食盐溶液 有色玻璃
物质的量浓度 CB
质 量 m 微 粒 N
气体的体积(标况下)
物质的量 n
×VB ÷VB
×NA
÷NA
÷Vm×Vm
÷M
×M
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
8
3. 分类及区别
①分类:根据分散质粒子大小来分
分散系(分散剂为液态):溶液,胶体(指液溶胶),浊液(悬浊液,乳浊液)
②区别
外观 稳定性 分散质大小 能否通过滤纸 分散质粒子种类
溶液 均一、透明 稳定(介稳性) ﹤1nm 能 分子、离子
胶体 均一、透明 稳定(介稳性) 1~100nm 能 较多分子的集合体或大分子
浊液 不均一、不透明 不稳定 ﹥100nm 否 大量分子的集合体(固体小颗粒或小液滴)
相关文档
- 高一化学必修一电解质及其电离练习2021-07-083页
- 新课标同步导学高一化学课件:第三章2021-07-0857页
- 新课标同步导学高一化学课件:第四章2021-07-0851页
- 宿州市汴北三校联考 2017-2018学年2021-07-083页
- 高一化学课件:1物质结构 元素周期律2021-07-0810页
- 高一化学期中试题无答案2021-07-085页
- 人教版高一化学必修一知识点超全总2021-07-0813页
- 人教版高一化学必修一知识点超全总2021-07-0822页
- 高一化学课件:3饮食中的有机化合物2021-07-0817页
- 黑龙江省绥化市绥棱县 2016-2017 2021-07-088页