- 1.15 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
河南省鹤壁市高级中学2019-2020学年高一下学期第一次测试试题
1.2022 年冬奥会雪上项目落户张家口,雪花成为我市沟通世界的名片。科学研究发现,世界上没有两片雪花的形状是完全相同的。不同雪花中,水分子( )
A. 数目都是相同的 B. 数目都是巨大的
C. 空间排列方式相同 D. 化学性质不相同
【答案】B
【解析】
【详解】A、不同雪花质量可能不同,所以水分子数目不同,故A错误;
B、由于分子质量和体积都很小,不同雪花中,水分子数目都是巨大的,故B正确;
C、由于水分子空间排列方式不同,形成雪花的形状不完全相同,故C错误;
D、同种分子性质相同,所以不同雪花中,水分子化学性质相同,故D错误。
2.一些装有化学物质的容器上常贴有危险化学品的标志。下列标志中,应贴在装有浓硝酸的容器上的是( )
A. B.
C. D.
【答案】C
【解析】
【分析】根据浓硝酸的化学性质和常用化学危险品的标志思考。
【详解】浓硝酸是无色、易挥发、有刺激性气味的液体,具有很强的氧化性,是强氧化剂,因此应该使用,故选C。
3.下列关于Fe(OH)3胶体的说法中,不正确的是 ( )
A. 分散质粒子直径在10-9~10-7m之间 B. 是一种纯净物
C. 具有丁达尔效应 D. 具有净水作用
【答案】B
【解析】
【详解】A. 氢氧化铁胶体胶粒的直径在10-9~10-7m之间,A正确;
B. 氢氧化铁胶体是氢氧化铁和水的混合物,B错误;
C. 胶体具有丁达尔效应,C正确;
D. 氢氧化铁胶粒能吸附水中的杂质颗粒,有净水的作用,D正确;
答案选B。
4.常温常压下,等质量的CH4、CO2、O2、SO2分别吹出四个气球,其中气体为CH4的是( )
A. B. C. D.
【答案】D
【解析】
【详解】V=,因为气体的质量相等,常温常压,则Vm相同,所以气体的体积V与气体的相对分子质量成反比,气体的相对分子质量越小,气体的体积越大。
CH4、CO2、O2、SO2的相对分子质量分别为16、44、32、64,所以CH4的相对分子质量最小,体积最大。
故选D。
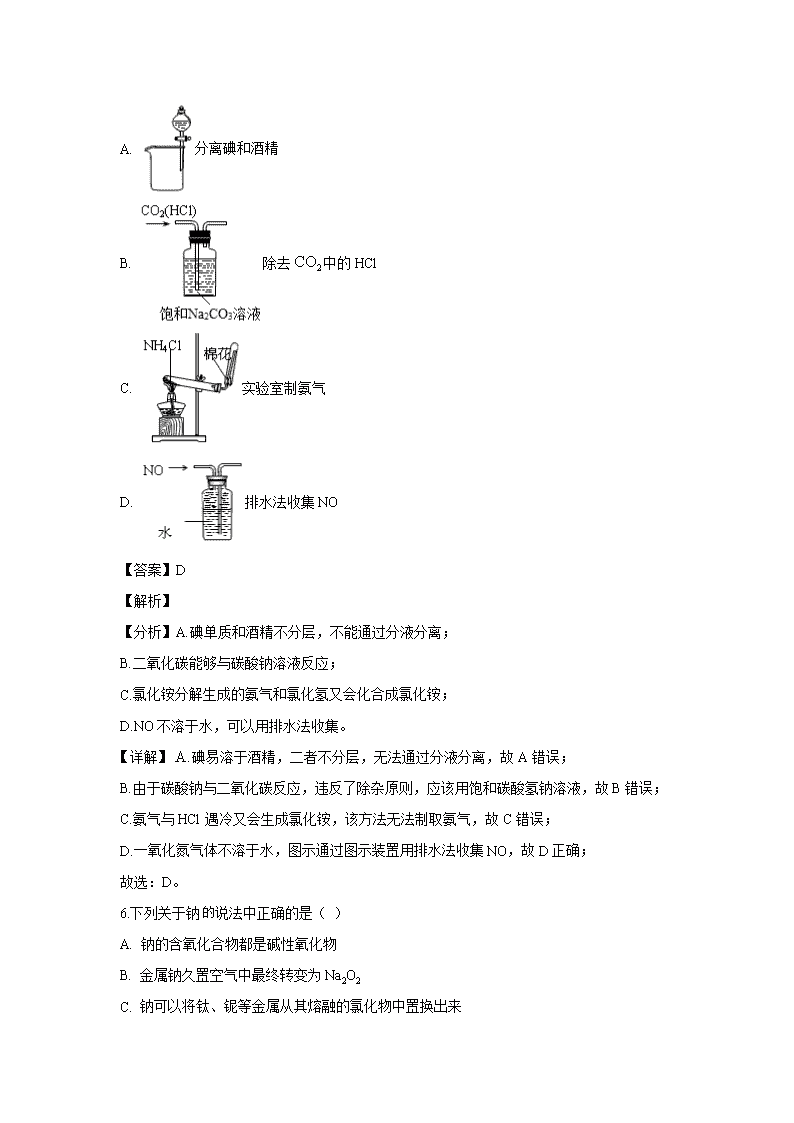
5.下列装置所示的实验中,能达到实验目的是( )
A. 分离碘和酒精
B. 除去中的HCl
C. 实验室制氨气
D. 排水法收集NO
【答案】D
【解析】
【分析】A.碘单质和酒精不分层,不能通过分液分离;
B.二氧化碳能够与碳酸钠溶液反应;
C.氯化铵分解生成的氨气和氯化氢又会化合成氯化铵;
D.NO不溶于水,可以用排水法收集。
详解】碘易溶于酒精,二者不分层,无法通过分液分离,故A错误;
B.由于碳酸钠与二氧化碳反应,违反了除杂原则,应该用饱和碳酸氢钠溶液,故B错误;
C.氨气与HCl遇冷又会生成氯化铵,该方法无法制取氨气,故C错误;
D.一氧化氮气体不溶于水,图示通过图示装置用排水法收集NO,故D正确;
故选:D。
6.下列关于钠说法中正确的是( )
A. 钠的含氧化合物都是碱性氧化物
B. 金属钠久置空气中最终转变为Na2O2
C. 钠可以将钛、铌等金属从其熔融的氯化物中置换出来
D. 过氧化钠只具有氧化性不具有还原性
【答案】C
【解析】
【详解】A、过氧化钠属于过氧化物,不是碱性氧化物,故A错误;
B. 金属钠久置空气中最终转变为Na2CO3,故B错误;
C. 钠的还原性强,钠可以将钛、铌等金属从其熔融的氯化物中置换出来,故C正确;
D. 过氧化钠中的氧元素化合价为-1,氧元素化合价既可以升高又可以降低,所以过氧化钠既具有氧化性又有还原性,故D错误。
7.中国最新战机歼-31使用了高强度、耐高温的钛合金材料,工业上冶炼钛的反应如下:,下列有关该反应的说法正确的是( )
A. 是还原剂 B. Mg被氧化
C. 发生氧化反应 D. Mg得到电子
【答案】B
【解析】
【详解】反应中,Ti元素化合价降低,Mg的化合价升高;
A. 反应中Ti元素化合价降低,则TiCl4为氧化剂,A项错误;
B. 反应中Mg失电子,则Mg被氧化,B项正确;
C. 反应中Ti元素化合价降低,则TiCl4发生还原反应,C项错误;
D. 反应中Mg的化合价升高,失电子,D项错误;
答案选B。
8.NA 代表阿伏加德罗常数的值,下列说法正确的是( )
A. 1mol O2 作为氧化剂参与反应,得到的电子数一定为 4NA
B. 1mol Fe 和足量稀硫酸反应,失去的电子数是 3NA
C. 0.4mol·L-1Na2SO4 溶液中,所含 Na+和SO42- 总数为 1.2NA
D. 标准状况下,23g Na 所占的体积一定小于 22.4L
【答案】D
【解析】
【详解】A、2Na+O2 Na2O2,反应中氧元素化合价由0变为-1,1molO2得到的电子数为2NA
,故A错误;
B. 铁与稀硫酸反应生成硫酸亚铁和和氢气,铁元素化合价由0变为+2,1mol Fe 和足量稀硫酸反应,失去的电子数2NA,故B错误;
C. 没有溶液体积不能计算溶质物质的量,故C错误;
D. 标准状况下,钠是固体,1mol Na所占的体积小于 22.4L,故D正确。
9.下列各组物质中,X表示某物质,Y表示X物质中含有的少量杂质,Z表示要除去杂质加入的试剂,其中正确的组别是( )
X
Y
Z
A
FeCl2溶液
FeCl3
KSCN溶液
B
H2
SO2
NaOH溶液
C
Fe2(SO4)3溶液
FeSO4
Cl2
D
SiO2
Fe2O3
NaOH溶液
【答案】B
【解析】
【详解】A.KSCN溶液可检验三价铁离子,不能用来除杂,应加入过量铁粉,故A错误;
B.SO2与NaOH溶液反应,氢气不反应,可以除去杂质,故B正确;
C.氯气与硫酸亚铁反应生成硫酸铁和氯离子,引入新的杂质,应该用双氧水,故C错误;
D.SiO2能与碱溶液反应生成可溶性盐,Fe2O3与碱溶液不反应,将原物质除掉,应该用盐酸,故D错误。
故答案选B。
10.以下实验现象判断正确的是( )
A
B
C
D
操作
将盛满NO2的试管倒扣在水槽中
向FeCl3溶液中滴加KSCN溶液
加热碳酸钠固体
将绿豆粒大小的钠投入硫酸铜溶液中
现象
液面上升,但溶液未充满整个试管
生成红色沉淀
生成可使澄清石灰水变浑浊的气体
有红色固体析出
【答案】A
【解析】A、NO2气体为红棕色,二氧化氮气体易与水反应生成硝酸(HNO3)和一氧化氮,3NO2+H2O=2HNO3+NO,NO为无色,所以气体颜色由红棕色逐渐变为无色,气体体积减少,试管内的液面会逐渐上升,但溶液未充满整个试管,故A正确;B、向FeCl3溶液中滴加KSCN溶液,溶液呈血红色,没有沉淀,故B错误;C、加热碳酸钠固体不能生成可使澄清石灰水变浑浊的气体,故C错误;D、将绿豆粒大小的钠投入硫酸铜溶液中,金属钠和盐溶液反应先是和溶液中的水反应,不会和盐之间发生置换反应,故D错误。故选A。
11.下列说法正确的是( )
A. 二氧化硫、二氧化氮、二氧化碳不仅严重污染大气,还会形成酸雨
B. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
C. 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,无K+
D. 金属钠着火,应立即用水灭火
【答案】B
【解析】A、二氧化硫、二氧化氮不仅严重污染大气,还会形成酸雨,二氧化碳不会形成酸雨,故A错误;B、在蔗糖中加入浓硫酸后出现发黑现象,由于浓硫酸使蔗糖碳化,说明浓硫酸具有脱水性,故B正确;C、 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+,要确定有无钾元素,要透过蓝色钴玻璃观察,不呈紫色才说明无K+,故C错误;D、 金属钠着火,应立即用沙子灭火,钠能与水反应,故D错误;故选B。
12.NaCl、Cl2、NaClO、ClO2、HClO4是按某一规律排列的,下列选项中也完全按照此规律排列的是( )
A. CH4、Na2CO3、C、CO2、NaHCO3
B. Na2S、S、SO2、Na2SO3、H2SO4
C. FeCl3、Fe、FeCl2、Fe(OH)3、Fe(SCN)3
D. NH3、N2、NO、NO2、NaNO3
【答案】D
【解析】A. CH4、Na2CO3、C、CO2、NaHCO3中C元素的化合价分别为-4、+4、0、+4、+4价,不是按照化合价升高顺序排列,A错误;B. Na2S、S、SO2、Na2SO3、H2SO4中S元素的化合价分别为-2、0、+4、+4、+6价,不是按照化合价升高顺序排列,B错误;C. FeCl3、Fe、FeCl2、Fe(OH)3、Fe(SCN)3中Fe元素的化合价分别为+3、0、+2、+3、+3价,不是按照化合价升高顺序排列,C错误;D. NH3、N2、NO、NO2、NaNO3
中N元素的化合价分别为-3、0、+2、+4、+5价,是按照化合价升高顺序排列,D正确,答案选D。
13.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,剩余固体不可能是( )
A. 有铜无铁 B. 有铁无铜
C. 铁、铜都有 D. 铁、铜都无
【答案】B
【解析】
【分析】Fe的还原性大于Cu,所以向氯化铁溶液中加入Cu、Fe可能发生的反应有2FeCl3+Cu=2FeCl2+CuCl2、2FeCl3+Fe=3FeCl2、CuCl2+Fe=FeCl2+Cu,且Fe先发生氧化还原反应,据此分析解答。
【详解】A.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,当Fe完全反应后,Cu部分反应,则烧杯中有Cu无Fe,故A不选;
B.Fe的还原性大于Cu,所以加入Fe、Cu时Fe先参加反应,如果溶液中有Fe而无铜,则Fe会和铜离子发生置换反应而生成铜,所以不可能出现有Fe而无Cu现象,故B可选;
C.如果铁完全将铁离子还原还剩余,则Cu就不参加反应,所以烧杯中还剩Fe、Cu,故C不选;
D.如果铁离子的量足够大,Fe、Cu完全反应后铁离子还剩余,则烧杯中Cu、Fe都不存在,故D不选;
故选:B。
14.下图是喷泉实验装置图,下列说法正确的是( )
A. 烧瓶中的溶液呈红色,则原气体一定是SO2
B. 形成喷泉的原因是烧瓶内压强大于外界大气压
C. 烧瓶中的溶液呈蓝色,则原气体可能是氨气
D. 若将石蕊溶液改成氢氧化钠溶液,则CO、CO2均能形成喷泉
【答案】C
【解析】A、烧瓶中的溶液呈红色,说明气体溶于水呈酸性,则原气体可能是HCl、SO2等酸性气体,A错误;B、烧瓶中的气体溶于烧杯内的液体,使烧瓶内压强小于外界大气压形成喷泉,B错误;C、烧瓶中的溶液呈蓝色,则原气体溶于水一定显碱性,因此可能是氨气,C错误;D、CO不溶于氢氧化钠溶液,若将石蕊改成氢氧化钠,CO不能形成喷泉,D错误。答案选C。
15.下列有关Na2CO3和NaHCO3比较中,不正确的是( )
A. 热稳定性:Na2CO3>NaHCO3
B. 相同温度下,0.1mol/L盐溶液的pH值:Na2CO3>NaHCO3
C. 等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应放出气体的量:Na2CO3NaHCO3
【答案】D
【解析】
【详解】A. Na2CO3受热难分解,NaHCO3受热易分解,所以热稳定性:Na2CO3>NaHCO3,A正确;
B. 相同温度下,相同浓度Na2CO3溶液的碱性比NaHCO3溶液强,所以0.1mol/L盐溶液的pH值:Na2CO3>NaHCO3,B正确;
C. 等质量的碳酸钠和碳酸氢钠,前者的物质的量小于后者,分别与足量盐酸反应放出气体的量:Na2CO3