- 2.09 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020 年高考化学大题专项复习:化学反应原理综合题
1.新型洁净能源能够解决环境污染、能源短缺等问题,真正把“绿水青山就是金山银山”
落实到我国的各个角落。氢气作为清洁高效、可持续“零碳”能源被广泛研究,而水煤
气变换反应(WGSR)是一个重要的制氢手段。
(1)WGSR 的氧化还原机理和羧基机理如图所示。则热化学方程式
CO(g)+H2O(g) CO2(g)+H2(g) ΔH 中,对ΔH 表述错误的是________(填字母)。
A.氧化还原机理途径:ΔH=ΔH1+ΔH2+ΔH5a+ΔH7
B.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5d+ΔH7
C.氧化还原机理途径:ΔH=ΔH1+ΔH3+ΔH5a+ΔH7
D.羧基机理途径:ΔH=ΔH1+ΔH4+ΔH5c+ΔH7
E.ΔH=ΔH1+ 2 4 5a 5d
2
H H H H +ΔH7
(2)水煤气变换反应在不同条件时 CO 的转化率不同,下图为压力、温度、不同温
度时钾的化合物对 CO 的转化率的影响关系图,请认真观察图中信息,结合自己所学
知识及生产实际,写出水煤气变换反应的条件:温度选择________℃;钾的化合物中
_______催化效果最明显;压力选择______Mpa,选用此压力的原因为________。
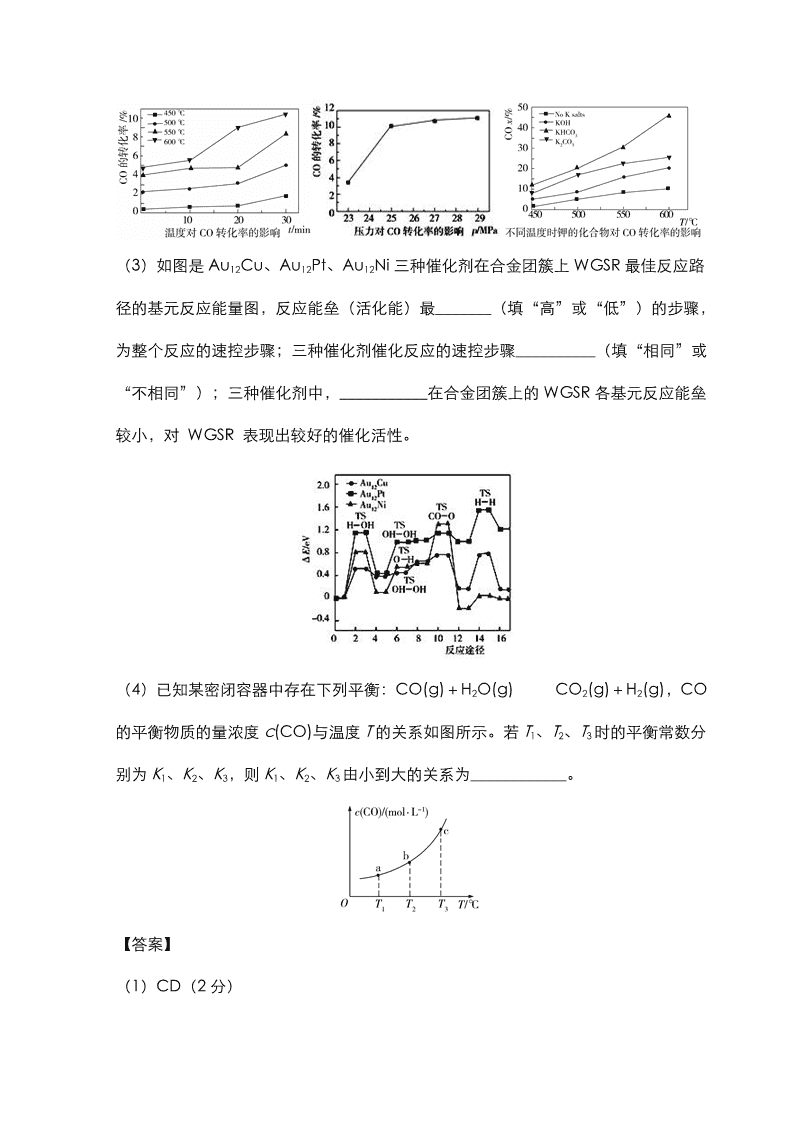
(3)如图是 Au12Cu、Au12Pt、Au12Ni 三种催化剂在合金团簇上 WGSR 最佳反应路
径的基元反应能量图,反应能垒(活化能)最_______(填“高”或“低”)的步骤,
为整个反应的速控步骤;三种催化剂催化反应的速控步骤__________(填“相同”或
“不相同”);三种催化剂中,___________在合金团簇上的 WGSR 各基元反应能垒
较小,对 WGSR 表现出较好的催化活性。
(4)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g),CO
的平衡物质的量浓度 c(CO)与温度 T 的关系如图所示。若 T1、T2、T3 时的平衡常数分
别为 K1、K2、K3,则 K1、K2、K3 由小到大的关系为____________。
【答案】
(1)CD(2 分)
(2)600(1 分) KHCO3(1 分) 25(1 分)
在 23~25 MPa,随着压力的升高,CO 转化率先快速增加,但在压力达到 25 MPa
之后,CO 转化率的增加减缓(2 分)
(3)高(1 分) 不相同(1 分) Au12Cu(2 分)
(4)K3<K2<K1(3 分)
【解析】
(1)根据盖斯定律可知①ΔH=ΔH1+ΔH2+ΔH5a+ΔH7;②ΔH=ΔH1+ΔH3+ΔH5b+ΔH7;③
ΔH=ΔH1+ΔH4+ΔH5d+ΔH7;④ΔH=ΔH1+ΔH4+ΔH5c+ΔH6,E 项可由(①+③)÷2 得出。
(2)根据温度对 CO 转化率的影响图可知,600℃,CO 转化率最高,故温度选择
600 ℃;根据不同温度时钾的化合物对 CO 转化率的影响图可知,相同温度时 KHCO3
对 CO 转化率高,故选 KHCO3;根据压力对 CO 转化率的影响图可知,在 23~25 MPa,
随着压力的升高,CO 转化率先快速增加,但在压力达到 25 MPa 之后,CO 转化
率的增加减缓,综合各种因素,25 MPa 时比较经济实惠,故选择 25 MPa。
(3)反应能垒(活化能)最高的步骤,是反应最慢的步骤,也是整个反应的速控步
骤;由反应途径图可知,三种催化剂催化的反应能垒最高的步骤不一致,有前有后,
速控步骤不相同;由反应途径图可知,Au12Cu 在合金团簇上的 WGSR 各基元反应能
垒较小,对 WGSR 表现出较好的催化活性。
(4)由题图可知,温度越高平衡时 c(CO)越大,说明升高温度,平衡向逆反应方向
移动,即ΔH<0,该反应正反应是放热反应,升高温度平衡向逆反应方向移动,化学平
衡常数减小,故 K3c(SO )>c(H )=c(OH )
-72y 10
x-2y
(2)2NO+4e-=N2+2O2- 阴极发生副反应 O2+4e-=2O2-
【解析】
I.(1)标况下,5.6LCH4 物质的量为: 5.6L
22.4L/mol =0.25mol,吸收 51.5kJ 的热量,则
1mol 甲烷反应吸收热量=51.5kJ× 1mol
0.25mol =206kJ,该反应的热化学方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206 kJ/mol;
(2)在 150℃时 2L 的密闭容器中,将 2mol CH4 和 2mol H2O(g)混合,经过 15min
达到平衡,此时 CH4 的转化率为 60%,则
4 2 2CH + H O CO + 3H
( / ) 1 1 0 0 ( / ) 0.6 0.6 0.6 1.8
( / ) 0.4 0.4 0.6 1.8
mol L
mol L
mol L
起始量
转化量
平衡量
①从反应开始至平衡,用氢气的变化量来表示该反应速率 v(H2)=1.8mol/L
15min
=0.12mol•L-1•min-1;
②结合①计算得到的平衡浓度,计算得到该反应的平衡常数
K=(1.83×0.6)/(0.4×0.4)=21.87;
③A.v 逆(H2)=3v 正(CO),说明正逆反应速率相同,反应达到平衡状态,故 A 正确;
B.密闭容器中混合气体的质量和体积不变,密度始终不变,不能说明反应达到平衡
状态,故 B 错误;
C.反应前后气体物质的量增加,气体压强之比等于气体物质的量之比,密闭容器中
总压强不变,说明反应达到平衡状态,故 C 正确;
D.浓度关系和消耗量、起始量有关,c(CH4)=c(CO)不能说明反应达到平衡状态,
故 D 错误;
故答案为:AC;
(3)A.甲和丙为等效平衡,则 n2=1.6mol,但乙与甲相比,相当于增大压强,平衡
向着正向移动,则 n1>3.2,故 A 错误;
B.甲和丙达到平衡状态为相同平衡状态,氮气体积分数相同,乙相当于甲平衡状态
再加入 1mol 氮气和 3mol 氢气,增大压强平衡正向进行,氮气体积分数减小,φ甲
=φ丙>φ乙,故 B 正确;
C.乙容器中反应物浓度大于甲和丙,反应速率大,甲和丙起始浓度相同反应速率相
同,故 C 错误;
D.乙中物质浓度是甲的 2 倍,且压强大于甲,甲和丙为等效平衡,压强相同,得到
P 乙>P 甲=P 丙,故 D 正确;
故答案为:BD;
II.(1)①根据电荷守恒,c(NH4
+)+c(H+)=c(OH-)+2c(SO4
2-),混合后溶液显中性,则
c(NH4
+)=2c(SO4
2-),则 2
4 4c(NH )>c(SO )>c(H )=c(OH ) ;
②x mol•L-1 氨水中加入等体积的 y mol•L-1 硫酸得混合溶液 M 恰好显中性,则
c(NH4
+)=2c(SO4
2-)=2× y
2 mol•L-1=ymol•L-1,混合后,根据物料守恒
c(NH3•H2O)+c(NH4
+)=0.5x mol•L-1,则 c(NH3•H2O)=(0.5x-y)mol•L-1,
K=c(NH4
+)•c(OH-)/c(NH3•H2O)=y×1×10-7/(0.5x-y)=2y×10-7/(x-2y);
(2)①阴极:NO 得到电子生成 N2,结合守恒原则,则电极方程式为
2NO+4e-=N2+2O2-;
②消除一定量的 NO 所消耗的电量远远大于理论计算量,可能存在副反应,O2 浓度约
为 NO 浓度的 10 倍,氧气易得到电子生成 O2-,电极方程式为:O2+4e-=2O2-。
4.煤燃烧排放的烟气含有 SO2 和 NOx,大量排放烟气形成酸雨、污染大气,因此对烟气
进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用 CO 脱硫
(1)工业生产可利用 CO 气体从燃煤烟气中脱硫,则 25℃时 CO 从燃煤烟气中脱硫
的热化学方程式 2CO(g)+SO2(g)⇌2CO2(g)+S(s)的焓变△H=_____________。
25℃,100kPa 时,由元素最稳定的单质生成 1mol 纯化合物时的反应热称为标准摩
尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 CO(g) CO2(g) SO2(g)
标准摩尔生成焓
∆fHm(25℃)/kJ∙mol-1
-110.5 -393.5 -296.8
(2)在模拟脱硫的实验中,向多个相同的体积恒为 2L 的密闭容器中分别通入 2.2mol
CO 和 1mol SO2 气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。
①在实验 b 中,40 min 达到平衡,则 0~40 min 用 SO2 表示的平均反应速率 v(SO2)
=_______。
②与实验 a 相比,实验 b 可能改变的条件为_______________,实验 c 可能改变的条
件为_________________。
Ⅱ.利用 NH3 脱硝
(3)在一定条件下,用 NH3 消除 NO 污染的反应原理为:4NH3(g)+6NO(g)⇌5N2(g)
+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3 与 NO 的物质的量之比分
别为 X、Y、Z(其中 X”“<”或“=”
下同);平衡时 CO2 的浓度 c(Ⅰ)________c(Ⅱ)。
②对反应Ⅰ,在其他条件不变下,若 30 min 时只改变温度为 T2 ℃,再次平衡时 H2
的物质的量为 2.5 mol,则 T1________T2(填“>”“<”或“=”)。
③若 30 min 时只向容器中再充入 1 mol H2(g)和 1 mol H2O(g),则平衡________移
动(填“正向”“逆向”或“不”)。
(3)研究人员发现,将煤炭在 O2/CO2 的气氛下燃烧,能够降低燃煤时 NO 的排放,
主要反应为:2NO(g)+2CO(g)=N2(g)+2CO2(g)。在一定温度下,于 2 L 的恒容密
闭容器中充入 0.1 mol NO 和 0.3 mol CO 发生该反应,如图为容器内的压强(p)与起
始压强(p0)的比值(p/p0)随时间的变化曲线。
①0~5 min 内,该反应的平均反应速率 v(NO)=________;平衡时 N2 的产率为
________。
②若 13 min 时,向该容器中再充入 0.06 mol CO2,15 min 时再次达到平衡,此时容
器内 p / 0p 的比值应在图中 A 点的________(填“上方”或“下方”)。
【答案】
(1)-(a+b)kJ/mol
(2)①< > ② > ③正向
(3)①6×10-3 mol/(L·min 80% ② 上方
【解析】
(1)已知:i:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1=-a kJ/mol
ii:CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+b kJ/mol
iii:CO(g)+2H2(g) CH3OH(g) ΔH3
根据盖斯定律可知 i-ii 即得到 CO(g)+2H2(g) CH3OH(g)ΔH3=-
(a+b)kJ/mol。
(2)①正反应放热,反应 I 是恒温恒容容器,反应Ⅱ绝热恒容,图表中反应Ⅱ若恒温
恒容达到相同平衡状态,Ⅱ为逆向恒容绝热,温度降低,平衡正向进行,平衡常数增
大,所以达到平衡后,反应Ⅰ、Ⅱ对比:平衡常数 K(Ⅰ)<K(Ⅱ),平衡时 CO2 的浓度
c(Ⅰ)>c(Ⅱ)。
②对反应Ⅰ,根据表中数据可知平衡时氢气的物质的量是 3mol,在其他条件不变下,
若 30 min 时只改变温度为 T2 ℃,再次平衡时 H2 的物质的量为 2.5 mol,说明平衡正
向进行温度降低,则 T1>T2。
③根据表中数据可知反应Ⅰ中平衡时二氧化碳、氢气、甲醇、水蒸气浓度分别是
(mol/L)0.5、1.5、0.5、0.5,则该温度下平衡常数为 3 3
0.5 0.5 0.5
0.5 1.5 1.5K 。若 30 min
时只向容器中再充入 1 mol H2(g)和 1 mol H2O(g),浓度熵为 3
1 0.5
0.5 2Q K
< ,则平
衡正向移动。
(3)①根据图像可知 5min 时混合气体的物质的量是 0.4mol×0.925=0.37mol,物
质的量减少 0.03mol,根据方程式 2NO(g)+2CO(g)=N2(g)+2CO2(g)可知消耗 NO
是 0.06mol,浓度是 0.03mol/L,所以 0~5 min 内,该反应的平均反应速率 v(NO)
=0.03mol/L÷5min=6×10-3 mol/(L·min);同理可计算平衡时气体的物质的量是
0.4mol×0.9=0.36mol,减少 0.04mol,所以生成氮气是 0.04mol,理论上生成氮气
是 0.05mol,则平衡时 N2 的产率为 0.04 100%=80%0.05
。
②若 13 min 时,向该容器中再充入 0.06 mol CO2,若平衡不移动,则
0
0.42 1.050.4
p
p
。
增大生成物浓度平衡逆向进行,混合气体的物质的量增大,则再次达到平衡,此时容
器内 p / 0p 的比值应在图中 A 点的上方。
【点睛】
(2)①是解答的易错点和难点,明确等效平衡的含义和反应Ⅱ中从生成物开始建立
平衡是解答的关键。
6.CO2 催化加氢制甲醇,是极具前景的温室气体资源化研究领域。在某 CO 催化加氢制
甲醇的反应体系中,发生的主要反应有:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) CH3OH(g) △H3
(1)△H3________ kJ·mol-1
(2)5MPa 时,往某密闭容器中按投料比 n(H2):n(CO2)=3:1 充入 H2 和 CO2。
反应达到平衡时,测得各组分的物质的量分数随温度变化的曲线如图所示。
①体系中 CO2 的物质的量分数受温度的影响不大,原因
是 。
②250℃时,反应 ii 的平衡常数____1(填“>”“<”或“=”)。
③下列措施中,无法提高甲醇产率的是____(填标号)。
A 加入适量 CO B 增大压强 C 循环利用原料气 D 升高温度
④如图中 X、Y 分别代表 (填化学式)。
(3)反应 i 可能的反应历程如下图所示。
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单
位:eV)。其中,TS 表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为 。
②相对总能量 E= _(计算结果保留 2 位小数)。(已知:
leV=1.6×10-22kJ)
(4)用电解法也可实现 CO2 加氢制甲醇(稀硫酸作电解质溶液)。电解时,往电解
池的____极通入氢气,阴极上的电极反应为 。
【答案】
(1)-90.6
(2)①温度改变时,反应 i 和反应 ii 平衡移动方向相反 ②<
③ D ④ CO、CH3OH
(3)HCOOH*+2H2(g)=H2COOH*+3/2H2 -0.51
(4)阳 CO2+6e-+6H+=CH3OH+H2O
【解析】
(1)已知:
i.CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.4kJ·mol-1
ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.2kJ·mol-1
ⅲ.CO(g)+2H2(g) CH3OH(g) △H3
根据盖斯定律可知反应 i-ii 可得反应 iii,所以
△H3=△H1-△H2=-49.4kJ/mol-41.2kJ/mol=-90.6kJ/mol;
(2) △H1<0,△H3<0,即生成甲醇的反应均为放热反应,所以温度升高平衡时甲
醇的物质的量分数应减小,△H2>0,生成 CO 的反应为吸热反应,所以随温度升高
CO 平衡时的物质的量分数会变大,二者共同作用导致水蒸气减小幅度小于甲醇,所
以 Z 代表 H2O,Y 代表 CH3OH,X 代表 CO。
①依据主要反应的化学方程式可知,反应 i 消耗 CO2,反应 ii 逆向产生 CO2,最终体
系内 CO2 的物质的量分数与上述两个反应进行的程度相关。由于△H1<0 而△H2>0,
根据勒夏特列原理,温度改变时,反应 i 和反应 ii 平衡移动方向相反,且平衡移动程
度相近,导致体系内 CO2 的物质的量分数受温度的影响不大;
②反应 ii 平衡常数 K=
2
2 2
CO H O
CO H
c c
c c ,该反应前后气体体积计量数之和不变,所以可以用
物质的量分数来代表浓度估算 K 值,据图可知 250℃时,CO2 与 H2 的物质的量分数
大于 CO 和 H2O 的物质的量分数,所以 K<1;
③A. 加入适量 CO,促使反应 iii 平衡正向移动,产生更多的 CH3OH,而反应 ii 平衡逆
向移动,又可减少CO2转化为CO,使更多的CO2通过反应i转化为CH3OH,故CH3OH
产率提高,A 项正确;
B. 增大压强,有利于反应 i 和 iii 的平衡正向移动,而对反应 ii 无影响,B 项正确;
C. 循环利用原料气能提高 CO2 的转化率,使 CH3OH 的产率提高,C 项正确;
D. 由图可知,升温,CH3OH 的物质的量分数下降,产率降低,D 项错误;
综上所述选 D;
④根据分析可知 X 代表 CO,Y 代表 CH3OH;
(3)①生成 CH3OH 的决速步骤,指反应历程中反应速率最慢的反应。速率快慢则由
反应的活化能决定,活化能越大,反应速率越慢。仔细观察并估算表中数据,找到活
化能(过渡态与起始态能量差)最大的反应步骤
为:HCOOH*+2H2(g)=H2COOH*+3/2H2,Ea=-0.18-(-1.66)= 1.48 eV;
②反应 i 的△H1= -49.4kJ/mol,指的是 1mol CH3OH(g)和 1molH2O(g)的总能量与 1
mol CO2(g)和 3mol H2(g)的总能量之差,而反应历程图中的 E 表示的是 1 个 CH3OH
分子和 1 个 H2O 分子的相对总能量与 1 个 CO2 分子和 3 个 H2 分子的相对总能量之差
(单位为 cV),且将起点的相对总能量设定为 0。所以,作如下换算即可求得相对总能
量 E:
E= 1
221.6 10A
H
N = 23 22
49.4
6.02 10 1.6 10
=-0.51eV;
(4)因为电解过程 CO2 被还原为 CH3OH,H2 应发生氧化反应,故氢气通入阳极附
近溶液中;而阴极上 CO2 转化为 CH3OH,碳元素从+4 价降为-2 价,电解质溶液为
硫酸,所以电极方程式为:CO2+6e-+6H+=CH3OH+H2O。
【点睛】
解答第 3 题第 1 小问时要注意框图中最后一步并非产生 CH3OH 的过程,而是已
经生成的 CH3OH 分子从催化剂表面解吸附的过程。
7.含氮化合物对环境、生产和人类生命活动等具有很大的影响。请按要求回答下列问题:
(1)利用某分子筛作催化剂,NH3 可脱除工厂废气中的 NO、NO2,反应机理如图所
示。A 包含的物质为 H2O 和 (填化学式)。
(2)研究氮氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(g)=NaNO3(g)+ClNO(g) ΔH1<0
②2NO(g)+Cl2(g)=2ClNO(g) ΔH2<0
则 4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g)的ΔH= (用
ΔH1 和ΔH2 表示)。
若反应①在绝热密闭容器中进行,实验测得 NO2(g)的转化率随时间的变化示意图如
图所示,NO2(g)的转化率α(NO2)在 t3-t4 时间降低的原因
是 。
(3)工业上利用氨气生产氢氰酸(HCN)的反应为 CH4(g)+NH3(g) HCN(g)+3H2(g)
ΔH>0。在一定温度下,向 2L 密闭容器中加入 nmolCH4 和 2molNH3 平衡时 NH3 体积
分数随 n 变化的关系如图所示。
a 点时,CH4 的转化率为___%;平衡常数:K(a)___K(b)(填“>”“=”或“<”)。
(4)肌肉中的肌红蛋白(Mb)与 O2 结合生成 MbO2,其反应原理可表示为
Mb(aq)+O2(g) MbO2(aq),该反应的平衡常数可表示为 K= 2
2
c(MbO )
c(Mb) p(O ) ,在一定
条件下达到平衡时,测得肌红蛋白的结合度(α)[α= 2c(MbO )
c(Mb)
生产的
初始的 ×100%]与 p(O2)
的关系如图所示。研究表明正反应速率 V 正=k 正·c(Mb)·p(O2),逆反应速率 V 逆=k
逆·c(MbO2)(其中 k 正和 k 逆分别表示正反应和逆反应的速率常数)。
①试写出平衡常数 K 与速率常数 k 正、k 逆的关系式:K= (用含有 k 正、k 逆的
式子表示)。
②试求出图中 c(4.50,90)点时,上述反应的平衡常数 K= kPa-1。已
知 k 逆=60s-1,则速率常数 k 正= s·kPa-1。
【答案】
(1)N2
(2)2ΔH1-ΔH2
因反应为放热反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,
t3-t4 时间段温度升高使平衡逆向移动,转化率降低
(3)25 =
(4)①
k
k
正
逆
② 2 120
【解析】
(1)由图示可得到方程[(NH4)2(NO2)]2++NO===[(NH4)(HNO2)]++A+H+,根据化学反
应前后原子种类和数目不变可知,A 为 H2O 和 N2,故答案为:N2;
(2)根据盖斯定律,由反应①×2-②可得
4NO2(g)+2NaCl(g)=2NaNO3(g)+2NO(g)+Cl2(g),则ΔH=2ΔH1-ΔH2,因反应为放热
反应且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4 时间段温度
升高使平衡逆向移动,NO2 的转化率降低,故答案为:2ΔH1-ΔH2;因反应为放热反应
且反应容器为绝热容器,随着反应正向进行,体系的温度升高,t3-t4 时间段温度升高
使平衡逆向移动,转化率降低;
(3)a 点时,n(CH4)=2mol,平衡时 NH3 的体积分数为 30%,设转化的 CH4 的物质
的量为 x,列三段式有:
4 3 2
mol 2 2 0
CH g +NH
0
mol x x x 3x
mol 2-x 2-x x 3x
g HCN g +3H g
起始
转化
平衡
则有 2-x 30%4 2x
,解得 x=0.5,则 CH4 的转化率为 0.5 100% 25%2
,由于 a 点和 b
点的温度相同,所以 K(a)=K(b),故答案为:25%;=;
(4)①已知正反应速率 v 正=k 正·c(Mb)·P(O2),逆反应速率 v 逆=k 逆·c(MbO2),
平衡时,v 正=v 逆,则 k 正·c(Mb)·P(O2)= k 逆·c(MbO2),即
2
2
c MbOk =k c Mb P O K正
逆
,
故答案为:
k
k
正
逆
;
②由图可知,c 点时,P(O2)=4.5kPa, 2c MbOα= 100%=90%c(Mb)
生成的
初始的 ,则生成的
c(MbO2)=0.9c(Mb)初始,平衡时 c(Mb)=0.1 c(Mb)初始,则
2 -1
2
0.9c Mbc MbO= = =2kPac Mb P O 0.1c Mb 4.5kPaK
初始
初始
,已知 K 逆=60s-1,又
k = =2k K正
逆
,则
速率常数 k 正=120s-1·kPa-1,故答案为:2;120。
8.乙烯是一种重要的化工原料,可由乙烷为原料制取,回答下列问题。
(1)传统的热裂解法和现代的氧化裂解法的热化学方程式如下:
①C2H6(g)=C2H4(g)+H2(g) ΔH1=+136kJ·mol-1
②C2H6(g)+ 1
2 O2(g)=C2H4(g)+H2O(g) ΔH2=-110kJ·mol-1
已知反应相关的部分化学键键能数据如下:
化学键 H-H(g) H-O(g) O=O
键能(kJ·mol-1) 436 x 496
由此计算 x= ,通过比较ΔH1 和ΔH2,说明和热裂解法相比,氧化裂
解法的优点是 (任写一点)。
(2)乙烷的氧化裂解反应产物中除了 C2H4 外,还存在 CH4、CO、CO2 等副产物(副
反应均为放热反应),图甲为温度对乙烷氧化裂解反应性能的影响。乙烷的转化率随温
度的升高而升高的原因是 ,反应的最佳温度为
(填序号)。
A.700℃ B.750℃ C.850℃ D.900℃
[乙烯选择性= 2 4
2 4 4 2
n(C H )
n(C H )+n(CH )+n(CO)+n(CO ) ;乙烯收率=乙烷转化率×乙烯选择性]
(3)烃类氧化反应中,氧气含量低会导致反应产生积炭堵塞反应管。图乙为 2 6
2
n(C H )
n(O )
的值对乙烷氧化裂解反应性能的影响。判断乙烷氧化裂解过程中 2 6
2
n(C H )
n(O ) 的最佳值
是 ,判断的理由是 。
(4)工业上,保持体系总压恒定为 100kPa 的条件下进行该反应,通常在乙烷和氧气
的混合气体中掺混惰性气体(惰性气体的体积分数为 70%),掺混惰性气体的目的
是 。反应达平衡时,各组分的体积分数如下表:
组分 C2H6 O2 C2H4 H2O 其他物质
体积分数/% 2.4 1.0 12 15 69.6
计算该温度下的平衡常数:Kp= (用平衡分压代替平衡浓度,平衡分压=总
压×体积分数)。
【答案】
(1)465 氧化裂解反应是放热反应,节约能源(或氧化裂解反应热力学趋势上大)
(2)温度升高,反应速率加快,转化率升高 C
(3)2.0 比值小于 2.0 时,乙烯的收率降低;比值大于 2.0 时,乙烯的收率并未
增加且产生更多的积炭,堵塞反应管
(4)正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器体积,降
低分压,有利于平衡正向移动 75(kPa)0.5
【解析】
(1)根据盖斯定律,②−①得到:H2(g)+ 1
2 O2(g)═H2O(g) △H=−246kJ/mol,根
据键能关系△H=反应物的总键能−生成物的总键能=436+496/2−2x=−246,x=
465;由热化学方程式可以看出,热裂解法是吸热反应,需要消耗能源,氧裂解法是
放热反应,不需要从外界得到能量,故答案为:465;氧化裂解反应是放热反应,节
约能源(或氧化裂解反应热力学趋势上大);
(2)由图可知,随温度的升高,乙烷的转化率在升高,考虑化学反应速率的影响因
素,温度越高,反应速率越快;由图,要乙烷的转化率尽可能高,而副产物又相对较
少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应下温度在 850 左右,
故答案为:温度升高,反应速率加快,转化率升高;C;
(3)由(2)分析可知,我们要选择乙烯收率较高的点,在图 2 中,比值小于 2 时,
乙烯收率随比值增大在上升,比值大于 2 时,乙烯的收率并未增加,并且氧含量值在
降低,会造成积炭,故答案为:2.0;比值小于 2.0 时,乙烯的收率降低;比值大于
2.0 时,乙烯的收率并未增加且产生更多的积炭,堵塞反应管;
(4)C2H6(g)+ 1
2 O2(g)=C2H4(g)+H2O(g)反应是体积在增大的反应,充入惰性气
体,总压恒定,分压就降低了,压强降低会促使反应向体积增大的方向移动,即正向
移动。根据平衡常数的表达式 Kp=
2 4
2
2
2
1
2 6(C H ) )
H O
O
C
(
H
P P
P P
=75(kPa)0.5,故答案为:
75(kPa)0.5。
【点睛】
解答(1)关键在于考查断键吸热,成键放热的知识;利用反应速率的影响因素来分
析实践生活中最佳的反应条件,本题主要考虑温度,化学反应速率常数的表达式要转
变成用分压来表示。
9.有效去除大气中的 NOx(主要是 NO 和 NO2)是环境保护的重要课题。
(1)用 Pl-g-C3N4 光催化氧化法脱除 NO 的过程如图-1 所示。在酸性水溶液中,光
催化脱除原理和电化学反应原理类似。g-C3N4 端的反应:O2+2H++2e-=H2O2,Pl 端
的反应: 。
(2)次氯酸盐脱除 NO 的主要过程如下:
①NO+HClO=NO2+HCl
②NO+NO2+H2O 2HNO2
③HClO+HNO2=HNO3+HCl
下列分析正确的是___。
a.烟气中含有的少量 O2 能提高 NO 的脱除率
b.NO2 单独存在时不能被脱除
c.脱除过程中,次氯酸盐溶液的 pH 下降
(3)NaClO 溶液能有效脱除 NO。25℃时,NO 的脱除率随 pH 的变化如图-2 所示;
pH=4 时,NO 的脱除率随温度的变化如图-3 所示。
①25℃时,随着 pH 降低,NO 的脱除率增大的原
因: 。
②pH=4 时,60~80℃NO 的脱除率下降的原
因: 。
(4)一定条件下,将一定浓度 NOx(NO2 和 NO 的混合气体)通入 Ca(OH)2 悬浊液
中,改变 2n(NO )
n(NO) ,NOx 的去除率如图-4 所示。
已知:NO 与 Ca(OH)2 不反应;
NOx 的去除率=1- 2 x
2 x
Ca(OH) NO
Ca(OH) NO
从 悬浊液中逸出的 的物质的量
通入 悬浊液中 的物质的量 ×100%
① 2n(NO )
n(NO) 在 0.3-0.5 之间,NO 吸收时发生的主要反应的离子方程式
为: 。
②当 2n(NO )
n(NO) 大于 1.4 时,NO2 去除率升高,但 NO 去除率却降价。其可能的原因
是 。
③O3 与 NO 反应的方程式为:NO+O3=NO2+O2,(该条件下不考虑 O2 与 NO 的反
应)。保持 NO 的初始浓度不变,改变 n(O3)/n(NO),将反应后的混合气体通入
Ca(OH)2 悬浊液中吸收。为节省 O3 的用量,又能保持 NOx 总去除效果好,则 3n(O )
n(NO)
合适的值范围为 。(保留两位小数)
【答案】
(1)NO−2e-+H2O=2H++NO2
(2) ac
(3)pH 降低,ClO-+H+=HClO,溶液中 c(HClO)增大
HClO 受热分解,溶液中 c(HClO)减小
(4)①NO+NO2+Ca(OH)2=Ca2++2NO2
-+H2O
②NO2 量太多,剩余的 NO2 和水反应生成 NO 逸出,导致 NO 去除率降低
③0.55~0.58
【解析】
(1)g-C3N4 端得电子发生还原反应,生成过氧化氢,P1 端 NO 失电子变成 NO2,
这样左边就出现了正电荷,右边加 H+,结合原子守恒,左边应加 H2O,所以 P1 端的离
子方程式为:NO−2e-+H2O=2H++NO2,故答案为:NO−2e-+H2O=2H++NO2;
(2)a.从给出的条件看,次氯酸盐脱除 NO 是先将一部分 NO 氧化成 NO2 才脱出
的,O2 和 NO 反应生成 NO2,就省了第一步了,所以烟气中含有的少量 O2 能提高
NO 的脱除率,a 正确;
b.从原理上看,氮氧化物转换为 HNO3 就被脱出了,NO2 单独存在时能和水反应生
成 HNO3 和 NO,有一定的脱出率,b 错误;
c.次氯酸盐水解显碱性,从原理来看,最后生成硝酸和 HCl,pH 下降,c 正确;
故答案为:ac;
(3)①pH 降低,c(H+)增大,产生更多的 HClO,所以 NO 的脱除率增大,故答案
为:pH 降低,ClO-+H+=HClO,溶液中 c(HClO)增大;
②HClO 会分解,温度太高,HClO 分解得太多,溶液中 HClO 浓度减小了,故答案
为:HClO 受热分解,溶液中 c(HClO)减小;
(4)①NO 和 Ca(OH)2 不反应,所以反应物有 NO、NO2 和 Ca(OH)2,根据氧化还
原规律,产物为 Ca(NO2)2 和水,所以离子方程式为:
NO+NO2+Ca(OH)2=Ca2++2NO2
-+H2O,故答案为:
NO+NO2+Ca(OH)2=Ca2++2NO2
-+H2O;
②当 2n(NO )
n(NO) 太大,NO2 量太多,吸收不完,有一部分 NO2 就和水反应生成硝酸和
NO,这样就导致 NO2 去除率升高,但 NO 去除率却降价,故答案为:NO2 量太多,
剩余的 NO2 和水反应生成 NO 逸出,导致 NO 去除率降低;
③从图上看 NOx 总去除效果最好时, 2n(NO )
n(NO) 介于 1.2 到 1.4 之间,设 NO 的物质量
为 1,那么则 NO2 的物质的量为 1.2 介于 1.4 之间,由 NO+O3=NO2+O2 可知,此时
消耗 O3 和 NO 的量均为 1.2 到 1.4 之间,所以 O3 的量为 1.2-1.4,NO 的量为(1.2+1)
到(1.4+1)之间,即 3n(O )
n(NO) 在 1.2
1.2+1 到 1.4
1.4+1 ,即 0.55 到 0.58 之间,故答案为:
0.55~0.58。
【点睛】
本题的(4)③采用设“1”法可将计算简单化。
10.I.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲
烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1
①
CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其
原理为 N2 (g)+3H2 (g) 2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始 N2、H2 分别为 0.1 mol、0.3 mol
时,平衡后混合物中氨的体积分数(φ)如下图所示。
①其中,p1、p2 和 p3 由大到小的顺序是____________,该反应ΔH _______0(填
“>”“<”或“=”)。
②若分别用 vA(N2)和 vB(N2)表示从反应开始至达平衡状态 A、B 时的化学反应速率,
则 vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在 250 ℃、p1 为 105 Pa 条件下,反应达到平衡时容器的体积为 1 L,则该条件
下 B 点 N2 的分压 p(N2)为_______Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O4
2-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO,装置
如图所示:
(3)①阴极区的电极反应式为___________。
②NO 吸收转化后的主要产物为 NH4
+,若通电时电路中转移了 0.3 mol e-,则此通电
过程中理论上吸收的 NO 在标准状况下的体积为________mL。
Ⅳ.(4)常温下,将 a mol·L-1 的醋酸与 b mol·L-1Ba(OH)2 溶液等体积混合,充分
反应后,溶液中存在 2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数
Ka=___________(用含 a 和 b 的代数式表示)。
【答案】
(1)高温 +247.1
(2)①p1>p2>p3 < ②< ③8.3×103
(3)①2SO3
2-+4H++2e-=S2O4
2-+2H2O ②1344
(4)
-72b 10
a-2b
【解析】
I.(1)水蒸气重整:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9 kJ·mol
-1①,△H>0,△S>0,满足△H−T△S<0,则需要高温。
水蒸气重整 CH4(g)+H2O(g) CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1①
CO(g)+H2O(g) CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1②
二氧化碳重整:CH4(g)+CO2(g) 2CO(g)+2H2(g) ΔH3③
盖斯定律计算①-②得到反应③的热化学方程式 CH4(g)+CO2(g)⇌
2CO(g)+2H2(g)△H3=+247.1KJ/mol,
故答案为:高温;+247.1;
II.(2)①由 N2+3H2⇌2NH3 可知,增大压强,平衡正向移动,由图象可知在相同温度
下,平衡后混合物中氨的体积分数(φ)为 p1>p2>p3,因此压强关系是 p1>p2>p3,压
强相同时,升高温度平衡逆向移动,故温度越高平衡混合物中氨的体积分数越小,故
反应热小于零,
故答案为:p1>p2>p3;<;
②温度越,压强越大,反应速率越大,p1>p2,由图可知,B 对应的温度、压强大,则
反应速率大,
故答案为:<;
③③用三段式解,设转化的氮气的物质的量为 x:
2 2 3
(mol) 0.1 0.3 0
(mol) x 3x 2x
(mo
N +
l)
3
0.1-x 0.3-3x 2x
H 2NH
开始
转化
平衡
2x
0.1-x+0.3-3x+2x =0.667,x=0.08。
若在 250℃、p1 为 105Pa 条件下,反应达到平衡时容器的体积为 1L,则该条件下 B
点 N2 的分压 p(N2)= 510 Pa 0.1-0.08
0.4-2 0.08
=8.3×103,
故答案为: 8.3×103;
III.(3)①由图可知,阴极区通入液体主要含 SO3
2−,流出液主要含 S2O4
2−,所以阴极
区电极反应式为 SO3
2-+4H++2e-=S2O4
2-+2H2O,
故答案为:SO3
2-+4H++2e-=S2O4
2-+2H2O;
②由于 NO 吸收转化后的主要产物为 NH4
+,NO
∼
NH4
+
∼
5e−,若电路中转移 0.3mole−,
消耗 NO0.06mol,标准状况下体积为=0.06mol×22.4L/mol=1.344L=1344mL,
故答案为:1344。
Ⅳ. (4)反应平衡时,2c(Ba2+)=c(CH3COO−)=bmol/L,据电荷守恒,溶液中
c(H+)=c(OH−)=10−7mol/L,溶液呈中性,醋酸电离平衡常数依据电离方程式写出 K=
-
3
+
3 )c(c(CH COO
CH
H )
COOH =
7b 10
a -b2
=
-72b 10
a-2b
;
用含 a 和 b 的代数式表示该混合溶液中醋酸的电离常数为
-72b 10
a-2b
,
故答案为:
-72b 10
a-2b
。
11.I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) ∆H=x kJ/mol。其
反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知 O2(g) O2(aq) ∆H=y kJ/mol,Na2SO3 溶液与 O2(g)反应的热化学方
程式为___________________。
(2)291.5 K 时,1.0 L 溶液中 Na2SO3 初始量分别为 4、6、8、12 mmol,溶解氧浓度
初始值为 9.60 mg/L,每 5 s 记录溶解氧浓度,实验结果如图所示。当 Na2SO3 初始量为
12 mmol,经过 20 s 溶解氧浓度降为 6.40 mg/L,则 0~20s 内 Na2SO3 的平均反应速率
为_______mol/(L·s)。
(3)为确定贫氧区速率方程 v=k·ca(SO3
2-)·cb(O2)中的 a、b 的值(取整数),分析实
验数据。
c(Na2SO3)×103 3.65 5.65 7.65 11.65
v×106 10.2 24.4 44.7 103.6
①当溶解氧浓度为 4.0 mg/L 时,c(SO3
2-)与速率数值关系如表(甲)所示,则 a=____。
②当溶解氧浓度小于 4.0mg/L 时,图中曲线皆为直线,Na2SO3 氧化速率与溶解氧浓度
无关,则 b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知 a1
2 2 1
Ek 1 1ln =- ( - )k R T T ,R 为
常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 速率方程 K
(291.5K)
k
k
(297.0 )
富氧区
v=k·c (SO3
2-)·c
(O2)
1.47
贫氧区
v=k·ca
(SO3
2-)·cb(O2)
2.59
II. (5)在容积固定的密闭容器中,起始充入 0.2 mol SO2 和 0.1 mol O2,反应体系起始
总压强 0.1MPa。反应在一定温度下达到平衡时 SO2 的转化率为 90%。该反应的压强
平衡常数 Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用 SO2 和 O2 来制备硫酸,该电池用多孔材料作电极。请写
出该电池负极反应式_________________________。
【答案】
(1)2Na2SO3(aq) +O2(g)=2Na2SO4(aq) ∆H=(x+y)kJ/mol
(2)1×10-5
(3)2 0
(4)<
(5)24300MPa-1
(6) 2 +
2 2 4SO 2 2H O SO 4He
【解析】
(1) 2Na2SO3(aq) +O2 (aq)=2Na2SO4(aq) ∆H=x kJ/mol ①;
O2(g) O2(aq) ∆H=y kJ/mol②;
将方程式①+②得 2Na2SO3 (aq) +O2 (g)=2Na2SO4(aq) ∆H=(x+y)kJ/mol;
(2) 0~20s 内溶解氧浓度变化量=(9.60-6.40)mg/L=3.20mg/L=3.20×10-3g/L,则
△c(O2)=
33.20 10 g
32g
L
/mol
/
=10-4mol/L,根据方程式得
△c(Na2SO3)=2△c(O2)=2×10-4mol/L,0~20s 内 Na2SO3 的平均反应速率
v=
42 10 mo
20
l L
s
/ =1×10-5mol•L-1•s-1;
(3)①当溶解氧浓度为 4.0 mg/L 时,c(SO3
2-)与速率数值关系如表(甲)所示,v1:
v2=c1
a(SO3
2-):c2
a(SO3
2-), 24.4 5.65=10.2 3 65
a
a. ,解得 a=2;
②当溶解氧浓度小于 4.0mg•L-1 时,图中曲线皆为直线,说明该方程为一次函数,k
为常数,v 与 c(SO3
2-)有关,溶解氧浓度对 v 无影响,所以 b=0;
(4)ln 1
2
K
K 随着 Ea 的增大而增大,富氧区的 ln 1
2
K
K 较小,故 Ea(富氧区)<Ea(贫氧区);
(5)
2 2 32SO +O 2SO
0.2 0.1 0
0.18 0.09 0.18
0.02 0.01 0.18
开始
转化
平衡
设平衡时的总压强 P, 0.3 0.21=0.1 P ,P=0.07 MPa,
Kp=
2
2
0.180.07MPa 0.21 =
0.02 0.010.07MPa 0.07MPa0.21 0.21
24300MPa-1;
(6)SO2 和 O2 来制备硫酸,硫元素化合价升高,负极为 SO2 失电子生成硫酸根离子,
反应的离子方程式是 2 +
2 2 4SO 2 2H O SO 4He 。
12.氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中
NO 是主要成分之一。
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化
学方程式____________________。
(2)FeSO4-Na2SO3 复合吸收剂吸收烟气中的 NO,该方法利用 Fe2+易与 NO 发生络
合反应的特性,原理如下 NO+FeSO4 Fe(NO)SO4
①如图是一段时间内不同吸收剂对 NO 脱除率对比,加入 Na2SO3 溶液后,吸收效率
增强,除了 Na2SO3 也能吸收部分 NO 外,还能防氧化从而增大 Fe2+的含量,写出此
原理的离子方程式_______________________________________。
②模拟实验表明,温度过高或过低都会降低 NO 的脱除率,其原因是
________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成 NO3
-,原理如图
①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出 NO 发生反应的离子方程式____________________________。
③根据下图所示,脱 NO 过程中控制溶液 pH 在______________范围内更合理。
【答案】
(1)2C2H4+6NO2 4CO2+3N2+4H2O
(2)2Fe3++SO3
2-+H2O=2Fe3++SO4
2-+2H+
温度过低,反应速率缓慢;温度过高,NO 的溶解度降低,都会造成脱除率下
降
(3)ClO-+H2O HClO+OH- 2NO+3ClO-+2OH- 2NO3
-+3Cl-+2H2O
5—6
【解析】
(1)反应机理示意图如图所示,解吸过程反应物为 C2H4,NO2 生成物为 CO2、N2、
H2O ,写出对应化学方程式;
(2)①Na2SO3 具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防 Fe2+氧
化从而增大 Fe2+的含量;
②温度过低,反应速率缓慢,温度过高,NO 的溶解度降低;
(3)①电解食盐水,阳极失去电子,反生为 2Cl--2e-=Cl2↑,阴极得到电子,反生的
反应为 2H2O+2e-=2OH-+H2↑,总反应方程式为 Cl-+ H2O= ClO-+H2↑,ClO-会水解;
②ClO-作氧化剂,NO 为还原剂,在碱性条件下的反应为 2NO+3ClO-+2OH-
2NO3
-+3Cl-+2H2O;
③根据图分析,当 pH 介于 5-6 时,Cl 元素以 HClO 存在,此时氧化性最强。
【详解】
(1)反应机理示意图如图所示,解吸过程反应物为 C2H4,NO2 生成物为 CO2、N2、
H2O ,化学方程式为 2C2H4+6NO2 4CO2+3N2+4H2O,故答案为:
2C2H4+6NO2 4CO2+3N2+4H2O;
(2) ①Na2SO3 具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防 Fe2+
氧化从而增大 Fe2+的含量,离子方程式为 2Fe3++SO3
2-+H2O=2Fe3++SO4
2-+2H+,故
答案为:2Fe3++SO3
2-+H2O=2Fe3++SO4
2-+2H+;
②温度过低,反应速率缓慢,温度过高,NO 的溶解度降低,故答案为:温度过低,
反应速率缓慢;温度过高,NO 的溶解度降低,都会造成脱除率下降;
(3)①电解食盐水,阳极失去电子,反生为 2Cl--2e-=Cl2↑,阴极得到电子,反生的
反应为 2H2O+2e-=2OH-+H2↑,总反应方程式为 Cl-+ H2O= ClO-+H2↑,ClO-会发生
水解,方程式为 ClO-+H2O HClO+OH-,故答案为:ClO-+H2O HClO+OH
-;
②ClO-作氧化剂,NO 为还原剂,在碱性条件下的反应为 2NO+3ClO-+2OH-
2NO3
-+3Cl-+2H2O,故答案为:2NO+3ClO-+2OH- 2NO3
-+3Cl-+2H2O;
③根据图分析,当 pH 介于 5-6 时,Cl 元素以 HClO 存在,此时氧化性最强,故答案
为 5-6。
13.(1)乙基叔丁基醚(以 ETBE 表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与
异丁烯(以 IB 表示)在催化剂 HZSM-5 催化下合成 ETBE,反应的化学方程式为:
C2H5OH(g)+IB(g) ETBE(g) △H。回答下列问题:
反应物被催化剂 HZSM-5 吸附的顺序与反应历程的关系如图所示,该反应的△H=
kJ·mol-1。
反应历程的最优途径是 (填 C1、C2 或 C3)。
(2)一定条件下,用 Fe2O3、NiO 或 Cr2O3 作催化剂对燃煤烟气回收。反应为
2CO(g)+SO2(g) 2CO2(g)+S(l) ΔH=-270kJ·mol-1
①其他条件相同、催化剂不同,SO2 的转化率随反应温度的变化如图 1,Fe2O3 和 NiO
作催化剂均能使 SO2 的转化率达到最高,不考虑催化剂价格因素,选择 Fe2O3 的主要
优点是: 。
②某科研小组用 Fe2O3 作催化剂。在 380℃时,分别研究了[n(CO)∶n(SO2)]为 1∶1、
3∶1 时 SO2 转化率的变化情况(图 2)。则图 2 中表示 n(CO)∶n(SO2)=3∶1 的变化曲
线为 。
(3)已知 NO2 存在如下平衡:2NO2(g) N2O4(g) △H<0,在一定条件下 NO2
与 N2O4 的消耗速率与各自的分压(分压=总压×物质的量分数)有如下关系:
v(NO2)=k1·p2(NO2),v(N2O4)=k2·p(N2O4),相应的速率与其分压关系如图所示。
一定温度下,k1、k2 与平衡常数 Kp(压力平衡常数,用平衡分压代替平衡浓度计算)间
的关系是 k1= ;在图标出点中,指出能表示反应
达到平衡状态的点是 ,理由
是 。
(4)二氧化硫的催化氧化是工业上生产硫酸的主要反应
O2(g)+2SO2(g) 2SO3(g)。
已知:标准平衡常数 Kθ=
23
θ
22 2
θ θ
pSO[ ]p
pSO pO[ ] [ ]p p
,其中 pθ为标准压强(1×105Pa),p(SO3)、p(O2)
和 p(SO2)为各组分的平衡分压,如 p(SO3)=x(SO3)p,p 为平衡总压,x(SO3)为平衡
系统中 SO3 的物质的量分数。
SO2 和 O2 起始物质的量之比为 2:1,反应在恒定温度和标准压强下进行,SO3 的平
衡产率为ω,则 Kθ= (用含ω的最简式表示)。
【答案】
(1)-4a C3
(2)Fe2O3 作催化剂时,在相对较低的温度可获得较高的 SO2 转化率,从而节约
能源
a
(3)k1=2k2·KP BD
达到平衡时,N2O4 与 NO2 的消耗速率满足条件 v(NO2)=2v(N2O4)
(4)
2
3
(3- )
(1- )
【解析】
(1)由图可知,反应物总能量大于生成物总能量,为放热反应,则该反应的△H=—
(5—1)akJ/mol=—4 akJ/mol;活化能的大小可以反映化学反应发生的难易程度,
过渡态 1 和 2 的活化能都为 6akJ/mol,过渡态 3 的活化能为 4akJ/mol,活化能越
小,反应越容易进行,过渡态 3 的活化能最小,反应历程最优,故答案为:-4a;C3;
(2)①根据图示内容,对比 260℃时不同催化剂作用下 SO2 的转化率,可以看出 Cr2O3
作催化剂时,反应速率最快,Fe2O3 和 NiO 作催化剂均能使 SO2 的转化率达到最高,
但是 Fe2O3 作催化剂时,在相对较低温度可获得较高 SO2 的转化率,从而节约大量能
源,故答案为:Fe2O3 作催化剂时,在相对较低温度可获得较高 SO2 的转化率,从而
节约大量能源;
②n(CO):n(SO2)=2:1 时反应速率界于 n(CO):n(SO2)=3:1 和 n(CO):
n(SO2)=1:1 之间,反应速率介于二者之间,且二氧化硫的转化率和 n(CO):n
(SO2)=3:1 是相等的,Fe2O3 作催化剂时,曲线 a 符合,故答案为:a;
(3)反应的化学平衡常数 Kp= 2 4
2
2
p(N O )
p (NO ) ,当反应达到平衡时,正逆反应速率相等,NO2
与 N2O4 的消耗速率的关系为 v(NO2)=2v(N2O4),则 k1•p2(NO2)=2k2•p(N2O4),
k1=2k2·KP;满足平衡条件 v(NO2)=2v(N2O4)即为平衡点,B、D 点的压强之比
等于其反应速率之比为 1:2,所以 B、D 为平衡点,故答案为:2k2·KP;BD;
(4)设 SO2 和 O2 起始物质的量为 2mol 和 1mol,由 SO3 的平衡产率为ω可知,平
衡时 SO3 的物质的量为 2ω,由题意建立如下三段式:
2 2 3
mol
mol 2
O g +2SO g 2SO g
ω ω ω 2
mol 1- 2-2 2ω ω ω
起( ) 1 2 0
变( )
平( )
由三段式可得 p(SO3)、p(O2)和 p(SO2)分别为 2
3-
×pθ、 1-
3-
×pθ、 2-2
3-
×pθ,则标准
平衡常数 Kθ=
23
θ
22 2
θ θ
p SO[ ]p
p SO p O[ ] [ ]p p
( )
( ) ( )=
22
3-
22-2 1-
3- 3-
[ ]
[ ] [ ]
=
2
3
(3- )
(1- )
,故答案为:
2
3
(3- )
(1- )
。
【点睛】
由平衡分压等于平衡总压和物质的量分数之积和 Kθ=
23
θ
22 2
θ θ
p SO[ ]p
p SO p O[ ] [ ]p p
( )
( ) ( )可知
Kθ=
23
θ
22 2
θ θ
p SO[ ]p
p SO p O[ ] [ ]p p
( )
( ) ( )=
22
3-
22-2 1-
3- 3-
[ ]
[ ] [ ]
是解答关键,也是难点。
14.水煤气变换[CO(g)+H2O(g) CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、
制氢以及合成气加工等工业领域中。回答下列问题:
(1)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的
反应历程,如图所示,其中吸附在金催化剂表面上的物种用 标注。
该历程中决速步骤的化学方程式为 (方程式两边若
有相同物料不用约简)。水煤气变换反应的热化学方程式
为 。
(2)t1℃时,密闭容器中,通入一定量的 CO 和 H2O,发生水煤气变换反应,容器
中各物质浓度(单位:mol·L-1)变化如下表所示:
时间(min) CO H2O CO2 H2
0 0.200 0.300 0 0
2 0.138 0.238 0.062 0.062
3 c1 c2 c3 c3
4 c1 c2 c3 c3
5 0.116 0.216 0.084
6 0.096 0.266 0.104
①一定处于平衡状态的时间段为 。
②5~6min 时间段内,平衡移动方向为 (填“向左移动”或
“向右移动”),根据表中数据判断,平衡移动的原因是
(填字母编号)。
a.增加了 H2O(g)的量 b.增加氢气浓度 c.使用催化剂 d.降低温度
③t2℃时(t2>t1),在相同条件下发生上述反应,达平衡时,CO 浓度__c1(填
“>”“<”或“=”)。
(3)已知反应 Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数随温度变化情况如图所
示:
①该反应是 (填“吸热”或“放热”)反应。
②若T1时水煤气变换反应的平衡常数等于0.5,则T1时FeO(s)+H2(g) Fe(s)+H2O(g)
的平衡常数为 。
(4)水煤气可做燃料电池的燃料。一种熔融碳酸盐燃料电池的工作原理如图所示。
电极 A 上 H2 参与的电极反应为 。假设催化炉
产生的 CO 与 H2 物质的量之比为 1︰2。电极 A 处产生的 CO2 有部分参与循环利用,
其利用率为 。
【答案】
(1)COOH +H +H2O =COOH +2H +OH
CO(g)+H2O(g) CO2(g)+H2(g) H=-0.72NAeV/mol
(2) ① 3min~4min ② 向右移动 a ③ >
(3) 吸热 1
(4) H2+CO3
2--2e-=H2O+CO2 75%
【解析】
(1)起始状态反应物的相对能量为 0,最终状态生成物的相对能量为-0.72eV,反应
物的能量高于生成物的能量,水煤气变换反应为放热反应,即ΔH 小于 0。该历程中两
次能垒分别为 1.59eV-(-0.32eV)=1.91eV,1.86eV-(-0.16eV)=2.02eV,最大能垒(活
化能)E 正=2.02eV。该步骤的反应物的相对能量为-0.16eV 的物质:
COOH +H +H2O ,生成物为相对能量为 1.41eV 的物质:
COOH +2H +OH ,由此可得该步骤的化学方程式:
COOH +H +H2O =COOH +2H +OH ,水煤气变换反应的热化学方程式为
CO(g)+H2O(g) CO2(g)+H2(g) H=-0.72NAeV/mol。
(2)①从表格中数据分析,第 3~4min 时,体系中各物质的浓度不再变化,说明已
经达到平衡状态;
②5min~6min 时间段内,H2O 的浓度增大,CO 浓度减小,说明是增加了 H2O 的量,
平衡正移,故答案为:向右移动;a;
③该反应的正反应为放热反应,升高温度平衡逆向移动,CO 转化率减小,则 CO 浓
度>c1,故答案为:>;
(3)①升高温度化学平衡常数增大,说明 Fe(s)+CO2(g) FeO(s)+CO(g)为吸热反
应,故答案为:吸热;
②T1 时反应 Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数 K=2,即 c(CO)/c(CO2)=2,
若 T1 时水煤气变换反应的平衡常数等于 0.5,即 K=
2 2
2
c CO c H
c CO c H O =0.5,所以平衡时
2
2
c H O
c H =1,所以 T1 时 FeO(s)+H2(g) Fe(s)+H2O(g)的平衡常数 K=
2
2
c H O
c H =1;
(4)A 为负极,负极上 CO 和 H2 被氧化生成二氧化碳和水,则电极 A 上前去参与的
反应为:H2+CO3
2--2e-=H2O+CO2;假设催化炉产生的 CO 与 H2 物质的量分别为
1mol、2mol,电极 A 处转移电子为 6mol,产生的 CO2 为 4mol,在阴极发生的电
极反应为 O2+2CO2+4e-=2CO3
2-,当转移 6mol 电子时,参与循环反应的 CO2 为
3mol,参与循环的利用率= 3mol 100%4mol
=75% 。
15.甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的
用途和应用前景,可以用多种方法合成。
I.用 CO2 生产甲醇、乙醇
(1)已知:H2 的燃烧热为-285.8 kJ/mol,CH3OH(l)的燃烧热为-725.8kJ/mol,
CH3OH(g)=CH3OH(l) △H= -37.3 kJ/mol,则 CO2(g)+3H2(g)=CH3OH(g)+ H2O
(1) △H=____kJ/mol。
(2)将 CO2 和 H2 按物质的量之比 1:3 充入体积为 2.0L 的恒容密闭容器中反应[生成
H2O(g)],如图 1 表示压强为 0.1 MPa 和 5.0 MPa 下 CO2 转化率随温度的变化关系。
①a、b 两点化学反应速率分别用 Va、Vb,表示,则 Va ___Vb(填“大于”、“小于”
或“等于”)。
②列出 a 点对应的平衡常数表达式 K= ____________________。
(3)在 1.0 L 恒容密闭容器中投入 1 mol CO2 和 2.75 mol H2 发生反应:
CO2(g)+3H2(g) CH3OH (g)+H2O(g),实验测得不同温度及压强下,平衡时甲
醇的物质的量变化如图 2 所示,下列说法正确的是_____。
A.该反应的正反应为放热反应
B.压强大小关系为 p1<p2<p3
C.M 点对应的平衡常数 K 的值约为 1.04×10-2
D.在 p2 及 512 K 时,图中 N 点υ(正)<υ(逆)
(4)CO2 催化加氢合成乙醇的反应为:2CO2(g)+6H2(g) C2H5OH(g) +3H2O(g)
△H;m 代表起始时的投料比,即 m= 2
2
n(H )
n(CO )
①图 3 中投料比相同,温度 T3>T2>T1,则该反应的焓变△H____0(填“>”、“<”)。
②m=3 时,该反应达到平衡状态后 p(总)=20a MPa,恒压条件下各物质的物质的量
分数与温度的关系如图 4 所示,则曲线 b 代表的物质为_________(填化学式),T4
温度时,反应达到平衡时物质 d 的分压 p(d)=___________。
Ⅱ.甲醇的应用
(5)以甲醇为主要原料,电化学合成碳酸二甲酯的工作原理如图 5 所示。
离子交换膜 a为_____(填“阳膜”、“阴膜”),阳极的电极反应式为______________。
【答案】
(1)-94.3
(2) ①大于 ② K= 3 2
3
2 2
c(CH OH)c(H O)
c(CO )c (H )
(3)AC
(4)①< ② CO2 2.5a MPa
(5)阳膜 2CH3OH+CO−2e−=(CH3O)2CO+2H+
【解析】
(1)①H2(g)+ 1
2 O2(g)=H2O(l)△H=-285.8kJ/mol,
②CH3OH(g)=CH3OH(l)△H= -37.3kJ/mol,
③CH3OH(l)+ 3
2 O2(g)=CO2(g)+2H2O(l)△H=-725.8kJ/mol,
由盖斯定律①×3-③-②;可得 CO2(g)+3H2(g)=CH3OH(g)+H2O(1)
△H=-94.3kJ/mol;
(2)①a、b 两点温度相同,正反应为气体体积减小的反应,增大压强平衡正向移动,
二氧化碳转化率增大,故压强曲线 A 大于曲线 B,压强越大反应速率越快,故反应速
率 Va 大于 Vb;
②a 点发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),平衡常数表达式
K= 3 2
3
2 2
c(CH OH)c(H O)
c(CO )c (H ) ;
(3)A.由图可知,随着温度升高,平衡时甲醇的物质的量在减小,所以升温平衡向
逆反应方向移动,则正反应为放热反应,故 A 正确;
B.由图可知,作一条等温线,因为该反应为气体体积减小的反应,压强越大,平衡
时甲醇的物质的量也越大,所以 p1>p2>p3,故 B 错误;
C.由图可知,M 点对应的甲醇产量为 0.25mol,则
2 2 3 2CO g +3H g CH OH g +H O g
(mol/L) 1 2.75 0 0
(mol/L) 0.25 0.75 0.25 0.25
(mol/L) 0.75 2 0.25 0.25
始
变
平
所以 K= 3
0.25 0.25
0.75 2
=1.04×10−2;故 C 正确;
D.由图可知,在 p2 及 512K 时,N 点甲醇的物质的量还小于平衡时的量,所以应该
正向移动,则 v(正)>v(逆),故 D 错误;
答案选 AC;
(4)①由图 3 可知,相同压强下,温度越高氢气转化率越小,说明升高温度反应向
逆向移动,正反应放热,△H<0;
②温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量
增大,由图可知,根据反应计量系数关系,曲线 a 代表的物质为 H2,b 表示 CO2,c
为 H2O,d 为 C2H5OH;设开始氢气的投入量是 3nmol,则二氧化碳是 nmol,二氧
化碳的转化量是 x,
2 2 2 5 22CO g +6H g C H OH g +3H O g
(mol)
(m
n 3n 0 0
x 3x 0.5x 1.5x
n-x 3
o
n-3x 0.5x 1
l)
(mol x) .5
起
变
平
N 点 b、d 的物质的量分数相同,所以 n-x=0.5x,解得 x= 2
3 n,总物质的量是
n-x+3n-3x+0.5x+1.5x= 8
3 n,压强之比等于物质的量之比,组分平衡分压=总压×该组
分的物质的量分数,d 为 C2H5OH,达到平衡时乙醇的分压 p(乙
醇)=
n 0.5
20a MPa
n
2
3
8
3
=2.5a MPa;
(5)由图分析可知氧气得电子,发生还原反应,与氢离子结合生成水,该电极为阴
极,则氢离子要透过交换膜 a 在阴极与氧气结合,则交换膜 a 为阳离子交换膜;阳极
上是甲醇和一氧化碳反应失电子发生氧化反应,电极反应为:
2CH3OH+CO-2e−=(CH3O)2CO+2H+。