- 265.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
甘肃省武威八中2020-2021学年高一上学期第一阶段考试(10月)试卷
满分100分,考试时间100分钟
可能用到的相对原子质量:H1 O16 C12 K 39 Cu 64 Na 23 S 32 N 14 Cl 35.5
第Ⅰ卷(选择题,共60分)
一、选择题(每小题只有一个选项符合题意,每小题3分,共60分)
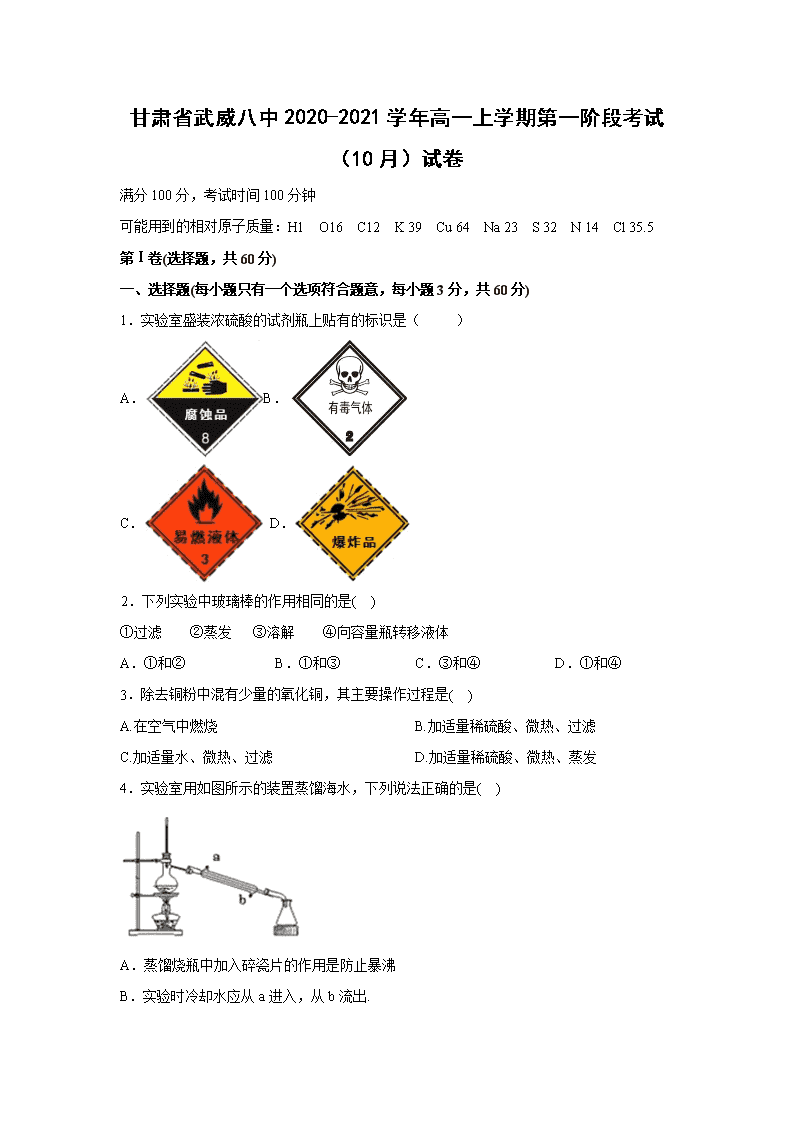
1.实验室盛装浓硫酸的试剂瓶上贴有的标识是( )
A.B.
C. D.
2.下列实验中玻璃棒的作用相同的是( )
①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
3.除去铜粉中混有少量的氧化铜,其主要操作过程是( )
A.在空气中燃烧 B.加适量稀硫酸、微热、过滤
C.加适量水、微热、过滤 D.加适量稀硫酸、微热、蒸发
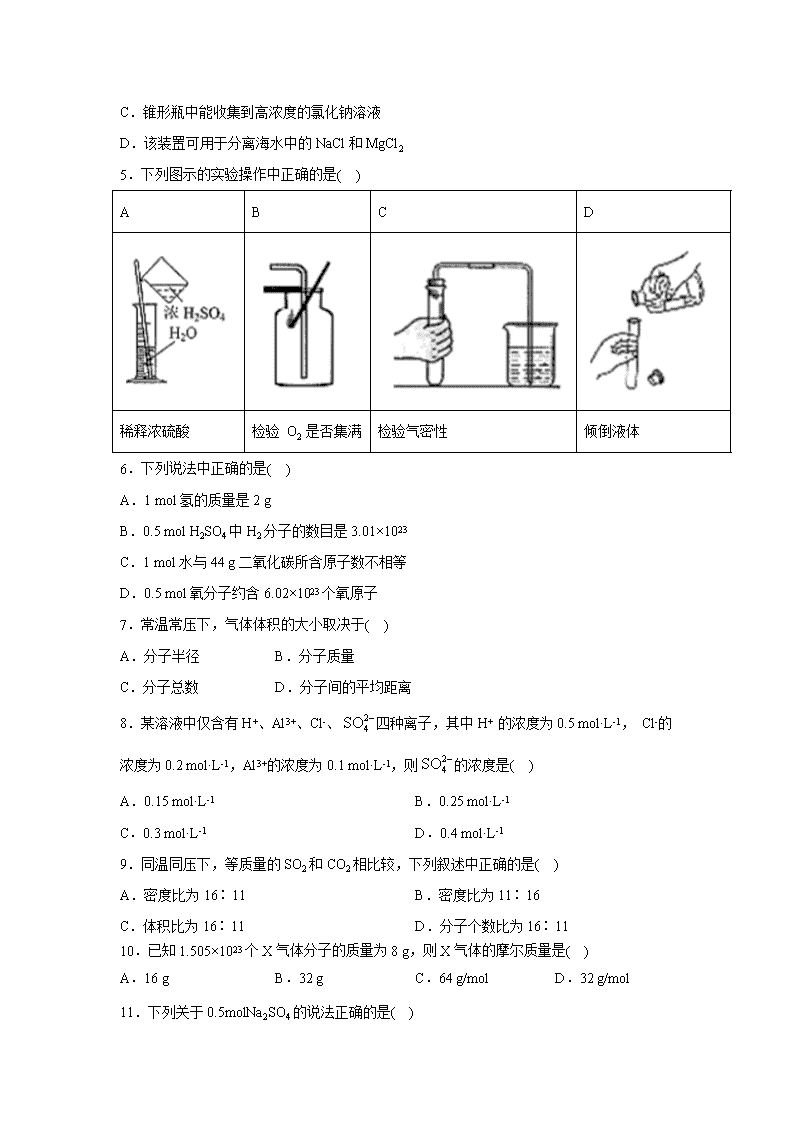
4.实验室用如图所示的装置蒸馏海水,下列说法正确的是( )
A.蒸馏烧瓶中加入碎瓷片的作用是防止暴沸
B.实验时冷却水应从a进入,从b流出.
C.锥形瓶中能收集到高浓度的氯化钠溶液
D.该装置可用于分离海水中的NaCl和MgCl2
5.下列图示的实验操作中正确的是( )
A
B
C
D
稀释浓硫酸
检验 O2 是否集满
检验气密性
倾倒液体
6.下列说法中正确的是( )
A.1 mol氢的质量是2 g
B.0.5 mol H2SO4中H2分子的数目是3.01×1023
C.1 mol水与44 g二氧化碳所含原子数不相等
D.0.5 mol氧分子约含6.02×1023个氧原子
7.常温常压下,气体体积的大小取决于( )
A.分子半径 B.分子质量
C.分子总数 D.分子间的平均距离
8.某溶液中仅含有H+、Al3+、Cl-、四种离子,其中H+ 的浓度为0.5 mol·L-1, Cl-的浓度为0.2 mol·L-1,Al3+的浓度为0.1 mol·L-1,则的浓度是( )
A.0.15 mol·L-1 B.0.25 mol·L-1
C.0.3 mol·L-1 D.0.4 mol·L-1
9.同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是( )
A.密度比为16∶11 B.密度比为11∶16
C.体积比为16∶11 D.分子个数比为16∶11
10.已知1.505×1023个X气体分子的质量为8 g,则X气体的摩尔质量是( )
A.16 g B.32 g C.64 g/mol D.32 g/mol
11.下列关于0.5molNa2SO4的说法正确的是( )
A.含有3.01×1023个SO B.含有0.5个Na2SO4
C.含有0.5molNa+ D.含有1mol氧原子
12.下列叙述中正确的是( )
A.1mol CO的质量是28g B.硝酸的摩尔质量是63g
C.2g氢气所含原子数目为1mol D.铁的摩尔质量等于铁原子的相对原子质量
13.下列说法正确的是( )
A.含58.5g NaCl的溶液中,溶质的分子数约为
B.标准状况下,22.4L水中约含个分子
C.常温常压下,22g中所含氧原子数约为
D.将40g NaOH固体溶于1L中,得到1 mol/L NaOH溶液
14.用NaCl固体配制100 mL 1.00 mol·L-1 NaCl溶液。下列图示的实验操作中,不需要进行的操作是( )
A.溶解 B.蒸发 C.转移 D.定容
15.为预防新型冠状病毒,公共场所可用0.5%的过氧乙酸溶液来消毒。实验室中用容量瓶配制一定物质的量浓度的过氧乙酸溶液,下列操作会使所配溶液浓度偏高的是( )
A.定容时水加多了,用滴管吸出溶液至刻度线
B.定容时仰视刻度线
C.没有洗涤稀释过氧乙酸的烧杯和玻璃棒
D.量取过氧乙酸液体时仰视刻度线
16.同温同压下,用等质量的Cl2、SO2、O2、H2S四种气体分别吹起四个气球,其中是由Cl2吹起的是( )
A. B. C. D.
17.下列各组物质中氧原子的物质的量相同的是 ( )
A.0.3molO2和0.3molH2O
B.0.1molH2SO4和3.6gH2O
C.0.1molMgSO4·7H2O和0.1molC12H22O11(蔗糖)
D.6.02×1023个CO2与0.1molKMnO4
18.下列溶液中Cl-的浓度与50 mL 1 mol/L的MgCl2溶液中的Cl-相等的是( )
A.100 mL 2 mol/L的NaCl溶液 B.50 mL 0.5 mol/L的AlCl3溶液
C.1 L 0.2 mol/L的KCl溶液 D.20 mL 0.5 mol/L的CaCl2溶液
19.用CuSO4·5H2O配制0.1 mol/LCuSO4水溶液,下面所列的方法正确的是( )
A.取25 g CuSO4·5H2O溶于1 L水中
B.将CuSO4·5H2O干燥去掉结晶水,取16 g溶于水制成1 L溶液
C.将25 g CuSO4·5H2O溶于水制成1 L溶液
D.取12.5 g CuSO4·5H2O溶于500 mL水中
20.为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序是( )
①过滤 ②加过量NaOH溶液 ③加适量盐酸
④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A.①④①②⑤③ B.①②⑤④①③ C.①②④⑤③ D.④②⑤
第Ⅱ卷(非选择题,共40分)
二、填空题(16分,每空2分)
21.(10分)①9.8gH2SO4的物质的量为_____mol。
②标准状况下,22.4LH2的质量为______g。
③将30mL0.5mol/LNaCl溶液加水稀释到500mL,稀释后NaCl溶液的物质的量浓度为__________mol/L。
④摩尔质量的符号为_______,单位是__________(符号)。
22.(6分)某双原子分子构成的气体,其摩尔质量为M g/mol,该气体质量为m g,阿伏加德罗常数为NA,则:
(1)该气体的物质的量为__________mol;(2)该气体在标准状况下的体积为__________L;
(3)该气体所含原子总数为__________个;
三、实验题(18分)
23.(6分)观察下列实验装置图,试回答下列问题:
(1)写出图中③实验操作的名称依次是 ______
(2)下列实验需要在哪套装置中进行(填序号):
a.从海水中提取蒸馏水: ______ ; b.分离氯化钠和水: ______ ;
c.分离碳酸钙和水: ______ ; d.分离植物油和水: ______ ;
(3)装置②中玻璃棒搅拌的目的是__________________________________;
24.(12分)实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)配制250mL 1.25mol/L的NaOH溶液
应称取NaOH的质量/g
应选用容量瓶的规格/mL
除容量瓶外还需要其它玻璃仪器
_________
_________
_________
(2)容量瓶上需标有以下五项中的_________________。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是______________(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1﹣2cm处
(4)下列配制的溶液浓度偏低的是________________________。
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水
四、计算题(6分)
25.常温下,将20.0 g质量分数为14.0%的KNO3溶液与30.0 g质量分数为24.0%的KNO3溶液混合,得到的密度为1.15 g/cm3的混合溶液。计算:
(1)混合后溶液的质量分数。
(2)混合后溶液的物质的量浓度。
(3)在1 000 g水中需溶解多少摩尔KNO3才能使其浓度恰好与上述混合后溶液的浓度相等?
【参考答案】
一、选择题(每小题3分,共60分,每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
答案
A
D
B
A
C
D
C
C
A
D
题号
11
12
13
14
15
16
17
18
19
20
答案
A
A
C
B
D
D
C
A
C
B
二、填空题
21.(10分) 0.1 2 0.03 M g/mol
22、(6分) (1) (2) (3)
三、实验题
23. (1)(1分) 蒸馏
(2)(4分) ③ ② ① ④
(3)(1分)加快蒸发速率,防止液体暴沸导致飞溅
24. (1)(6分) 12.5 250 烧杯、玻璃棒、胶头滴管
(2)(2分) ①③⑤
(3)(2分)B、C、A、F、E、D
(4)(2分)A、B、C
四、计算题
25(6分)
(1)20% (2)2.28 mol·L-1 (3)2.48 mol