- 102.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
共价键类型、杂化轨道和空间结构(学案)
知识梳理
1.σ键、π键的判断方法
(1)由轨道重叠方式判断
“头碰头”重叠为σ键,“肩并肩”重叠为π键。
(2)由共用电子对数判断
单键为σ键;双键或三键,其中一个为σ键,其余为π键。
(3)由成键轨道类型判断
s轨道形成的共价键全都是σ键;杂化轨道形成的共价键全部为σ键。
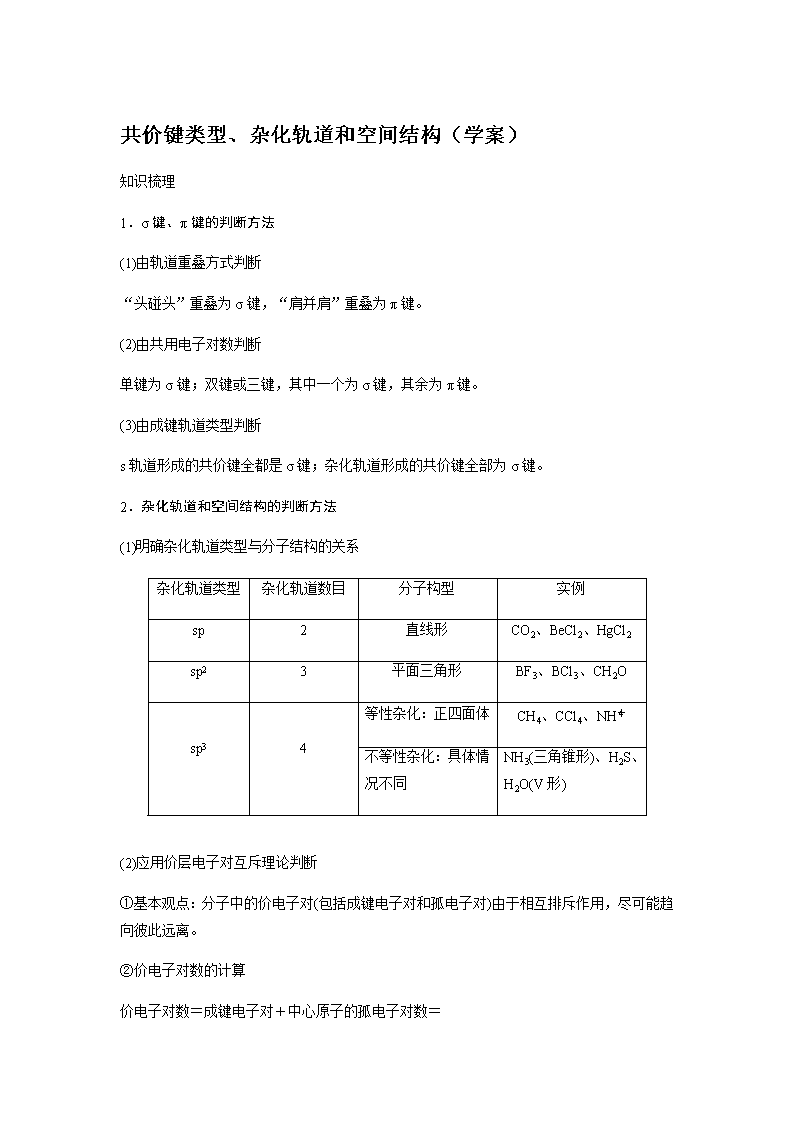
2.杂化轨道和空间结构的判断方法
(1)明确杂化轨道类型与分子结构的关系
杂化轨道类型
杂化轨道数目
分子构型
实例
sp
2
直线形
CO2、BeCl2、HgCl2
sp2
3
平面三角形
BF3、BCl3、CH2O
sp3
4
等性杂化:正四面体
CH4、CCl4、NH
不等性杂化:具体情况不同
NH3(三角锥形)、H2S、H2O(V形)
(2)应用价层电子对互斥理论判断
①基本观点:分子中的价电子对(包括成键电子对和孤电子对)由于相互排斥作用,尽可能趋向彼此远离。
②价电子对数的计算
价电子对数=成键电子对+中心原子的孤电子对数=
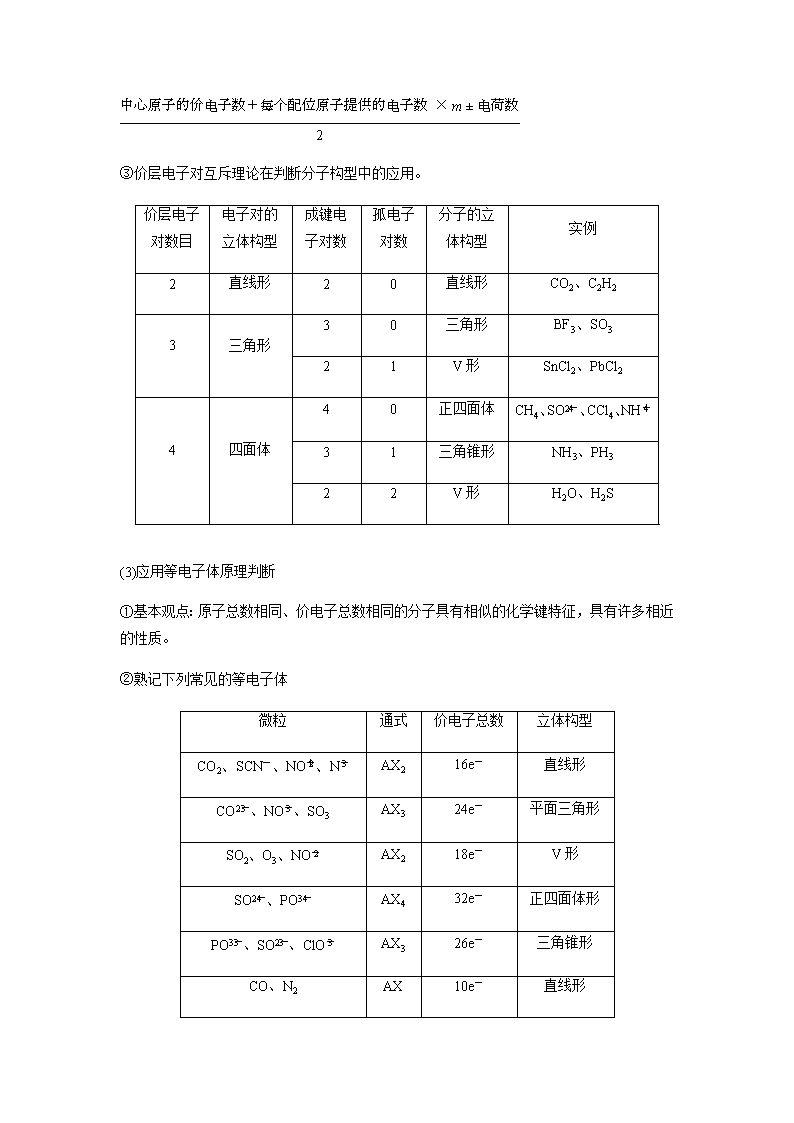
③价层电子对互斥理论在判断分子构型中的应用。
价层电子对数目
电子对的立体构型
成键电子对数
孤电子对数
分子的立体构型
实例
2
直线形
2
0
直线形
CO2、C2H2
3
三角形
3
0
三角形
BF3、SO3
2
1
V形
SnCl2、PbCl2
4
四面体
4
0
正四面体
CH4、SO、CCl4、NH
3
1
三角锥形
NH3、PH3
2
2
V形
H2O、H2S
(3)应用等电子体原理判断
①基本观点:原子总数相同、价电子总数相同的分子具有相似的化学键特征,具有许多相近的性质。
②熟记下列常见的等电子体
微粒
通式
价电子总数
立体构型
CO2、SCN-、NO、N
AX2
16e-
直线形
CO、NO、SO3
AX3
24e-
平面三角形
SO2、O3、NO
AX2
18e-
V形
SO、PO
AX4
32e-
正四面体形
PO、SO、ClO
AX3
26e-
三角锥形
CO、N2
AX
10e-
直线形
CH4、NH
AX4
8e-
正四面体形
强化训练
1.[2018·全国卷Ⅰ,35(3)]LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是________、中心原子的杂化形式为________。LiAlH4中,存在________(填标号)。
A.离子键 B.σ键 C.π键 D.氢键
答案 正四面体 sp3 AB
2.[2018·全国卷Ⅲ,35(4)]《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为________,C原子的杂化形式为________________________________________________________________________。
答案 平面三角形 强化p2
3.[2017·全国卷Ⅰ,35(3)]X射线衍射测定等发现,I3AsF6中存在I离子。I离子的几何构型为________,中心原子的杂化类型为________。
答案 V形 sp3
4.[2017·江苏,21(2)]丙酮()分子中碳原子轨道的杂化类型是________,1 mol丙酮分子中含有σ键的数目为________。
答案 sp2和sp3 9NA
5.CS2分子中,共价键的类型有____________,C原子的杂化轨道类型是________,写出两个与CS2具有相同空间构型和键合形式的分子或离子____________。
答案 σ键和π键 sp CO2、COS
6.磷和氯反应可生成组成比为1∶3的化合物,该化合物的立体构型为________________,中心原子的杂化轨道类型为________。
答案 三角锥形 sp3
7.石墨烯(图甲)
是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(图乙)。
(1)图甲中,1号C与相邻C形成σ键的个数为________。
(2)图乙中,1号C的杂化方式是____________,该C与相邻C形成的键角________(填“>”“<”或“=”)图甲中1号C与相邻C形成的键角。
答案 (1)3 (2)sp3 <
8.甲醛(H2C==O)在Ni催化作用下加氢可得甲醇(CH3OH),甲醇分子内C原子的杂化方式为________,甲醇分子内的O—C—H键角________(填“大于”“等于”或“小于”)甲醛分子内的O—C—H键角。
答案 sp3 小于
9.(1)S单质的常见形式为S8,其环状结构如图所示,S原子采用的轨道杂化方式是______________。
(2)H2Se的酸性比H2S________(填“强”或“弱”);气态SeO3分子的立体构型为________________,SO离子的立体构型为______________。
答案 (1)sp3 (2)强 平面三角形 三角锥形
相关文档
- 2020届高考化学一轮复习化学反应与2021-07-098页
- 2021届高考化学一轮复习化学平衡状2021-07-0910页
- 2020版高考一轮复习化学通用版学案2021-07-0821页
- 2020届高考化学一轮复习化学能与热2021-07-086页
- 2020届高考化学一轮复习化学反应与2021-07-085页
- 2020届高考化学一轮复习化学平衡学2021-07-0833页
- 2020届高考化学一轮复习化学反应原2021-07-0832页
- 2020届高考化学一轮复习化学平衡状2021-07-0830页
- 2021届高考化学一轮复习化学反应速2021-07-0818页
- 2020届高考化学一轮复习化学与自然2021-07-0823页