- 853.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
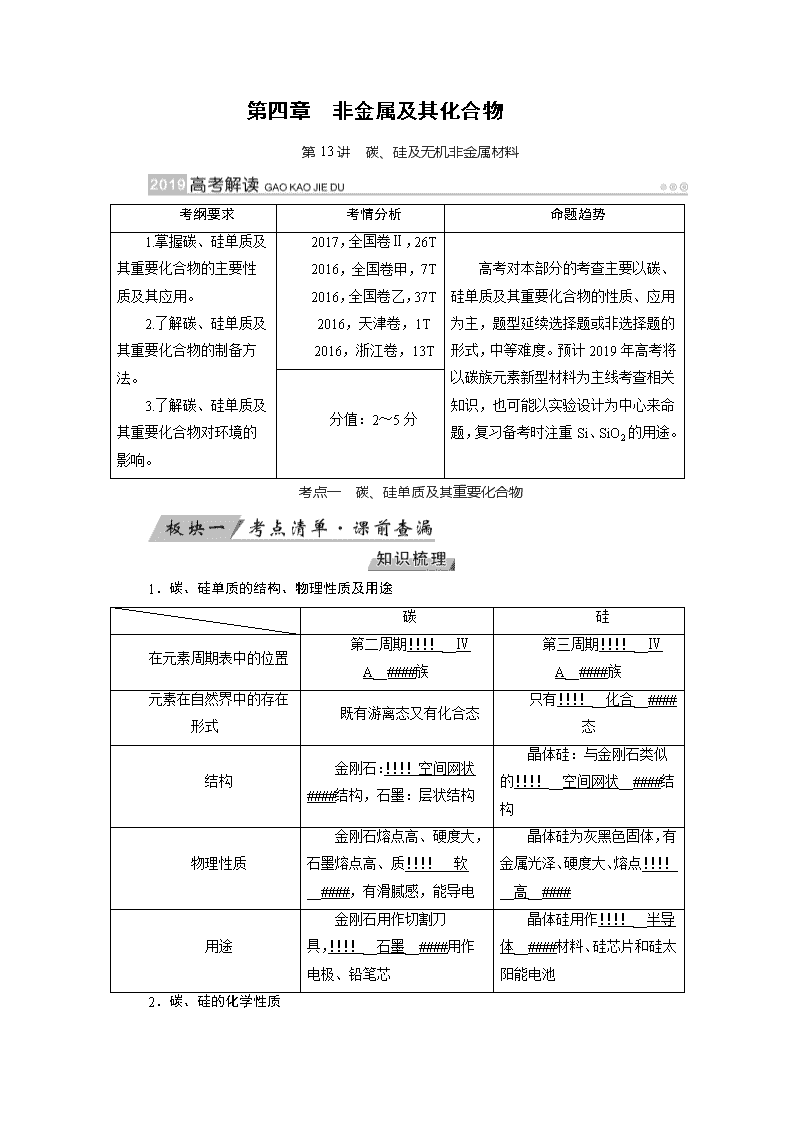
第四章 非金属及其化合物
第13讲 碳、硅及无机非金属材料
考纲要求
考情分析
命题趋势
1.掌握碳、硅单质及其重要化合物的主要性质及其应用。
2.了解碳、硅单质及其重要化合物的制备方法。
3.了解碳、硅单质及其重要化合物对环境的影响。
2017,全国卷Ⅱ,26T
2016,全国卷甲,7T
2016,全国卷乙,37T
2016,天津卷,1T
2016,浙江卷,13T
高考对本部分的考查主要以碳、硅单质及其重要化合物的性质、应用为主,题型延续选择题或非选择题的形式,中等难度。预计2019年高考将以碳族元素新型材料为主线考查相关知识,也可能以实验设计为中心来命题,复习备考时注重Si、SiO2的用途。
分值:2~5分
考点一 碳、硅单质及其重要化合物
1.碳、硅单质的结构、物理性质及用途
碳
硅
在元素周期表中的位置
第二周期!!!!__ⅣA__####族
第三周期!!!!__ⅣA__####族
元素在自然界中的存在形式
既有游离态又有化合态
只有!!!!__化合__####态
结构
金刚石:!!!!空间网状####结构,石墨:层状结构
晶体硅:与金刚石类似的!!!!__空间网状__####结构
物理性质
金刚石熔点高、硬度大,石墨熔点高、质!!!!__软__####,有滑腻感,能导电
晶体硅为灰黑色固体,有金属光泽、硬度大、熔点!!!!__高__####
用途
金刚石用作切割刀具,!!!!__石墨__####用作电极、铅笔芯
晶体硅用作!!!!__半导体__####材料、硅芯片和硅太阳能电池
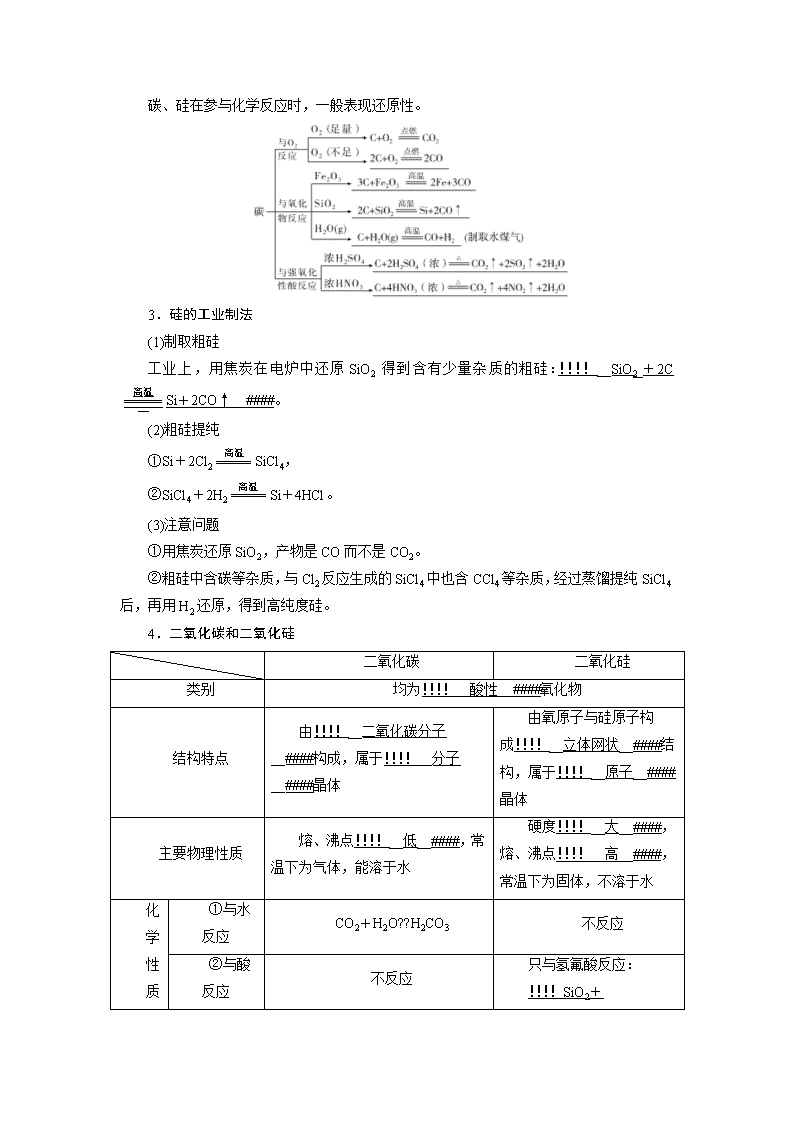
2.碳、硅的化学性质
碳、硅在参与化学反应时,一般表现还原性。
3.硅的工业制法
(1)制取粗硅
工业上,用焦炭在电炉中还原SiO2得到含有少量杂质的粗硅:!!!!__SiO2+2CSi+2CO↑__####。
(2)粗硅提纯
①Si+2Cl2SiCl4,
②SiCl4+2H2Si+4HCl。
(3)注意问题
①用焦炭还原SiO2,产物是CO而不是CO2。
②粗硅中含碳等杂质,与Cl2反应生成的SiCl4中也含CCl4等杂质,经过蒸馏提纯SiCl4后,再用H2还原,得到高纯度硅。
4.二氧化碳和二氧化硅
二氧化碳
二氧化硅
类别
均为!!!!__酸性__####氧化物
结构特点
由!!!!__二氧化碳分子__####构成,属于!!!!__分子__####晶体
由氧原子与硅原子构成!!!!__立体网状__####结构,属于!!!!__原子__####晶体
主要物理性质
熔、沸点!!!!__低__####,常温下为气体,能溶于水
硬度!!!!__大__####,熔、沸点!!!!__高__####,常温下为固体,不溶于水
化
学
性
①与水反应
CO2+H2O??H2CO3
不反应
质
②
不反应
只与氢氟酸反应:
与酸反应
!!!!SiO2+4HF===SiF4↑+2H2O####
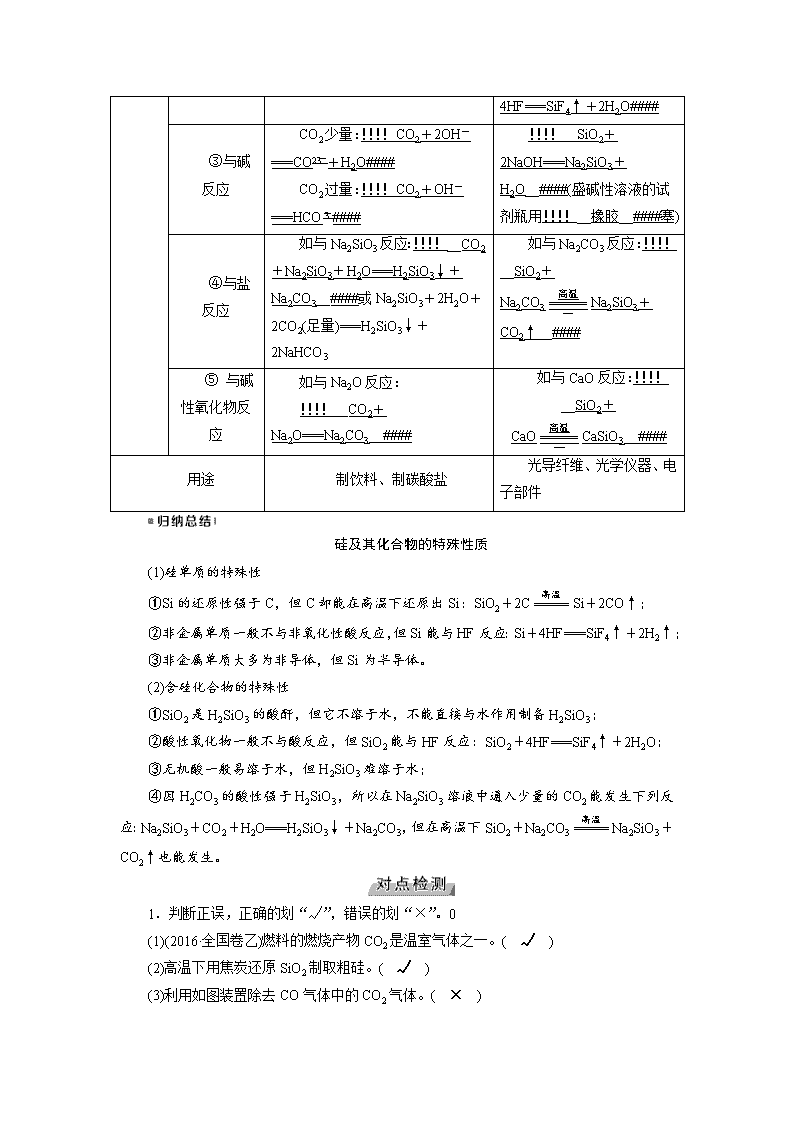
③与碱反应
CO2少量:!!!!CO2+2OH-===CO+H2O####
CO2过量:!!!!CO2+OH-===HCO####
!!!!__SiO2+2NaOH===Na2SiO3+H2O__####(盛碱性溶液的试剂瓶用!!!!__橡胶__####塞)
④与盐反应
如与Na2SiO3反应:!!!!__CO2+Na2SiO3+H2O===H2SiO3↓+Na2CO3__####或Na2SiO3+2H2O+2CO2(足量)===H2SiO3↓+2NaHCO3
如与Na2CO3反应:!!!!__SiO2+Na2CO3Na2SiO3+CO2↑__####
⑤ 与碱性氧化物反应
如与Na2O反应:
!!!!__CO2+Na2O===Na2CO3__####
如与CaO反应:!!!!__SiO2+CaOCaSiO3__####
用途
制饮料、制碳酸盐
光导纤维、光学仪器、电子部件
硅及其化合物的特殊性质
(1)硅单质的特殊性
①Si的还原性强于C,但C却能在高温下还原出Si:SiO2+2CSi+2CO↑;
②非金属单质一般不与非氧化性酸反应,但Si能与HF反应:Si+4HF===SiF4↑+2H2↑;
③非金属单质大多为非导体,但Si为半导体。
(2)含硅化合物的特殊性
①SiO2是H2SiO3的酸酐,但它不溶于水,不能直接与水作用制备H2SiO3;
②酸性氧化物一般不与酸反应,但SiO2能与HF反应:SiO2+4HF===SiF4↑+2H2O;
③无机酸一般易溶于水,但H2SiO3难溶于水;
④因H2CO3的酸性强于H2SiO3,所以在Na2SiO3溶液中通入少量的CO2能发生下列反应:Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3,但在高温下SiO2+Na2CO3Na2SiO3+CO2↑也能发生。
1.判断正误,正确的划“√”,错误的划“×”。0
(1)(2016·全国卷乙)燃料的燃烧产物CO2是温室气体之一。( √ )
(2)高温下用焦炭还原SiO2制取粗硅。( √ )
(3)利用如图装置除去CO气体中的CO2气体。( × )
(4)元素碳的单质只存在金刚石和石墨两种同素异形体。( × )
2.用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质),将所选答案的编号填入下表相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
可供选择的试剂:A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
粉末状混合物
选择的试剂
选用的操作
Ⅰ.
CaCO3(SiO2)
!!!!__B__####
!!!!__④__####
Ⅱ.
NaCl(SiO2)
!!!!__D__####
!!!!__④⑤__####
Ⅲ.
SiO2(Fe2O3)
!!!!__A__####
!!!!__④__####
Ⅳ.
SiO2(CaCO3)
!!!!__A__####
!!!!__④__####
Ⅴ.
SiO2(NH4Cl)
!!!!__/__####
!!!!__②__####
CO2与碱、盐溶液的反应规律
1.CO2与碱反应产物的定量判断
CO2通入NaOH、Ca(OH)2等强碱溶液的反应产物与CO2气体的通入量有关,当通入少量的CO2时生成碳酸盐,当通入过量的CO2时生成碳酸氢盐;当CO2的通入量介于两者之间时,既有正盐又有酸式盐生成,因此推断时一定要注意CO2与碱之间量的关系。
以CO2与NaOH溶液反应为例,将CO2通入NaOH溶液中,可能发生的反应为
①CO2+2NaOH===Na2CO3+H2O
②CO2+NaOH===NaHCO3
当n(OH-)∶n(CO2)的值不同时产物如下:
2.碳酸的“强酸性”
碳酸虽然是一种弱酸,但其酸性比硅酸、次氯酸、偏铝酸等物质的酸性强,将CO2气体通入Na2SiO3、NaClO、NaAlO2盐溶液中,均能发生反应而生成相应的弱酸和碳酸(氢)盐,这是“强酸制弱酸”原理的应用。如
CO2(少量)+Na2SiO3+H2O===Na2CO3+H2SiO3↓
CO2(少量)+Ca(ClO)2+H2O===CaCO3↓+2HClO
CO2(少量)+2NaAlO2+3H2O===2Al(OH)3↓+Na2CO3
[例1] 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入的CO2的体积关系如图所示。下列关于整个反应过程中的叙述不正确的是( B )
A.Oa段反应的化学方程式是Ba(OH)2+CO2===BaCO3↓+H2O
B.ab段与cd段所发生的反应相同
C.de段沉淀减少是由于BaCO3固体消失
D.bc段反应的离子方程式是2AlO+3H2O+CO2===2Al(OH)3↓+CO
解析 CO2首先与Ba(OH)2反应:Ba(OH)2+CO2===BaCO3↓+H2O(Oa段),接着与KOH反应生成K2CO3(ab段),最后再与KAlO2反应生成Al(OH)3沉淀和K2CO3(bc段),K2CO3与CO2反应生成KHCO3(cd段),BaCO3 与CO2反应转化为可溶的Ba(HCO3)2(de段)。
[例1] 研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO占95%。写出CO2溶于水产生HCO的方程式:!!!!________________________________________####。
(2)在海洋碳循环中,通过如图所示的途径固碳。
①写出钙化作用的离子方程式:!!!!______________________####。
②同位素示踪法证实光合作用释放出的O2只来自H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
!!!!______####+!!!!______#### (CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol·L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度=!!!!______####mol·L-1。
(4)利用如图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理:
________________________________________________________________________
________________________________________________________________________。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是!!!!____________________####。
[答题送检]来自阅卷名师报告
错误
致错原因
扣分
(2)
审题不够仔细,没弄清光合作用的反应物之一为HO
-2
(4)
电解原理不够熟练,且文字表述题抓不住叙述的顺序和关键点
-3
[解析] (1)CO2溶于水生成H2CO3、H2CO3电离生成H+和HCO。(2)①钙化作用为Ca2+和HCO反应生成CaCO3。②该反应为CO2和HO
发生反应,利用原子守恒可配平该化学方程式。(3)①用N2从酸化后的海水中吹出CO2,则气体从长管进、从短管出,由于溶液没有酸化,则需要用分液漏斗滴入稀硫酸。②海水中溶解无机碳的浓度=x mol/L×y×10-3L/(z×10-3L)= mol/L。(4)①阳极区H2O放电产生H+,H+通过阳离子膜进入b室,与HCO反应产生CO2。②b室排出的海水pH<6,而海水的pH≈8,因此需要加入碱溶液中和,可以用c室产物调节pH。
[答案] (1)CO2+H2O??H2CO3、H2CO3??H++HCO
(2)①2HCO+Ca2+===CaCO3↓+CO2↑+H2O
②xCO2 2xHO
(3)① ②
(4)①a室:2H2O-4e-===4H++O2↑,H+通过阳离子膜进入b室,发生反应:H++HCO===CO2↑+H2O
②c室的反应:2H2O+2e-===2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调至接近装置入口海水的pH
1.(2018·广西南宁调研)硅单质及其化合物应用范围很广。请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
①写出由纯SiHCl3制备高纯硅的化学反应方程式:!!!!__SiHCl3+H2Si+3HCl__####。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:!!!!__SiHCl3+3H2O===H2SiO3↓+3HCl↑+H2↑__####;H2还原SiHCl3过程中若混入O2,可能引起的后果是!!!!__氧气与氢气混合,可能引起爆炸;氧气可能会氧化SiHCl3__####。
(2)下列有关硅材料的说法正确的是!!!!__ABC__#### (填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高
E.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(3)硅酸钠水溶液俗称水玻璃。取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡。写出实验现象并给予解释:
!!!!__现象:试管中有白色胶状沉淀生成,并且有刺激性气味气体生成。解释:Na2SiO3和NH4Cl均能够水解,两者相互促进,Na2SiO3水解生成H2SiO3,NH4Cl水解产生NH3__####。
1.判断正误,正确的划“√”,错误的划“×”。
(1)(2017·全国卷Ⅲ)将金属钠在燃烧匙中点燃,迅速伸入集满CO2的集气瓶,集气瓶中产生大量白烟,瓶内有黑色颗粒产生,说明CO2具有氧化性。( √ )
(2)(2017·江苏卷)SiO2硬度大,可用于制造光导纤维。( × )
(3)(2016·江苏卷)下列转化在一定条件下能够实现:SiO2SiCl4Si。( × )
(4)硅胶可用作食品干燥剂。( √ )
(5)SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物。( × )
(6)NH4F水溶液中含有HF,因此NH4F溶液不能存放于玻璃试剂瓶中。( √ )
(7)如图:①中为浓硝酸,②中为Na2CO3,③中为Na2SiO3溶液,可证明酸性:硝酸>碳酸>硅酸。( × )
(8)用活性炭去除冰箱中的异味,没有发生化学反应。( √ )
考点二 硅酸盐与无机非金属材料
1.硅酸
2.硅酸盐
(1)概念:!!!!__由硅、氧和金属元素组成的化合物__####的总称,是构成地壳岩石的主要成分。
(2)硅酸钠(Na2SiO3)
①白色、可溶于水的粉末状固体,其水溶液俗称!!!!__水玻璃__####,有黏性,水溶液显碱性。
②它能与较强的酸反应,如与盐酸反应:!!!!__Na2SiO3+2HCl===2NaCl+H2SiO3↓__####;与CO2水溶液反应:!!!!__Na2SiO3+CO2+H2O===H2SiO3↓+Na2CO3__####。
③用途:黏合剂(矿物胶),耐火阻燃材料。
(3)硅酸盐组成的表示:通常用二氧化硅和金属氧化物的组合形式表示硅酸盐的组成,如硅酸钠(Na2SiO3)可表示为Na2O·SiO2,长石(KAlSi3O8)可表示为!!!!__K2O·Al2O3·6SiO2__####。
3.无机非金属材料
(1)传统无机非金属材料
水泥
普通玻璃
陶瓷
生产原料
!!!!__石灰石、黏土__####
!!!!__纯碱、石灰石、石英__####
黏土
主要设备
水泥回转窑
玻璃熔炉
陶瓷窑
(2)新型无机非金属材料,如高温结构陶瓷、光导纤维、生物陶瓷、压电陶瓷等。
(3)特殊功能的含硅物质
①碳化硅具有金刚石结构,可用作磨料。
②含硅元素4%的硅钢具有导磁性。
③硅橡胶具有耐高温和耐低温的性质。
含硅物质的用途
(1)晶体硅:半导体材料、计算机芯片。
(2)SiO2:光导纤维、水晶、石英、玛瑙等的主要成分为SiO2。
(3)硅胶:干燥剂、催化剂的载体。
(4)Na2SiO3:黏合剂、防火剂等。
1.判断正误,正确的划“√”,错误的划“×”。
(1)水玻璃俗称泡花碱,是一种纯净物。( × )
(2)向一定浓度的Na2SiO3溶液中通入适量CO2出现白色沉淀,通入过量CO2,白色沉淀消失。( × )
(3)传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐。( × )
(1)玻璃中含有二氧化硅,因此氢氟酸可用于雕刻玻璃,盛放氢氟酸不用玻璃瓶而用塑料瓶。
(2)NaOH等碱性溶液可以用玻璃瓶盛放,但不能用玻璃塞。
一 硅酸盐改写成氧化物形式的方法
1.氧化物的书写顺序
活泼金属氧化物―→较活泼金属氧化物―→二氧化硅―→水。
2.氧化物前计量数的配置原则
除氧元素外,其他元素按配置前后原子个数守恒原则配置计量数,且不同氧化物间以“·”隔开。
3.当计量数配置出现分数时应化为整数
如正长石:KAlSi3O8不能写成K2O·Al2O3·3SiO2,应写成K2O·Al2O3·6SiO2。
4.实例
高岭土(Al2Si2O7·2H2O)⇒Al2O3·2SiO2·2H2O
石棉(CaMg3Si4O12)⇒CaO·3MgO·4SiO2
沸石(Na2Al2Si3O10·2H2O)⇒Na2O·Al2O3·3SiO2·2H2O
云母(KAl3Si3O17·H2O)⇒K2O·3Al2O3·6SiO2·2H2O
[例1] (2018·云南昆明质检)青石棉(crocidolite)是一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,其化学式为Na2Fe5Si8O22(OH)2。青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法不正确的是 ( B )
A.青石棉是一种硅酸盐产品
B.青石棉中含有一定量的石英晶体
C.青石棉的化学组成可表示为
Na2O·3FeO·Fe2O3·8SiO2·H2O
D.1 mol青石棉能使1 mol HNO3被还原
二 碳、硅及其化合物的相互转化
1.碳及其化合物的转化关系图
2.硅及其化合物的转化关系图
[例2]A、B、C、D、E五种物质中均含有同一种非金属元素,它们能发生如图所示的转化关系,该元素(用R表示)的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气。
请回答下列问题:
(1)写出各物质的化学式:A!!!!__SiO2__####;B!!!!__CaSiO3__####;
C!!!!__Na2SiO3__####;D!!!!__Si__####;E!!!!__H2SiO3__####。
(2)写出反应①的化学方程式:!!!!__SiO2+2CSi+2CO↑__####,该反应中氧化剂与还原剂的物质的量之比为!!!!__1∶2__####。
(3)写出反应④的离子方程式:!!!!__Si+2OH-+H2O===SiO+2H2↑__####。
(4)写出反应⑤的离子方程式:!!!!__SiO+Ca2+===CaSiO3↓__####。
(5)H2CO3的酸性强于E,请用离子方程式予以证明:!!!!__SiO+CO2+H2O===H2SiO3↓+CO__####。
解析 解答本题的第一个“突破口”是非金属元素R的单质能与NaOH溶液反应生成盐(Na2RO3)和氢气,说明是硅及其化合物之间的转化。第二个“突破口”是反应条件“高温”,A在高温条件下,能与焦炭、CaCO3发生反应,则A为SiO2。从而推知B为CaSiO3,D为Si,E为H2SiO3。
[例1] 单质Z是一种常见的半导体材料,可由X通过如图所示的路线制备。其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似。回答下列问题:
(1)能与X发生化学反应的酸是!!!!______#### ;由X制备Mg2Z
的化学方程式为!!!!________________________####。
(2)由Mg2Z生成Y的化学方程式为!!!!____________________####,Y分子的电子式为!!!!______####。
(3)Z、X中共价键的类型分别是!!!!__________####、!!!!__________####。
[答题送检]来自阅卷名师报告
错误
致错原因
扣分
(1)
以为SiO2与Mg的反应为置换反应
-2
(2)
不能有效地将CH4与SiH4进行类比
-1
(3)
不清楚SiO2晶体中的共价键类型
-1
[解析] (1)根据题中信息可确定Z为Si,其氧化物X的化学式为SiO2,能与SiO2反应的酸只有氢氟酸;由SiO2制备Mg2Si的化学方程式为SiO2+4Mg2MgO+Mg2Si。(2)Y为SiH4,结合图示可写出Mg2Si与盐酸的反应为Mg2Si+4HCl===2MgCl2+SiH4;C、Si为同主族元素,根据CH4的电子式可写出SiH4的电子式。(3)Si和SiO2中分别含有非极性共价键和极性共价键。
[答案] (1)氢氟酸 SiO2+4MgMg2Si+2MgO
(2)Mg2Si+4HCl===SiH4↑+2MgCl2
(3)非极性共价键 极性共价键
1.SiO2是硅酸盐玻璃(Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成Na2O·CaO·6SiO2。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成黏性的硅酸盐而无法打开,发生反应的化学方程式为!!!!__SiO2+2NaOH===Na2SiO3+H2O__####。长石是铝硅酸盐,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为!!!!__CaAl2Si2O8__####。
1.判断正误,正确的划“√”,错误的划“×”。
(1)(2016·浙江卷)Ge(32号元素)的单晶可以作为充电转换材料用于太阳能电池。( √ )
(2)(2016·四川卷)pH=2的溶液中可能大量存在Na+、NH、SiO。( × )
(3)(2016·江苏卷)向Na2SiO3溶液中滴加稀盐酸的离子方程式:Na2SiO3+2H+===H2SiO3↓+2Na+。( × )
2.金刚石、SiC具有优良的耐磨、耐腐蚀性,应用广泛。
(1)碳与短周期元素Q的单质化合仅能生成两种常见气态化合物,其中一种化合物R为非极性分子,碳元素在周期表中的位置是!!!!__第二周期第ⅣA族__####,Q是!!!!__氧(或O)__####,R的电子式为!!!!____####。
(2)一定条件下,Na还原CCl4可制备金刚石,反应结束冷却至室温后,回收其中的CCl4的实验操作名称为!!!!__过滤__####,除去粗产品中少量钠的试剂为!!!!__水(或乙醇)__####。
(3)碳还原SiO2制SiC,其粗产品中杂质为Si和SiO2。现将20.0 g SiC粗产品加入到过量的NaOH溶液中充分反应,收集到0.1 mol氢气,过滤得SiC固体11.4 g,滤液稀释到1 L,生成氢气的离子方程式为!!!!__Si+2OH-+H2O===SiO+2H2↑__####,硅酸盐的物质的量浓度为!!!!__0.17_mol·L-1__####。
课时达标 第14讲
1.下列关于硅单质及其化合物的说法正确的是( D )
①硅酸盐Na2Fe2Si3O10用氧化物的形式表示为:Na2O·2FeO·3SiO2
②水泥、玻璃、水晶饰物都是硅酸盐制品
③高纯度的硅单质广泛用于制作光导纤维
④单质硅是将太阳能转变为电能的常用材料
A.②③ B.①③
C.①④ D.④
解析 从化合价代数和为0可知Na2Fe2Si3O10中铁的化合价是+3价,①错误;水晶的主要成分是SiO2,②错误;光导纤维的主要成分是SiO2,③错误。
2.二氧化硅(SiO2)又称硅石,是制备硅及其化合物的重要原料(见下图)。下列说法正确的是( C )
A.SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物
B.SiO2和Si都是光导纤维材料
C.在硅胶中加入CoCl2可显示硅胶吸水是否失效
D.图中所示转化反应都是非氧化还原反应
解析 两性氧化物的定义为与酸和碱反应均生成盐和水的氧化物,SiO2与HF反应得到的SiF4不属于盐类,A项错误;SiO2是光导纤维材料,Si为半导体材料,B项错误;CoCl2在吸水和失水状态下显示不同的颜色,C项正确;制取Si的过程中涉及了氧化还原反应,D项错误。
3.用四种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是( A )
选项
操作及现象
溶液
A
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失
饱和Na2CO3溶液
B
通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
Ca(ClO)2溶液
C
通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊
Ca(OH)2溶液
D
通入CO2,溶液变浑浊,再加入稀硝酸,沉淀不溶解
Na2SiO3溶液
解析 CO2通入饱和Na2CO3溶液会生成溶解度小的NaHCO3,继续通CO2,浑浊不消失,A项错误;CO2与Ca(ClO)2溶液反应生成CaCO3白色沉淀和具有漂白性的HClO,B项正确;CO2与Ca(OH)2溶液反应生成CaCO3沉淀,继续通入CO2,生成Ca(HCO3)2,沉淀消失,加入NaOH溶液,又生成CaCO3沉淀,C项正确;CO2与Na2SiO3溶液反应生成硅酸,硅酸不溶于稀硝酸,D项正确。
4.下列除杂方法正确的是( B )
A.SiO2中含Al2O3杂质,可以加入足量NaOH溶液然后过滤除去
B.CO2中含有CO杂质,可以通入盛有CuO的玻璃管且加热
C.CO2中含有HCl杂质,可以通过盛有Na2CO3溶液的洗气瓶
D.Na2CO3溶液中含有Na2SiO3杂质,可以通入足量的CO2,然后过滤
解析 A项,SiO2、Al2O3均与NaOH溶液反应;C项,Na2CO3溶液会吸收CO2生成NaHCO3,应通过盛有饱和NaHCO3溶液的洗气瓶;D项,Na2CO3溶液能与CO2反应生成NaHCO3。
5.向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L (0 ℃,1.01×105 Pa) 时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )
解析 本题涉及的化学反应方程式如下:Ba(OH)2+CO2===BaCO3↓+H2O ①;2NaOH+CO2===Na2CO3+H2O ②;Na2CO3+CO2+H2O===2NaHCO3 ③;BaCO3+CO2+H2O===Ba(HCO3)2 ④。当未通入CO2气体时,溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol OH-;当通入2.24 L CO2气体时,发生反应①,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol OH-;当通入4.48 L CO2时,发生反应②,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol CO;当通入6.72 L CO2时,发生反应③,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol HCO;当通入8.96 L CO2时,发生反应④,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol HCO。
6.铅及其化合物可用于蓄电池、耐酸设备及X-射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第!!!!__六__####周期第!!!!___ⅣA__####族;PbO2的酸性比CO2的酸性!!!!__弱__####(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为!!!!__PbO2+4HCl(浓)PbCl2+Cl2↑+2H2O__####。
(3)PbO2在加热过程发生分解的失重曲线如下图所示,已 知 失重曲线上的a点为样品失重4.0%(即×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n的值:!!!!__×32=239×4.0%,x=2-=1.4,根据mPbO2·nPbO,=1.4,==__####。
解析 (2)PbO2与浓盐酸反应得到黄绿色的氯气,联想实验室制氯气的反应原理写出化学方程式。(3)根据题意PbO2在加热过程中发生反应:PbO2PbOx+O2↑
,减少的质量是氧气的质量,再利用质量关系进行计算。
相关文档
- 2021届高考化学一轮复习化学平衡常2021-07-0919页
- 2020届高考化学一轮复习化学反应与2021-07-098页
- 2021届高考化学一轮复习化学平衡状2021-07-0910页
- 2020版高考一轮复习化学通用版学案2021-07-0821页
- 2020届高考化学一轮复习化学能与热2021-07-086页
- 2020届高考化学一轮复习化学反应与2021-07-085页
- 2020届高考化学一轮复习化学平衡学2021-07-0833页
- 2020届高考化学一轮复习化学反应原2021-07-0832页
- 2020届高考化学一轮复习化学平衡状2021-07-0830页
- 2021届高考化学一轮复习化学反应速2021-07-0818页