- 1.09 MB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
(十三)“多池”组合装置分析与电化学计算
(对应学生用书第128页)
突破1| “多池”组合装置的原理分析
[考纲知识整合]
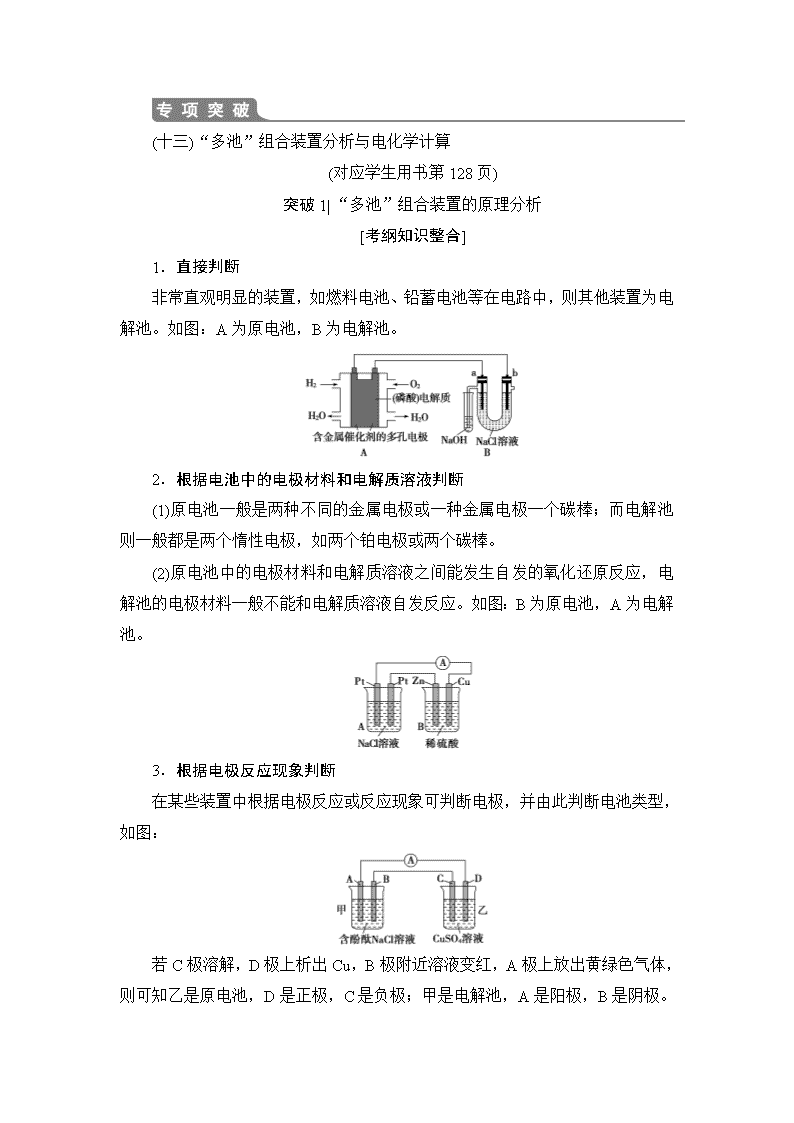
1.直接判断
非常直观明显的装置,如燃料电池、铅蓄电池等在电路中,则其他装置为电解池。如图:A为原电池,B为电解池。
2.根据电池中的电极材料和电解质溶液判断
(1)原电池一般是两种不同的金属电极或一种金属电极一个碳棒;而电解池则一般都是两个惰性电极,如两个铂电极或两个碳棒。
(2)原电池中的电极材料和电解质溶液之间能发生自发的氧化还原反应,电解池的电极材料一般不能和电解质溶液自发反应。如图:B为原电池,A为电解池。
3.根据电极反应现象判断
在某些装置中根据电极反应或反应现象可判断电极,并由此判断电池类型,如图:
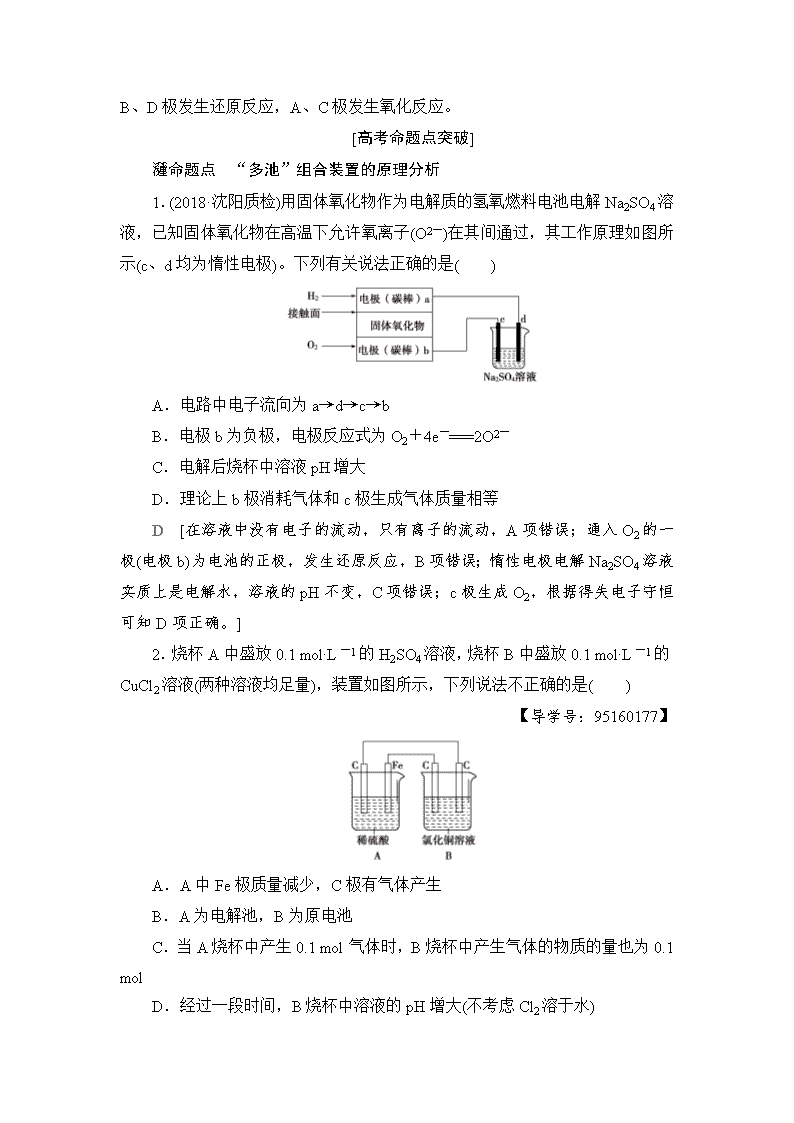
若C极溶解,D极上析出Cu,B极附近溶液变红,A极上放出黄绿色气体,则可知乙是原电池,D是正极,C是负极;甲是电解池,A是阳极,B是阴极。B、D极发生还原反应,A、C极发生氧化反应。
[高考命题点突破]
命题点 “多池”组合装置的原理分析
1.(2018·沈阳质检)用固体氧化物作为电解质的氢氧燃料电池电解Na2SO4溶液,已知固体氧化物在高温下允许氧离子(O2-)在其间通过,其工作原理如图所示(c、d均为惰性电极)。下列有关说法正确的是( )
A.电路中电子流向为a→d→c→b
B.电极b为负极,电极反应式为O2+4e-===2O2-
C.电解后烧杯中溶液pH增大
D.理论上b极消耗气体和c极生成气体质量相等
D [在溶液中没有电子的流动,只有离子的流动,A项错误;通入O2的一极(电极b)为电池的正极,发生还原反应,B项错误;惰性电极电解Na2SO4溶液实质上是电解水,溶液的pH不变,C项错误;c极生成O2,根据得失电子守恒可知D项正确。]
2.烧杯A中盛放0.1 mol·L-1的H2SO4溶液,烧杯B中盛放0.1 mol·L-1的CuCl2溶液(两种溶液均足量),装置如图所示,下列说法不正确的是( )
【导学号:95160177】
A.A中Fe极质量减少,C极有气体产生
B.A为电解池,B为原电池
C.当A烧杯中产生0.1 mol气体时,B烧杯中产生气体的物质的量也为0.1 mol
D.经过一段时间,B烧杯中溶液的pH增大(不考虑Cl2溶于水)
B [构成A装置的活动性不同的电极、电解质溶液,两极形成了闭合的回路,所以A为原电池装置,且A为B的电解提供电能。电极反应式分别为(烧杯A中)C正极:2H++2e-===H2↑,Fe负极:Fe-2e-===Fe2+。(烧杯B中)阴极:Cu2++2e-===Cu,阳极:2Cl--2e-===Cl2↑。烧杯B中电解氯化铜溶液,铜离子浓度减小,水解程度减小,pH增大。 ]
突破2| 电化学计算
[考纲知识整合]
1.计算原则
电化学的反应是氧化还原反应,各电极上转移电子的物质的量相等,无论是单一电池还是串联电解池,均可抓住电子守恒计算。
关键:a.电极名称要区分清楚;b.电极产物要判断准确;c.各产物间量的关系遵循电子得失守恒。
2.三种计算方法
提醒:在电化学计算中,还常利用Q=I·t和Q=n(e-)×NA×1.60×10-19 C来计算电路中通过的电量。
[典例导航]
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO)=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是 ( )
A.原混合溶液中c(Na+)=0.2 mol·L-1
B.电解后溶液中c(H+)=0.2 mol·L-1
C.上述电解过程中共转移0.4 mol电子
D.电解后得到的Cu的物质的量为0.1 mol
【答案】 B
(1)整个电解过程,阴极电极反应式为____________________________________________________________。
(2)如何使电解后溶液复原?______________________________________
________________________________________________________________________。
【答案】 (1)Cu2++2e-===Cu、2H++2e-===H2↑
(2)加入4.9 g Cu(OH)2(或同时加入4 g CuO和0.9 g H2O)
[易错防范]
电解一定量NaCl或CuSO4溶液时,注意电解的程度,当溶液中的Cl-或Cu2+放电完全后,再电解时相当于电解H2O,故判断复原物质要注意前期与后期减少的物质,确定加什么物质复原。
[高考命题点突破]
命题点 电化学的有关计算
1.(2018·大连模拟)用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 mol Cu2(OH)2CO3后恰好恢复到电解前的浓度和pH(不考虑二氧化碳的溶解)。则电解过程中转移电子的物质的量为 ( ) 【导学号:95160178】
A.0.4 mol B.0.5 mol
C.0.6 mol D.0.8 mol
C [Cu2(OH)2CO3可改写为2CuO·H2O·CO2,因反应后生成的CO2离开溶液,所以加入0.1 mol Cu2(OH)2CO3相当于加入0.2 mol CuO、0.1 mol H2O,根据
2Cu ~ O2 ~ 4e-
2 mol 4 mol
0.2 mol 0.4 mol
2H2O ~ O2 ~ 4e-
2 mol 4 mol
0.1 mol 0.2 mol
转移电子的物质的量=0.4 mol+0.2 mol=0.6 mol。 ]
2.某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。
请回答下列问题:
【导学号:95160179】
(1)甲池为________(填“原电池”“电解池”或“电镀池”),通入CH3OH电极的电极反应式为_______________________________________
________________________________________________。
(2)乙池中A(石墨)电极的名称为________(填“正极”“负极”“阴极”或“阳极”),总反应式为_________________________________________________
_________________________________________________________________。
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O2的体积为________mL(标准状况),丙池中________极析出________g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将________(填“增大”“减小”或“不变”);丙中溶液的pH将________(填“增大”“减小”或“不变”),若将丙中溶液复原,需加入________。
【解析】 (1)甲池为原电池,通入CH3OH的电极为负极,电极反应式为CH3OH-6e-+8OH-===CO+6H2O。
(2)乙池中为用惰性电极电解AgNO3溶液,其中A作阳极,B作阴极,总反应式为4AgNO3+2H2O4Ag+O2↑+4HNO3。
(3)根据各电极上转移的电子相同,则n(Ag)=4n(O2)=2n(Cu),故V(O2)=××22.4 L=0.28 L=280 mL,m(Cu)=××64 g=1.6 g。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,根据丙中总反应式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,溶液pH增大,而甲中总反应式为2CH3OH+3O2+4KOH===2K2CO3+6H2O,溶液pH减小。
【答案】 (1)原电池 CH3OH-6e-+8OH-===CO+6H2O
(2)阳极 4AgNO3+2H2O4Ag+O2↑+4HNO3
(3)280 D 1.6 (4)减小 增大 HCl
相关文档
- 2020届高考化学一轮复习化学工艺流2021-07-0919页
- 2021届高考化学一轮复习化学平衡常2021-07-0919页
- 2020届高考化学一轮复习化学反应与2021-07-098页
- 2021届高考化学一轮复习化学平衡状2021-07-0910页
- 2020版高考一轮复习化学通用版学案2021-07-0821页
- 2020届高考化学一轮复习化学能与热2021-07-086页
- 2020届高考化学一轮复习化学反应与2021-07-085页
- 2020届高考化学一轮复习化学平衡学2021-07-0833页
- 2020届高考化学一轮复习化学反应原2021-07-0832页
- 2020届高考化学一轮复习化学平衡状2021-07-0830页