- 863.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
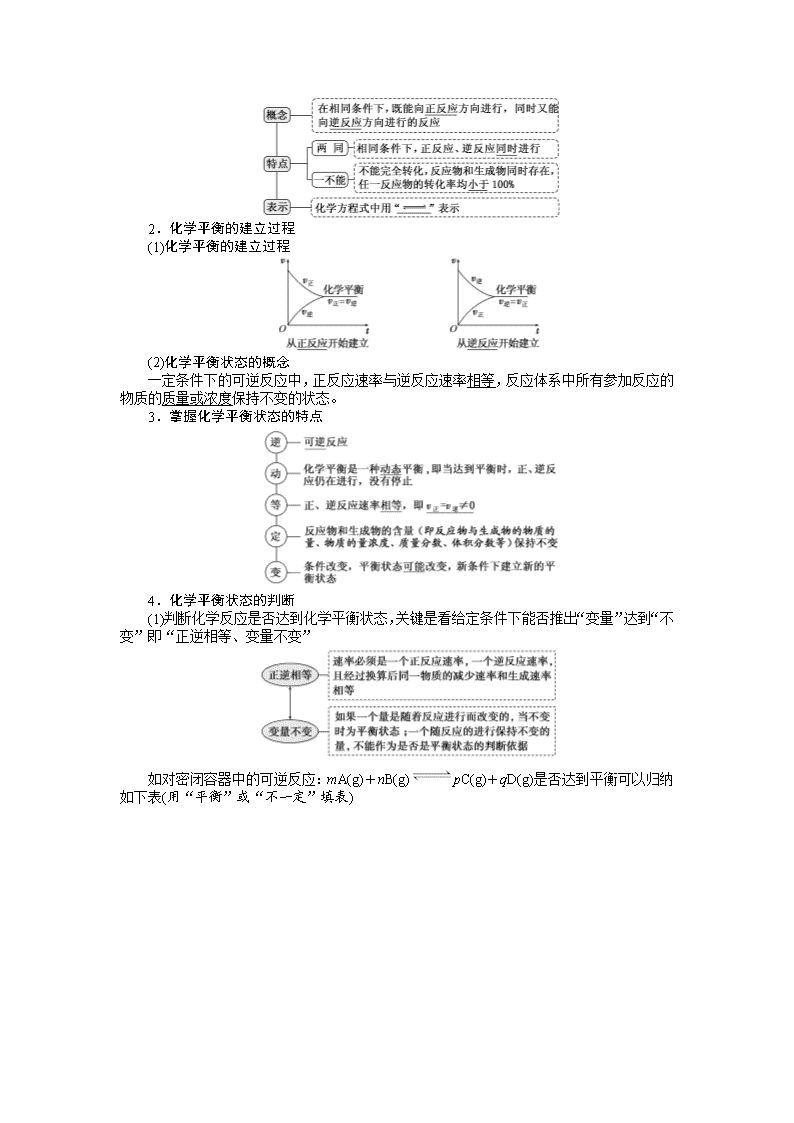
学案一 化学反应进行的方向与化学平衡状态
一、化学反应进行的方向
1.理解自发过程及自发反应的概念
在一定条件下,不需要借助外力作用就能自动进行的过程为自发过程,无需外界帮助就
能自发进行的反应为自发反应。其特点如下:
(1)体系趋向于从高能状态转变为低能状态(体系对外部做功或释放热量)。
(2)在密闭条件下,体系有从有序转变为无序的倾向性(无序体系更加稳定)。
2.掌握化学反应方向的判据
(1)焓判据:放热过程中体系能量降低,ΔH<0,具有自发进行的倾向,但有些吸热反应
也可以自发进行,如 NH4Cl 和 Ba(OH)2 的反应,故只用焓变判断反应方向不全面。
(2)熵判据:①熵的大小:同种物质,熵值:气态>液态>固态;②熵判据:体系的混乱
度增加(即熵增),ΔS>0,反应有自发进行的倾向。但有些熵减的过程也能自发进行,故只用
熵变来判断反应方向也不全面。
(3)复合判据:在温度、压强一定的条件下,化学反应方向是反应的焓变和熵变共同影
响的结果,反应方向的复合判据为ΔG=ΔH-TΔS。
ΔH ΔS ΔG 反应情况
- + 永远是负值 在任何温度下反应均自发进行
+ - 永远是正值 在任何温度下反应均非自发进行
+ + 低温为正高温为负 低温时非自发,高温时自发
- - 低温为负高温为正 低温时自发,高温时非自发
[对点练习]
1.实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一种重要因素
D.焓变是决定反应是否具有自发性的唯一判据
解析:选 C 焓变是判断反应能否自发进行的一种判据,但不是唯一判据;有些放热反
应不是自发反应,有些自发反应是吸热的。
2.已知碳酸钙的分解①CaCO3(s)===CaO(s)+CO2(g) ΔH1 仅在高温下自发进行;氯酸
钾的分解②2KClO3(s)===2KCl(s)+3O2(g) ΔH2 在任何温度下都自发进行。下面有几组焓变
数据,其中可能正确的是( )
A.ΔH1=-178.32 kJ·mol-1 ΔH2=-78.3 kJ·mol-1
B.ΔH1=+178.32 kJ·mol-1 ΔH2=-78.3 kJ·mol-1
C.ΔH1=-178.32 kJ·mol-1 ΔH2=+78.3 kJ·mol-1
D.ΔH1=+178.32 kJ·mol-1 ΔH2=+78.3 kJ·mol-1
解析:选 B 当ΔH-TΔS<0 时反应能自发进行,反应①②的ΔS>0,当ΔH>0 时反应
须在高温下才能自发进行,当ΔH<0 时反应在任何温度下都能自发进行。
二、化学平衡状态
1.可逆反应
2.化学平衡的建立过程
(1)化学平衡的建立过程
(2)化学平衡状态的概念
一定条件下的可逆反应中,正反应速率与逆反应速率相等,反应体系中所有参加反应的
物质的质量或浓度保持不变的状态。
3.掌握化学平衡状态的特点
4.化学平衡状态的判断
(1)判断化学反应是否达到化学平衡状态,关键是看给定条件下能否推出“变量”达到
“不变”即“正逆相等、变量不变”
如对密闭容器中的可逆反应:mA(g)+nB(g) pC(g)+qD(g)是否达到平衡可以归纳
如下表(用“平衡”或“不一定”填表)
(2)以下几种情况不能作为可逆反应达到化学平衡状态的标志:
①某一时刻,各物质的浓度(或物质的量或分子数)之比等于化学计量数之比的状态。
②恒温、恒容条件下气体体积不变的反应,混合气体的压强或气体的总物质的量不随时
间变化,如 2HI(g) I2(g)+H2(g)。
③全部是气体参加的体积不变的反应,体系的平均相对分子质量不随时间变化而变化,
如 2HI(g) I2(g)+H2(g)。
④全部是气体参加的反应,恒容条件下体系的密度保持不变。
[对点练习]
1.在两个恒容的密闭容器中进行下列两个可逆反应:
(甲)2NO2(g) 2NO(g)+O2(g),(乙)H2(g)+I2(g) 2HI(g)。现有下列状态,将能
证明上述反应达到化学平衡状态的填入相应表格:
表明(甲)
达到平衡
表明(乙)
达到平衡
表明(甲)、(乙)
都达到平衡
①反应物的消耗速率与生成物的生成速率之比等于系数之比的状态
②反应物的消耗速率与生成物的消耗速率之比等于系数之比的状态
③速率之比等于系数之比的状态
④浓度之比等于系数之比的状态
⑤百分含量之比等于系数之比的状态
⑥混合气体的颜色不再改变的状态
⑦混合气体的密度不再改变的状态
⑧混合气体的平均相对分子质量不再改变的状态
⑨体系温度不再改变的状态
⑩压强不再改变的状态
⑪反应物的浓度不再改变的状态
⑫反应物或生成物的百分含量不再改变的状态
答案:②⑥⑧⑨⑩⑪⑫ ②⑥⑨⑪⑫ ②⑥⑨⑪⑫
2.在密闭容器中进行反应:X2(g)+Y2(g) 2Z(g),已知 X2、Y2、Z 的起始浓度分
别为 0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的
浓度可能是( )
A.Z 为 0.3 mol·L-1
B.Y2 为 0.4 mol·L-1
C.X2 为 0.2 mol·L-1
D.Z 为 0.4 mol·L-1
解析:选 A 可设 X2 的转化量为 x,然后根据三段式,将题中各选项中各物质的物质
的量代入,计算出 x 的值是否合理,如果合理则就有可能,若不合理就不可能。
[学案验收·块块过]
1.(2017·宿迁期末)下列反应过程中,ΔH>0 且ΔS>0 的是( )
A.NH3(g)+HCl(g)===NH4Cl(s)
B.CaCO3(s)===CaO(s)+CO2(g)
C.4Al(s)+3O2(g)===2Al2O3(s)
D.HCl(aq)+NaOH(aq)===NaCl(aq)+H2O(l)
解析:选 B A 是熵减的放热反应;C 是熵减的放热反应;D 是放热反应。
2.已知:(NH4)2CO3(s)===NH4HCO3(s)+NH3(g) ΔH=+74.9 kJ·mol-1。下列说法中正
确的是( )
A.该反应中熵变、焓变都大于 0
B.该反应是吸热反应,因此一定不能自发进行
C.碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行
D.能自发进行的反应一定是放热反应,不能自发进行的反应一定是吸热反应
解析:选 A 该反应的ΔH=+74.9 kJ·mol-1>0,因为反应前为固体,反应后有气体生成,
所以混乱度增加,熵变大于 0,A 正确;吸热反应也可能自发进行,B 错误;熵增加的反应
不一定能自发进行,C 错误;有些放热反应不能自发进行,如碳的燃烧,而有些吸热反应却
能自发进行,如 NH4Cl 与 Ba(OH)2 的反应在常温下能自发进行,判断反应能否自发进行要
根据ΔH 与ΔS 综合分析,D 错误。
3.分析下列反应在任何温度下均能自发进行的是( )
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.Ag(s)+1
2Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C.HgO(s)===Hg(l)+1
2O2(g) ΔH=+91 kJ·mol-1
D.H2O2(l)===1
2O2(g)+H2O(l) ΔH=-98 kJ·mol-1
解析:选 D A 项,ΔH>0,ΔS<0,在任何温度下,ΔH-TΔS>0,即任何温度下,反应
都不能自发进行;B 项,ΔH<0,ΔS<0,在较低温度下,ΔH-TΔS<0,即反应温度不能过高;
C 项,ΔH>0,ΔS>0,若使反应自发进行,即ΔH-TΔS<0,必须提高温度,即反应只有在较
高温度时能自发进行;D 项,ΔH<0,ΔS>0,在任何温度下,ΔH-TΔS<0,即在任何温度下
反应均能自发进行。
4 . (2017· 辽 宁 营 口 模 拟 ) 在 一 定 条 件 下 的 密 封 容 器 中 , 发 生 反 应 N2(g) +
O2(g) 2NO(g) ΔH=+180.5 kJ·mol-1,下列说法正确的是( )
A.平衡后升高温度,混合气体中 N2 的含量降低
B.当 v 正(O2)=v 正(NO)时,反应达到化学平衡
C.改变压强,平衡不移动的原因是化学反应速率不变
D.1 mol N2(g)和 1 mol O2(g)反应,达到平衡时吸收的热量为 180.5 kJ
解析:选 A 该反应的正反应为吸热反应,升温后平衡正向移动,N2 的含量降低,A
项正确;所给的两个速率数据均为正反应的数据,且速率之比不等于化学计量数之比,不能
用于判断反应是否达到平衡状态,B 项错误;由于该反应是反应前后气体体积不变的反应,
加压后速率增大,但正、逆反应速率仍然相等,所以平衡不移动,C 项错误;由于该反应为
可逆反应,1 mol N2 和 1 mol O2 不可能完全反应,所以达到平衡时,吸收的热量小于 180.5 kJ,
D 项错误。
5.一定条件下,对于可逆反应 X(g)+3Y(g) 2Z(g),若 X、Y、Z 的起始浓度分别
为 c1、c2、c3(均不为零),达到平衡时,X、Y、Z 的浓度分别为 0.1 mol·L-1、0.3 mol·L-1、
0.08 mol·L-1,则下列判断正确的是( )
A.c1∶c2=3∶1
B.平衡时,Y 和 Z 的生成速率之比为 2∶3
C.X、Y 的转化率相等
D.c1 的取值范围为 00
PCl5(g)
PCl3(g)+Cl2(g)
又充入 PCl5
c(PCl5)增大,v 正>v 逆,
压强增大但不利于
PCl5 的分解,平衡正移
α(PCl5)减小,
φ(PCl5)增大
Δn=0
2HI(g)
H2(g)+I2(g)
又充入 HI
c(HI)增大,v 正>v 逆,压
强增大,对 v 正、v 逆的
影响相同,平衡正移
α(HI)不变,
φ(HI)
不变
Δn<0 2NO2(g) 又充入 c(NO2)增大,v 正>v 逆, α(NO2)增大,
N2O4(g) NO2 同时压强的增大更有
利于 NO2 的转化,平衡
正移
φ(NO2)减小
[对点练习]
1.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列
有关叙述正确的是( )
①生成物的百分含量一定增加 ②生成物的产量一定增加 ③反应物的转化率一定增大
④反应物浓度一定降低
⑤正反应速率一定大于逆反应速率 ⑥使用了合适的催化剂
A.①② B.②⑤
C.③⑤ D.④⑥
解析:选 B 催化剂对化学平衡移动无影响。增加反应物的浓度平衡正向移动,反应物
的转化率、浓度可能增大也可能减小,如合成氨中增加 N2 的浓度再次达到平衡,N2 的转化
率减小,H2 的转化率增大,N2 的浓度增大,H2 的浓度减小;若改变温度、压强使平衡正向
移动,生成物的百分含量增大,若增加反应物的浓度使平衡正向移动,生成物的百分含量可
能增大也可能减小。平衡正向移动时,生成物的产量一定增加,正反应速率一定大于逆反应
速率。
2.下列事实不能用勒夏特列原理解释的是( )
A.新制的氯水放置一段时间,溶液的 pH 减小
B.在配制硫酸亚铁溶液时往往要加入少量铁粉
C.反应 CO(g)+NO2(g) CO2(g)+NO(g) ΔH<0 达平衡后,升高温度,气体颜色
变深
D.增大压强,有利于 SO2 与 O2 反应生成 SO3
解析:选 B A 项,Cl2 溶于水发生反应:Cl2+H2O H++Cl-+HClO,HClO 不
稳定,见光容易分解,HClO 浓度减小,平衡正向移动,可以用勒夏特列原理解释;B 项,
加入铁粉的目的是防止 Fe2+被氧化,不能用勒夏特列原理解释;C 项,根据勒夏特列原理,
升高温度,平衡向吸热反应方向移动,NO2 浓度增大,气体颜色加深;D 项,根据勒夏特列
原理,增大压强,平衡向气体分子数减小的方向移动,即向生成 SO3 的方向移动。
二、等效平衡
1.含义
在一定条件下(等温等容或等温等压),对同一可逆反应体系,起始时加入物质的物质的
量不同,而达到化学平衡时,同种物质的百分含量相同。
2.原理
由于化学平衡状态与条件有关,而与建立平衡的途径无关。因而,同一可逆反应,从不
同的状态开始,只要达到平衡时条件(温度、浓度、压强等)完全相同,则可形成等效平衡。
3.等效平衡规律
[对点练习]
1.在恒温恒容条件下,可逆反应:2A(g)+B(g) 3C(g)+D(g)
ΔH=-Q1 kJ·mol-1(Q1>0),起始物质的量如表所示:
序号 A B C D
① 2 mol 1 mol 0 0
② 4 mol 2 mol 0 0
③ 1 mol 0.5 mol 1.5 mol 0.5 mol
④ 0 1 mol 3 mol 1mol
⑤ 0 0 3 mol 1 mol
(1)上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
________________________________________________________________________。
(2)达到平衡后,①放出的热量为 Q2 kJ,⑤吸收的热量为 Q3 kJ,则 Q1、Q2、Q3 的定量
关系为________________________________________________________________。
(3)其他条件不变,当 D 为固体时,上述反应达到平衡时,互为等效平衡的是哪几组?
达到平衡后,哪些量相同?__________________________________。
答案:(1)①③⑤互为等效平衡。表现在达到平衡后各物质的物质的量、质量、体积、
物质的量浓度、组分百分含量(物质的量分数、质量分数、体积分数)相同 (2)Q2+Q3=
Q1(3)①②③⑤互为等效平衡。表现在达到平衡后各组分百分含量(物质的量分数、质量分数、
体积分数)相同
2.有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入 2 mol
N2、3 mol H2,反应 N2(g)+3H2(g) 2NH3(g)达到平衡时生成 NH3 的物质的量为 m mol。
(1)相同温度下,在乙中加入 4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙
中反应达到平衡时,生成 NH3 的物质的量为________mol(从下列各项中选择,只填字母序
号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成 NH3 的物质的量
为________mol。
A.小于 m B.等于 m
C.在 m~2m 之间 D.等于 2m
E.大于 2m
(2)相同温度下,保持乙的容积为甲的一半,并加入 1 mol NH3,要使乙中反应达到平衡
时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入________mol N2
和________mol H2。
解析:(1)由于甲容器定容,而乙容器定压,当它们的压强相等达到平衡时,乙的容积
应该为甲的两倍,生成的 NH3 的物质的量应该等于 2m mol。当甲、乙两容器的体积相等时,
相当于将建立等效平衡后的乙容器压缩,故乙中 NH3 的物质的量大于 2m mol。(2)乙的容积
为甲的一半时,要建立与甲一样的平衡,只有乙中的投入量是甲的一半才行,故乙中应该投
入 N2 为(1-0.5) mol=0.5 mol,H2 为(1.5-1.5) mol=0 mol。
答案:(1)D E (2)0.5 0
[规律方法]
恒温恒压下等效平衡的分析方法——虚构箱体法
对某一可逆反应,无论反应前后气体体积是否相等,改变起始时加入物质的物质的量,
只要按化学计量数换算成同一半边的物质的物质的量,若物质的量之比与对应组分起始加入
的物质的量之比相同,则达到的平衡与原平衡等效。如在恒温、恒压条件下,可逆反应:
2SO2(g) + O2(g) 2SO3(g)
① 2 mol 1 mol 0 mol
② 4 mol 2 mol 0 mol
③ 0 mol 0 mol 4 mol
④ 2 mol 1 mol 2 mol
①②的图示如下:
对于不是恒压的条件,也可以利用此模型,即先在恒压条件下建立等效平衡然后再压缩,
比如上述①③若在恒容条件下比较,可以先在恒压条件下比较出二者是等效的,各物质的百
分含量是相同的,然后再将③的容器压缩至一半,则分析出再次平衡后 SO3 的体积分数会增
大。
[学案验收·块块过]
1.(2015·上海高考)对于合成氨反应,达到平衡后,以下分析正确的是( )
A.升高温度,对正反应的反应速率影响更大
B.增大压强,对正反应的反应速率影响更大
C.减小反应物浓度,对逆反应的反应速率影响更大
D.加入催化剂,对逆反应的反应速率影响更大
解析:选 B 合成氨反应的正反应是放热反应,升高温度,正反应、逆反应的反应速率
都增大,但是温度对吸热反应的反应速率影响更大,所以对该反应来说,对逆反应的反应速
率影响更大,A 错误。合成氨的正反应是气体体积减小的反应。增大压强,对正反应的反应
速率影响更大,正反应速率大于逆反应速率,所以平衡正向移动,B 正确。减小反应物浓度,
使正反应的反应速率减小,由于生成物的浓度没有变化,所以逆反应速率不变,逆反应速率
大于正反应速率,所以化学平衡逆向移动,C 错误。加入催化剂,使正反应、逆反应速率改
变的倍数相同,正反应、逆反应速率相同,化学平衡不发生移动,D 错误。
2.下列可逆反应达到平衡后,增大压强同时升高温度,平衡一定向右移动的是( )
A.2AB(g) A2(g)+B2(g) ΔH>0
B.A2(g)+3B2(g) 2AB3(g) ΔH<0
C.A(s)+B(g) C(g)+D(g) ΔH>0
D.2A(g)+B(g) 3C(g)+D(s) ΔH<0
解析:选 A A 项加压平衡不移动,升温平衡向右移动,正确;B 项加压平衡向右移动,
升温平衡向左移动,错误;C 项加压平衡向左移动,升温平衡向右移动,错误;D 项加压平
衡不移动,升温平衡向左移动,错误。
3.在一体积可变的密闭容器中,加入一定量的 X、Y,发生反应 mX(g) nY(g) ΔH
=Q kJ·mol-1。反应达到平衡时,Y 的物质的量浓度与温度、气体体积的关系如表所示:
气体体积/Lc (Y)/(mol·L-1)温度/℃ 1 2 4
100 1.00 0.75 0.53
200 1.20 0.90 0.63
300 1.30 1.00 0.70
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y 的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
解析:选 C 温度 100 ℃,气体体积 1 L 时,n(Y)=1 mol,气体体积 2 L 时,n(Y)=1.5
mol,则气体体积增大,n(Y)增加。气体体积增大,压强减小,平衡向气体体积增大的方向
移动,所以 m0,
B、D 错误。
4.将 NO2 装入带活塞的密闭容器中,当反应 2NO2(g) N2O4(g)达到平衡后,改变
下列一个条件,其中叙述正确的是( )
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
解析:选 C A 项,颜色加深说明平衡向左移动,所以正反应为放热反应,错误;B 项,
首先假设压缩气体平衡不移动,加压颜色加深,但平衡向右移动,使混合气体颜色在加深后
的基础上变浅,但一定比原平衡的颜色深,错误;同理 C 项,首先假设平衡不移动,若体
积减小一半,压强为原来的两倍,但平衡向右移动,使压强在原平衡两倍的基础上减小,正
确;D 项,体积不变,反应物及生成物浓度不变,所以正、逆反应速率均不变,平衡不移动,
颜色无变化,错误。
5.COCl2(g) CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温;
②恒容通入惰性气体;③增加 CO 浓度;④减压;⑤加催化剂;⑥恒压通入惰性气体,能提
高 COCl2 转化率的是( )
A.①②④ B.①④⑥ C.②③⑤ D.③⑤⑥
解析:选 B 能提高反应物转化率的方法是在不改变该反应物起始量的条件下使化学平
衡向正反应方向移动。①升温向吸热方向即正反应方向移动;②恒容通入惰性气体,各组分
浓度不变,平衡不移动;③增加 CO 浓度使平衡向逆反应方向移动;④减压使平衡向正反应
方向移动;⑤催化剂不影响平衡移动;⑥恒压通入惰性气体,参与反应的各组分分压减小,
平衡向正反应方向移动,故①④⑥符合题意。
6.[双选](2016·江苏高考)一定温度下,在 3 个体积均为 1.0 L 的恒容密闭容器中反应
2H2(g)+CO(g) CH3OH(g)达到平衡,下列说法正确的是( )
A.该反应的正反应放热
B.达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大
C.达到平衡时,容器Ⅱ中 c(H2)大于容器Ⅲ中 c(H2)的两倍
D.达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大
解析:选 AD 容器Ⅰ中,列三段式
2H2(g) + CO(g) CH3OH(g)
起始浓度(mol·L-1):0.20 0.10 0
转化浓度(mol·L-1):0.16 0.08 0.08
平衡浓度(mol·L-1):0.04 0.02 0.08
容器Ⅲ中,列三段式
2H2(g) + CO(g) CH3OH(g)
起始浓度(mol·L-1): 0 0 0.10
转化浓度(mol·L-1): 0.15 0.075 0.075
平衡浓度(mol·L-1): 0.15 0.075 0.025
A 项中,KⅠ= 0.08
0.042×0.02
=2 500,KⅢ= 0.025
0.152×0.075
≈14.81,由Ⅰ、Ⅲ比较,温度升高
平衡向左移动,所以正反应为放热反应,正确;B 项中,容器Ⅱ相当于在容器Ⅰ的基础上压
缩容器体积,压强增大,平衡右移,容器Ⅱ中的转化率比Ⅰ中大,错误;C 项中,容器Ⅱ中,
增大压强,平衡向右移动,平衡时 c(H2)要小于Ⅰ中 c(H2)的 2 倍;Ⅲ和Ⅰ比较,平衡时Ⅲ中
c(H2)>Ⅰ中 c(H2)的 2 倍,错误;D 项中,Ⅲ中温度为 500 K,Ⅰ中温度为 400 K,温度越高,
反应速率越快,正确。
[课时小测试]
1.[双选](2016·天津高考节选)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
MHx+2y(s) ΔH<0 达到化学平衡。下列有关叙述正确的是( )
A.容器内气体压强保持不变
B.吸收 y mol H2 只需 1 mol MHx
C.若降温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则 v(放氢)>v(吸氢)
解析:选 AC 该反应是气体分子数变化的反应,当气体的物质的量不变时,反应达到
平衡,容器容积不变,故压强不变,A 正确;由于该反应是可逆反应,吸收 y mol H2 需要
MHx(s)的物质的量应大于 1 mol, B 错误;该反应ΔH<0,为放热反应,降温平衡向右移动,
平衡常数增大,C 正确;若向容器中充入少量 H2,v(吸氢)>v(放氢),D 错误。
2.(2017·天津市河西区模拟)在某一恒温恒容的密闭容器中发生如下反应:3H2(g)+
N2(g) 2NH3(g) ΔH<0。t1 时刻到达平衡后,在 t2 时刻改变某一条件,其反应过程如下
图所示。下列说法正确的是( )
A.Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠⅡ;C 项,由于容器的容积不变,反应混合物都是
气体,所以在任何时刻气体的密度都不变,故Ⅰ、Ⅱ两过程不能根据气体密度是否改变判断
反应是否达到平衡状态。
3.在一恒定容积的容器中充入 4 mol A 和 2 mol B 发生反应:2A(g)+B(g) xC(g)。
达到平衡后,C 的体积分数为 w%。若维持容积和温度不变,按 1.2 mol A、0.6 mol B 和 2.8
mol C 为起始物质,达到平衡后,C 的体积分数仍为 w%,则 x 的值为( )
A.只能为 2 B.只能为 3
C.可能为 2,也可能为 3 D.无法确定
解析:选 C 根据等效平衡原理,若 x=2,则反应为前后气体体积变化的反应,将第
二种情况换算为化学方程式同一边的物质则起始投料与第一种情况相同,符合题意;若为反
应前后气体体积不变的反应,即 x=3 时,只要加入量 n(A)∶n(B)=2∶1 即可,符合题意。
4.已知 298 K 下反应 2Al2O3(s)+3C(s)===4Al(s)+3CO2(g) ΔH=+2 171 kJ·mol-1,ΔS
=+635.5 J·mol-1·K-1,则下列说法正确的是( )
A.由题给ΔH 值可知,该反应是一个放热反应
B.ΔS>0 表明该反应是一个熵增加的反应
C.该反应能自发进行
D.不能确定该反应能否自发进行
解析:选 B ΔH>0,该反应是吸热反应,A 错误;由ΔH-TΔS=2 171 kJ·mol-1-298
K×0.635 5 kJ·mol-1·K-1>0 知,该反应不能自发进行,C、D 错误。
5.(2017·成都模拟)工业上用 DME 法以 H2 和 CO 为原料生产甲醚(CH3OCH3)。其原理
是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g) CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
改变温度,实验数据如表所示,下列分析正确的是( )
温度(℃) 260 270 280 290 300 310 320
CO 转化率(%) 92 87 82 80 72 65 62
CH3OCH3 产率(%) 33 45 77 79 62 58 52
A.反应①、②均为吸热反应
B.290 ℃时反应②平衡常数值达到最大
C.反应①与②中 CH3OH 的消耗速率一定相等
D.增大压强能增大 CH3OCH3 产率
解析:选 D 从反应①来看,温度升高,转化率一直在减小,说明①为放热反应,而反
应②在较低温度时,反应均未达到平衡,甲醇的产率主要受温度影响,随着温度升高,产率
降低,说明反应②也是放热反应,A 错误;平衡常数与转化率并不是一个概念,B 错误;反
应①与②中 CH3OH 的消耗速率不相等,因为二者不是同一个反应,C 错误;增大压强,反
应①向正反应方向移动,使 c(CH3OH)增大,从而使反应②也向正反应方向移动,则 CH3OCH3
产率增大,D 正确。
6.在恒温、恒压下,a mol X 和 b mol Y 在一个容积可变的容器中发生反应:X(g)+
2Y(g) 2Z(g),一段时间后达到平衡,生成 n mol Z。则下列说法中正确的是( )
A.物质 X、Y 的转化率之比为 1∶2
B.起始时刻和达到平衡后容器中的压强之比为(a+b)∶ a+b-n
2
C.当 2v 正(X)=v 逆(Y)时,反应一定达到平衡状态
D.充入惰性气体(如 Ar),平衡向正反应方向移动
解析:选 C 根据化学方程式,X、Y 转化的物质的量分别为 0.5n mol、n mol,故 X、
Y 的转化率之比为0.5n
a
∶n
b
=b∶2a,A 项错误;由于该反应在恒温、恒压下进行,因此起始
时和平衡时容器中的压强之比为 1∶1,B 项错误;当 2v 正(X)=v 逆(Y)时,正、逆反应速率
相等,反应达到平衡状态,C 项正确;充入惰性气体(如 Ar),由于保持恒压,则容器体积增
大,平衡向气体分子数增多的方向(逆反应方向)移动,D 项错误。
7.对于平衡体系:aA(g)+bB(g) cC(g)+dD(g) ΔH<0,下列判断,其中正确的
是( )
A.若温度不变,容器体积扩大一倍,此时气体 A 的浓度是原来的 0.48 倍,则 a+b>c
+d
B.若从正反应开始,平衡时,气体 A、B 的转化率相等,则起始时气体 A、B 的物质
的量之比为 b∶a
C.若平衡体系中共有气体 m mol,再向其中充入 n mol B,达到平衡时气体总物质的量
为(m+n)mol,则 a+b=c+d
D.若 a+b=c+d,则对于体积不变的容器,升高温度,平衡向左移动,容器中气体的
压强不变
解析:选 C 若温度不变,容器体积扩大一倍,如果反应前后气体分子数不变,则 A
的浓度为原来的 0.5 倍,现为原来的 0.48 倍,说明平衡向气体分子数增多的方向(正反应方
向)移动,则 a+b”、“<”或“=”)。
解析:容积为 5 L 的恒容密闭容器中充入 0.4 mol SO2 和 0.2 mol O2,设反应前后 O2 消
耗了 x mol,三段式解题:
2SO2(g)+O2(g) 2SO3(g)
起始(mol) 0.4 0.2 0
转化(mol) 2x x 2x
平衡(mol) 0.4-2x 0.2-x 2x
当反应达到平衡时,容器内压强变为起始时的 0.7 倍,得到0.4-2x+0.2-x+2x
0.4+0.2
=0.7,
解得 x=0.18,则
2SO2(g)+O2(g) 2SO3(g)
起始(mol) 0.4 0.2 0
转化(mol) 0.36 0.18 0.36
平衡(mol) 0.04 0.02 0.36
(1)a 项,SO2、O2、SO3 三者的浓度之比和化学计量数之比相等,与反应是否平衡没有
必然联系,不能作为平衡标志;b 项,因该平衡是一个恒容条件下的化学平衡,反应前后气
体的物质的量发生变化,压强不变,说明气体总量已经不变,化学反应达到了平衡状态;c
项,因该平衡是恒容条件下的化学平衡状态,反应物和生成物均为气体,则气体质量恒定,
气体密度恒定,不能作为达到平衡状态的标志;d 项,SO3 的物质的量不再变化,可逆反应
达到平衡状态;e 项,SO2 的生成速率和 SO3 的生成速率相等,可逆反应达到平衡状态。
(2)①SO2 的转化率为0.36 mol
0.4 mol
×100%=90%;②达到平衡时反应放出的热量=0.36 mol
2 mol
×196
kJ=35.28 kJ。(3)该反应为放热反应,升高温度,平衡逆向移动,SO2 的体积分数增大,得
到温度关系:T1
相关文档
- 2020届高考化学一轮复习化学反应速2021-07-0918页
- 2020届高考化学一轮复习化学工艺流2021-07-0919页
- 2021届高考化学一轮复习化学平衡常2021-07-0919页
- 2020届高考化学一轮复习化学反应与2021-07-098页
- 2021届高考化学一轮复习化学平衡状2021-07-0910页
- 2020版高考一轮复习化学通用版学案2021-07-0821页
- 2020届高考化学一轮复习化学能与热2021-07-086页
- 2020届高考化学一轮复习化学反应与2021-07-085页
- 2020届高考化学一轮复习化学平衡学2021-07-0833页
- 2020届高考化学一轮复习化学反应原2021-07-0832页