- 957.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
化学反应热
可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4
P~31 Cu~64 Ba~137 Ca~40 Cu~64 Mg~24
、选择题(本大题共 15 小题。在每小题给出的四个选项中,只有一个选项是符合题目要求的)
1.下列说法正确的是( )
A.吸热反应不加热就不会发生
B.需要加热才能发生的反应一定是吸热反应
C.根据反应物和生成物具有总能量的相对大小可确定反应热
D.放热的反应在常温下一定很容易发生
2.对于一定不能自发进行的反应来说,反应后体系的( )
A.混乱度增大,而能量降低 B.混乱度减少,而能量增加
C.混乱度减少,能量降低 D.混乱度增大,能量增加
3.在 273 K.101kPa.催化剂存在的条件下,发生了某化学反应,书写该反应的热化学方程式时,一
般不需注明的是( )
A.反应物或生成物的状态 B.反应时的温度 C.反应时的压强
D.反应时所用的催化剂
4.最新报道:科学家首次用 X 射线激光技术观察到 CO 与 O 在催化剂表面形成化学键的过程。反应过
程的示意图如下:
下列说法中正确的是
A.CO 和 O 生成 CO2 是吸热反应 B.在该过程中,CO 断键形成 C 和 O
C.CO 和 O 生成了具有极性共价键的 CO2 D.状态Ⅰ →状态Ⅲ表示 CO 与 O2 反应的过程
5. 右图是一个一次性加热杯的示意图,当水袋破裂时,水与固体碎块混合,杯内食物温度逐渐上升,
制造此加热杯可选用的固体碎块是( )
A. 硝酸铵 B. 生石灰
C. 氯化镁 D. 食盐
6.下列热化学方程式中的△H 能表示物质燃烧热的是( )
A.2CO (g) + O2 (g) ﹦ 2CO2 (g) ;△H = -556kJ·mol-1
B.CH4 (g) + 2O2 (g) ﹦ CO2 (g) + 2H2O (l) ;△H = -890.3kJ·mol-1
C.2H2 (g) +O2 (g) ﹦ 2H2O(l) ;△H = -571.6kJ·mol-1
D.H2 (g ) +1/2O2 (g) ﹦ H2O (g) ;△H = -241.8kJ·mol-1
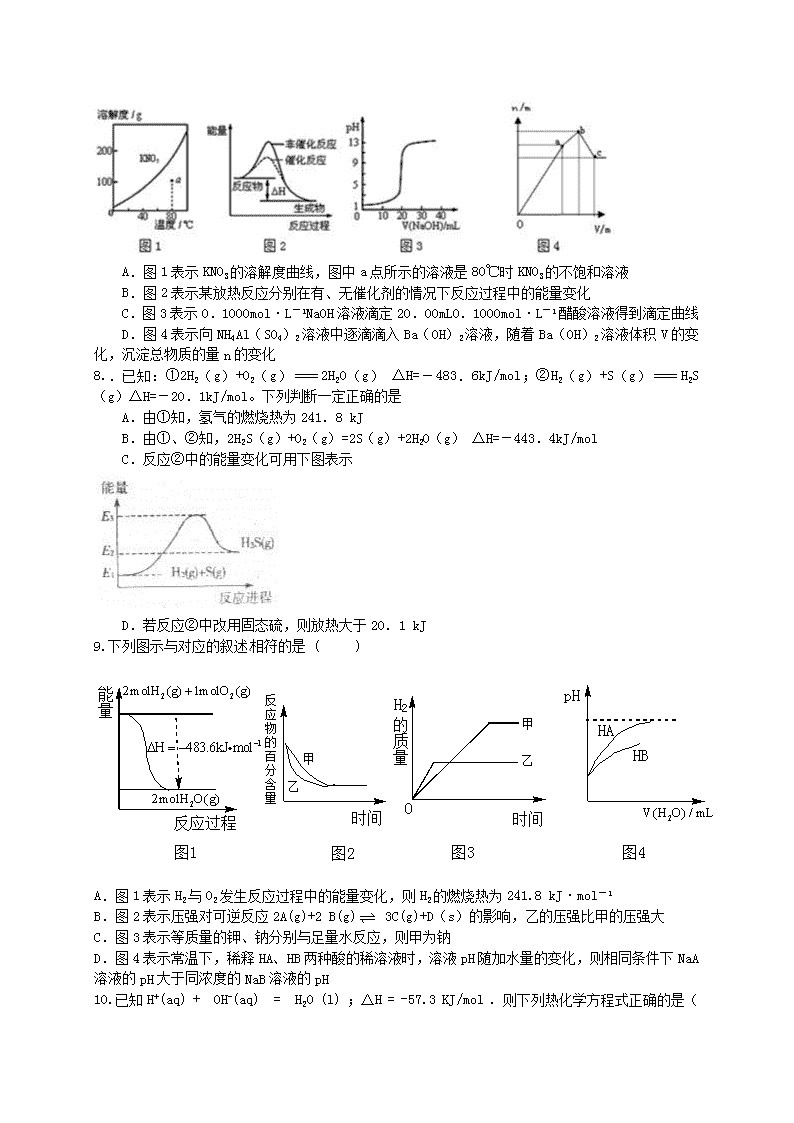
7..下列图示与对应的叙述不相符的是
A.图 1 表示 KNO3 的溶解度曲线,图中 a 点所示的溶液是 80℃时 KNO3 的不饱和溶液
B.图 2 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
C.图 3 表示 0.1000mol·L-1NaOH 溶液滴定 20.00mL0.1000mol·L-1 醋酸溶液得到滴定曲线
D.图 4 表示向 NH4Al(SO4)2 溶液中逐滴滴入 Ba(OH)2 溶液,随着 Ba(OH)2 溶液体积 V 的变
化,沉淀总物质的量 n 的变化
8..已知:①2H2(g)+O2(g) 2H2O(g) △H=-483.6kJ/mol;②H2(g)+S(g) H2S(g)
△H=-20.1kJ/mol。下列判断一定正确的是
A.由①知,氢气的燃烧热为 241.8 kJ
B.由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g) △H=-443.4kJ/mol
C.反应②中的能量变化可用下图表示
D.若反应②中改用固态硫,则放热大于 20.1 kJ
9.下列图示与对应的叙述相符的是 ( )
时间时间
甲
乙
甲 乙
H2
的
质
量
pH
HA
HB
反
应
物
的
百
分
含
量 O
2 22molH (g) 1molO (g)
1H 483.6kJ mol
22molH O(g)
能
量
反应过程
图1 图2 图3 图4
2V(H O) / mL
A.图 1 表示 H2 与 O2 发生反应过程中的能量变化,则 H2 的燃烧热为 241.8 kJ·mol-1
B.图 2 表示压强对可逆反应 2A(g)+2 B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图 3 表示等质量的钾、钠分别与足量水反应,则甲为钠
D.图 4 表示常温下,稀释 HA、HB 两种酸的稀溶液时,溶液 pH 随加水量的变化,则相同条件下 NaA
溶液的 pH 大于同浓度的 NaB 溶液的 pH
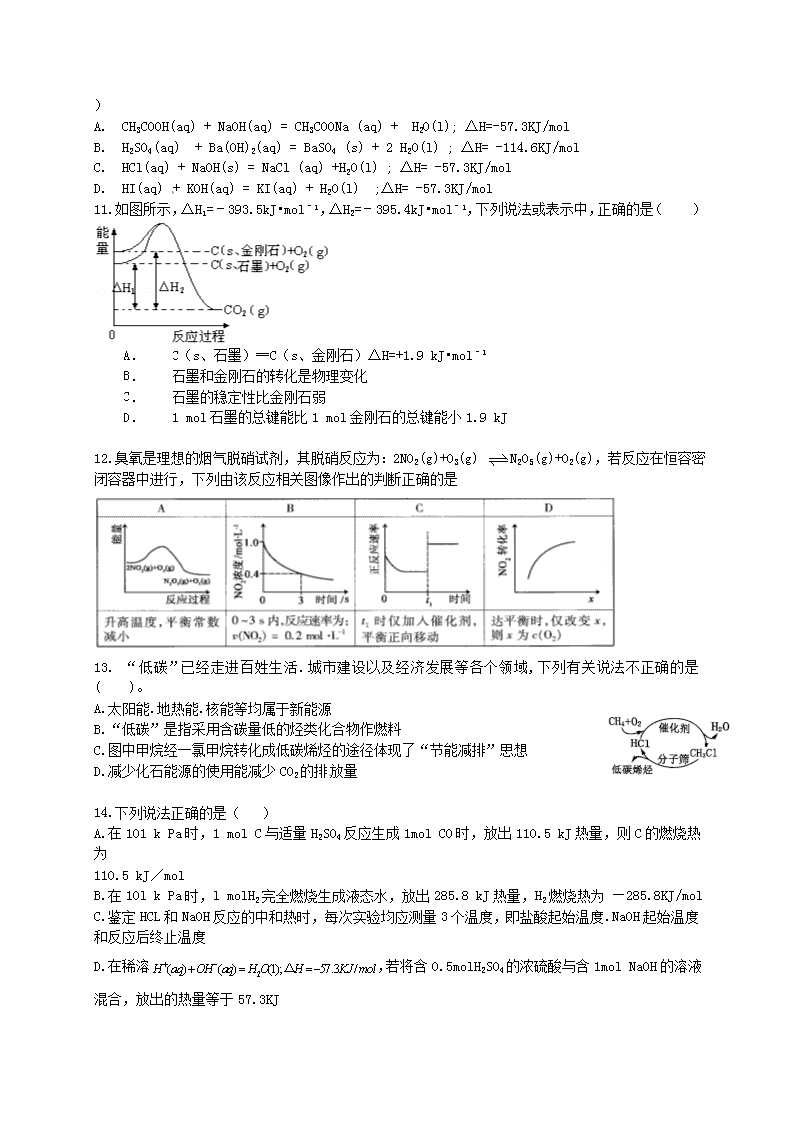
10.已知 H+(aq) + OH-(aq) = H2O (l) ;△H = -57.3 KJ/mol . 则下列热化学方程式正确的是
( )
A. CH3COOH(aq) + NaOH(aq) = CH3COONa (aq) + H2O(l); △H=-57.3KJ/mol
B. H2SO4(aq) + Ba(OH)2(aq) = BaSO4 (s) + 2 H2O(l) ; △H= -114.6KJ/mol
C. HCl(aq) + NaOH(s) = NaCl (aq) +H2O(l) ; △H= -57.3KJ/mol
D. HI(aq) + KOH(aq) = KI(aq) + H2O(l) ;△H= -57.3KJ/mol
11.如图所示,△H1=﹣393.5kJ•mol﹣1,△H2=﹣395.4kJ•mol﹣1,下列说法或表示中,正确的是( )
A. C(s、石墨)═C(s、金刚石)△H=+1.9 kJ•mol﹣1
B. 石墨和金刚石的转化是物理变化
C. 石墨的稳定性比金刚石弱
D. 1 mol 石墨的总键能比 1 mol 金刚石的总键能小 1.9 kJ
12.臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) N2O5(g)+O2(g),若反应在恒容密
闭容器中进行,下列由该反应相关图像作出的判断正确的是
13. “低碳”已经走进百姓生活.城市建设以及经济发展等各个领域,下列有关说法不正确的是
( )。
A.太阳能.地热能.核能等均属于新能源
B.“低碳”是指采用含碳量低的烃类化合物作燃料
C.图中甲烷经一氯甲烷转化成低碳烯烃的途径体现了“节能减排”思想
D.减少化石能源的使用能减少 CO2 的排放量
14.下列说法正确的是( )
A.在 101 k Pa 时,1 mol C 与适量 H2SO4 反应生成 1mol CO 时,放出 110.5 kJ 热量,则 C 的燃烧热
为
110.5 kJ/mol
B.在 10l k Pa 时,l molH2 完全燃烧生成液态水,放出 285.8 kJ 热量,H2 燃烧热为 —285.8KJ/mol
C.鉴定 HCL 和 NaOH 反应的中和热时,每次实验均应测量 3 个温度,即盐酸起始温度.NaOH 起始温度
和反应后终止温度
D.在稀溶 2( ) ( ) (1); 57.3 /H aq OH aq H O H KJ mol △ ,若将含 0.5molH2SO4 的浓硫酸与含 1mol NaOH 的溶液
混合,放出的热量等于 57.3KJ
15.图中 A 表示硝酸钾和氢氧化钙的溶解度随温度变化的情
况。B 中甲.乙试管分别盛有硝酸钾.氢氧化钙的饱和溶液,试
管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管
中固体增加,乙试管中的固体减少,则加入的物质可能是( )
A.硝酸铵 B.氢氧化钠
C.浓硫酸 D.氯化钠
、填空、实验、简答题(本大题共 3 小题)
16.判断正误,正确的画“√”错误的画“×”
(1)1mol 纯物质完全燃烧时所放出的热量,叫该物质的燃烧热。 ( )
(2)放热反应都是自发进行的反应,吸热反应都是非自发进行的反应。 ( )
(3)同一种物质不同状态时的熵值大小关系为 S(g)﹥S(l)﹥S(s) ( )
(4)对于反应 2NO2(g) N2O4(g);△H<0,升温正、逆反应速率都增大 ( )
(5)强电解质溶液的导电能力一定比弱电解质溶液强 ( )
(6)中和等体积,等物质的量浓度的盐酸和醋酸溶液,盐酸消耗氢氧化钠多 ( )
17.用 O2 将 HCl 转化为 Cl2,可提高效益,减少污染,
(1)传统上该转化通过如右图所示的催化剂循环实现,
其中,反应①为 2HCl(g) + CuO(s) H2O(g)+CuCl2(g) △H1
反 应 ② 生 成 1molCl2 的 反 应 热 为 △ H2 , 则 总 反 应 的 热 化 学 方 程 式
为 , (反应热用△H1 和△H2 表示)。
(2)新型 RuO2 催化剂对上述 HCl 转化为 Cl2 的总反应具有更好的催化活性,
①实验测得在一定压强下,总反应的 HCl 平衡转化率随温度变化的ɑHCl—T 曲线如图,则总反应的△H
0 ,(填“>”、“﹦”或“<”);A、B 两点的平衡常数 K(A)与 K(B)中较大的是 。
②在上述实 验中若压缩体 积使压强增大 ,画出相应 ɑ HCl—T 曲线的示 意图,并简要 说明理
由 。
③下列措施中有利于提高ɑHCl 的有 。
A、增大 n(HCl) B、增大 n(O2)
C、使用更好的催化剂 D、移去 H2O
温度
A 图 B 图
加入物质甲 乙
水
KNO3
Ca(OH)2
Ca(OH)2
KNO3
溶
解
度
0
(3)一定条件下测得反应过程汇总 n(Cl2)的数据如下:
计算 2.0~6.0min 以内 HCl 的物质的量变化表示的反应速率(以 mol·min-1 为单位,写出计算过程)。
(4)Cl2 用途广泛,写出 Cl2 制备漂白粉的化学方程式。
18.近年来对 CO2 的有效控制及其高效利用的研究正引起全球广泛关注。据中国化工报报道,美国科
学家发现了一种新的可将 CO2 转化为甲醇的高活性催化体系,比目前工业使用的常见催化剂快近 90
倍。由 CO2 制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g) +H2O(g);△H 1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+ H2(g) CO (g)+H2O(g);△H 2
反应Ⅲ:CO(g)+2 H2(g) CH3OH(g);△H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H 2= ,反应Ⅲ自发进行条件是 (填“较低温”、“较高温”或“任
何温度”)。
(2)在一定条件下 2L 恒容密闭容器中充入一定量的 H2 和 CO2 仅发生反应Ⅰ,实验测得在不同反应物
起始投入量下,反应体系中 CO2 的平衡转化率与温度的关系曲线,如下图所示。
①据图可知,若要使 CO2 的平衡转化率大于 40%,以下条件中最合适的是 。
A.n(H2)=3mol,n(CO2)=1.5mol; 650K
B.n(H2)=3mol,n(CO2)=1.7mol;550K
C.n(H2)=3mol,n(CO2)=1.9mol; 650K
D.n(H2)=3mol,n(CO2)=2.5mol;550K
②在温度为 500K 的条件下,充入 3mol H2 和 1.5mol CO2,该反应 10min 时达到平衡:
a.用 H2 表示该反应的速率为 ;
b.该温度下,反应 I 的平衡常数 K= ;
c.在此条件下,系统中 CH3OH 的浓度随反应时间的变化趋势如图所示,当反应时间达到 3min 时,迅
速将体系温度升至 600K,请在图中画出 3~10min 内容器中 CH3OH 浓度的变化趋势曲线。
(3)某研究小组将一定量的 H2 和 CO2 充入恒容密闭容器中并加入合适的催化剂(发生反应 I、Ⅱ、Ⅲ),
测得了不同温度下体系达到平衡时 CO2 的转化率(a)及 CH3OH 的产率(b),如图所示,请回答问题:
① 该 反 应 达 到 平 衡 后 , 为 同 时 提 高 反 应 速 率 和 甲 醇 的 生 成 量 , 以 下 措 施 一 定 可 行 的
是 (选填编号)。
A.改 用高效催化剂 B.升高温度 C.缩小容器体积 D.分离出甲
醇 E.增加 CO2 的浓度
②据图可知当温度高于 260℃后,CO 的浓度随着温度的升高而 (填“增大”、“减小”、“不
变”或“无法判断”),其原因是 。
2016 万卷作业卷(化学反应热)答案解析
、选择题
19.C
20.B
21.D
22.【答案】C
【解析】 根据能量--反应过程的图像知,状态 I 的能量高于状态 III 的能量,故该过程是放热反
应,A 错误;根据状态 I、II、III 可以看出整个过程中 CO 中的 C 和 O 形成的化学键没有断裂,故 B
错误;由图 III 可知,生成物是 CO2,具有极性共价键,故 C 正确;状态Ⅰ →状态Ⅲ表示 CO 与 O 反
应的过程,故 D 错误。
23.B
【解析】
24.B
【解析】
25.C
【解析】
26.B
【解析】
27.C
【解析】
28.D【解析】
29.
考点:化学能与热能的相互转化..
专题:化学反应中的能量变化.
分析:先根据图写出对应的热化学方程式,然后根据盖斯定律写出石墨转变成金刚石的热化
学方程式,根据物质的能量越低越稳定,拆化学键吸收能量,形成化学键放出热量来
解答.
解答:由图得:①C(S,石墨)+O2(g)=CO2(g)△H=﹣393.5kJ•mol﹣1
②C(S,金刚石)+O2(g)=CO2(g)△H=﹣395.4kJ•mol﹣1,
利用盖斯定律将①﹣②可得:C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol﹣1,则
A、因 C(s、石墨)=C(s、金刚石)△H=+1.9kJ•mol﹣1,故 A 正确;
B、石墨转化为金刚石是发生的化学反应,属于化学变化,故 B 错误;
C、金刚石能量大于石墨的总能量,物质的量能量越大越不稳定,则石墨比金刚石稳
定,故 C 错误;
D、依据热化学方程式 C(S,石墨)=C(S,金刚石)△H=+1.9kJ•mol﹣1,1 mol 石墨
的总键能比 1 mol 金刚石的总键能大于 1.9 kJ,故 D 错误;
故选 A.
点评:本题考查根据图象信息书写热化学方程式,题目难度不大,注意物质的稳定性与能量
的关系.
30.A
31.B【解析】太阳能.风能.核能.生物质能.地热能等均属于新能源,A 正确;图中甲烷经一氯甲烷转
化成低碳烯烃的途径体现了“节能减排”思想,C 正确;减少化石能源的使用能有效减少 CO2 排放量,
是实现“低碳经济”的重要途径,D 正确;“低碳”意指较低的温室气体排放,并非指采用含碳量低的
烃类化合物作燃料,B 不正确。
32.C【解析】燃烧热:在 101 k Pa 时 1.mol...可燃物完全燃烧生成稳定的氧化物......时所放出的热量。
中和热:在稀溶液...中,强酸和强碱发生中和反应生成 1mol 水时的反应热。
【错误分析】本题有的同学对燃烧热.中和热的概念搞不清容易误选 B 或者 C
33.A【解析】依题意:甲.乙两支试管中分别为 KNO3 和 Ca(OH)2 的饱和溶液,而氢氧化钠.浓硫酸两
种物质溶于水时均放出大量的热,氯化钠物质溶于水时无热效应,硝酸铵物质溶于水时均吸收大量
的热,所以答案只有 A。
、填空、实验、简答题
34.
(1) ( × ) (2) ( × ) (3) ( √ )
(4) ( √ ) (5) ( × ) (6) ( × )
35.
36. (1)△H2=+41.19 kJ•mol-1;较低温
(2)①B; ②a. 1 10.135mol minL ; b.200
c.
(3)①CE;②增大;反应 I、反应 III 均为放热反应,温度升高不利于 CO2、CO 转化为甲醇;反应 II
为吸热反应,温度升高使更多的 CO2 转化为 CO。综上所述,CO 的浓度一定增大(或其他合理答案)
相关文档
- 2020届高考化学一轮复习铝及其重要2021-07-0920页
- 通用版五年2016_2020高考化学真题2021-07-0928页
- 2019届高考化学一轮复习烃的含氧衍2021-07-098页
- 2020版高考化学一轮复习生命中的基2021-07-0915页
- 2019届高考化学一轮复习分子结构与2021-07-0925页
- 2020届高考化学一轮复习晶体结构与2021-07-099页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 高考化学试题分类汇编2021-07-0938页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 高考化学第一轮复习课件第2讲 富2021-07-096页