- 34.83 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年全国卷高考化学总复习《探索生活材料》专题突破
【考纲要求】
1、了解合金、概念、组成、性能、用途;
2、能描述金属腐蚀的化学原理、金属防护的常用方法;
3、了解水泥、玻璃和陶瓷的主要生产原料、化学成分及其用途;认识光导纤维和高温结构陶瓷等新型材料;
4、生活中常用合成高分子材料的化学成分、性能以及高分子材料的使用对人类生活质量和环境质量的影响;
学习重点:
1、各种生活材料的成分、用途及性能
2、玻璃陶瓷和水泥的主要成分和生产原理
学习难点:析氢腐蚀和吸氧腐蚀的电极反应方程式
【考点梳理】
考点一、合金
1.合金:由两种或两种以上金属(或与非金属)熔合而成的具有金属特性的物质。
2.合金的物理性质
(1)一般情况下,合金比纯金属硬度大。原因:合金内加入了其他元素或大或小的原子,改变了金属原子有规则的层状排列,使原子层之间的相对滑动变得困难。因此,在一般情况下,合金比纯金属硬度大。
(2)多数合金的熔点一般比各成分金属的低
(3)合金具有良好的物理、化学和机械的性能。
要点诠释:
①合金具有固定的熔沸点(有别于其他混合物)。不要认为合金为几种物质的简单混合。
②不要认为只有不同的金属间能形成合金,金属与非金属熔合也可能形成合金,如生铁主要由铁和石墨组成。
③合金的硬度一般比纯金属大,但钠、钾合金在常温下为液态。
④一般来说,合金的性质并不是各成分金属性质的总和,而是“取长补短”;合金的性能可以通过所添加的合金元素的种类、含量和生成合金的条件等来加以调节。
3.使用合金
(1)铁合金
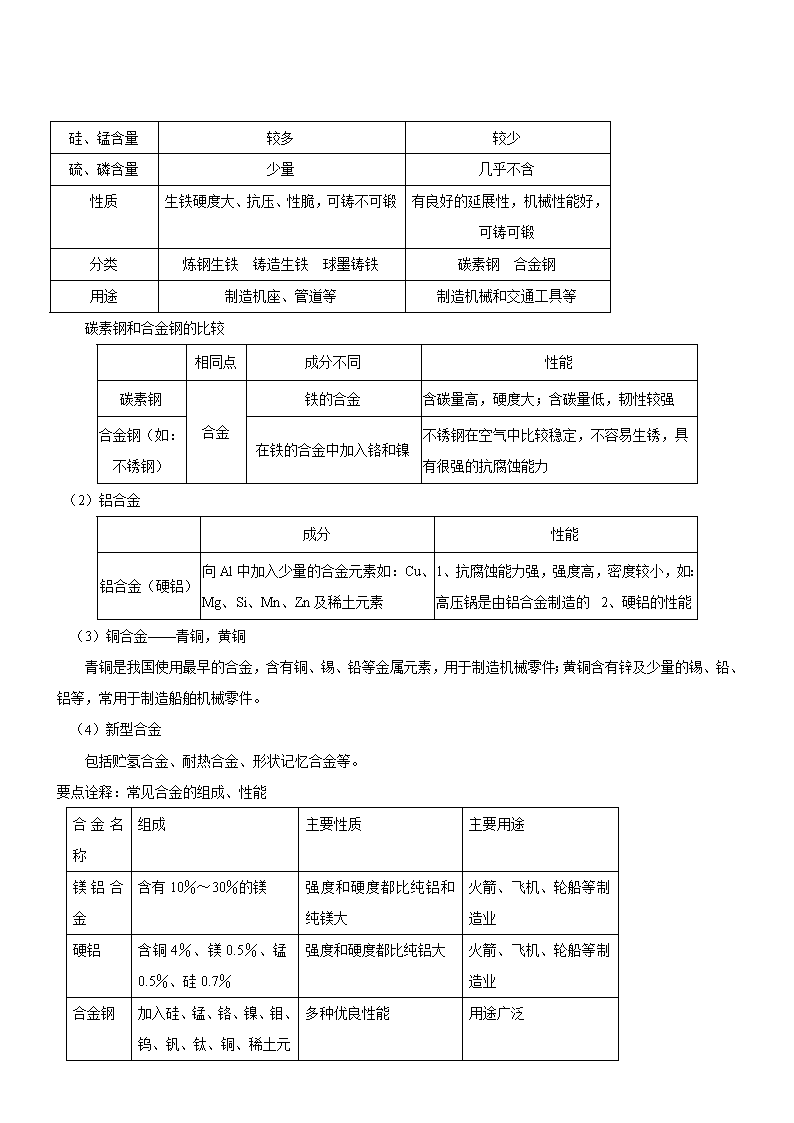
根据含碳量的不同,将铁的合金分为生铁和钢。
生铁
钢
含碳量
2%~4.3%
0.3%~2%
硅、锰含量
较多
较少
硫、磷含量
少量
几乎不含
性质
生铁硬度大、抗压、性脆,可铸不可锻
有良好的延展性,机械性能好,可铸可锻
分类
炼钢生铁 铸造生铁 球墨铸铁
碳素钢 合金钢
用途
制造机座、管道等
制造机械和交通工具等
碳素钢和合金钢的比较
相同点
成分不同
性能
碳素钢
合金
铁的合金
含碳量高,硬度大;含碳量低,韧性较强
合金钢(如:不锈钢)
在铁的合金中加入铬和镍
不锈钢在空气中比较稳定,不容易生锈,具有很强的抗腐蚀能力
(2)铝合金
成分
性能
铝合金(硬铝)
向Al中加入少量的合金元素如:Cu、Mg、Si、Mn、Zn及稀土元素
1、抗腐蚀能力强,强度高,密度较小,如:高压锅是由铝合金制造的
2、硬铝的性能
(3)铜合金——青铜,黄铜
青铜是我国使用最早的合金,含有铜、锡、铅等金属元素,用于制造机械零件;黄铜含有锌及少量的锡、铅、铝等,常用于制造船舶机械零件。
(4)新型合金
包括贮氢合金、耐热合金、形状记忆合金等。
要点诠释:常见合金的组成、性能
合金名称
组成
主要性质
主要用途
镁铝合金
含有10%~30%的镁
强度和硬度都比纯铝和纯镁大
火箭、飞机、轮船等制造业
硬铝
含铜4%、镁0.5%、锰0.5%、硅0.7%
强度和硬度都比纯铝大
火箭、飞机、轮船等制造业
合金钢
加入硅、锰、铬、镍、钼
多种优良性能
用途广泛
、钨、钒、钛、铜、稀土元素等
锰钢
含锰9%~14%
硬度和强度很大
制造粉碎机、球磨机、钢轨
黄铜
含锌20%~36%,常加入少量锡、铅、铝
有良好的强度和塑性、易加工、耐腐蚀
机器零件、仪表和日用品
青铜
含锡10%~30%
有良好的强度和塑性、耐磨、耐腐蚀
机械零件如轴承、齿轮等
钛合金
含铝6%、钒4%
耐高温、耐腐蚀、高强度
用于宇航、飞机、造船、化学工业
金合金
加入银、铜、稀土元素等
有光泽、易加工、耐磨、耐腐蚀、易导电
金饰品、电子元件、钱币、笔尖
考点二、金属的腐蚀与防护
1.金属腐蚀的本质:金属原子(M)失去电子生成金属阳离子。
M-ne-==Mn+
2.化学腐蚀和电化学腐蚀的比较。
化学腐蚀
电化学腐蚀
条件
金属跟接触的物质直接反应
不纯金属或合金跟电解质溶液接触
现象
不产生电流
有微弱的电流产生
反应
金属被氧化
较活泼的金属被氧化
相互关系
化学腐蚀和电化学腐蚀往往同时发生
3.钢铁的吸氧腐蚀和析氢腐蚀。
(1)吸氧腐蚀和析氢腐蚀的比较。
类型
吸氧腐蚀
析氢腐蚀
条件
水膜呈弱酸性或中性
水膜呈酸性
正极反应(O2)
O2+2H2O+4e-==4OH-
2H++2e-==H2↑
负极反应(Fe)
Fe-2e-==Fe2+
Fe-2e-==Fe2+
总反应式
4Fe+3O2+6H2O==4Fe(OH)3
Fe+2H+==Fe2++H2↑
(2)铁锈(Fe2O3·nH2O)的生成过程:钢铁发生吸氧腐蚀而生锈。发生的化学反应为:
正极:O2+2H2O+4e-==4OH-
负极:2Fe-4e-==2Fe2+
Fe2++2OH-==Fe(OH)2↓
4Fe(OH)2+O2+2H2O==4Fe(OH)3
2Fe(OH)3==Fe2O3·H2O+2H2O
要点诠释:
①金属的腐蚀主要是电化学腐蚀。
②在金属活动顺序表中H以后的金属只能发生吸氧腐蚀。
③钢铁表面呈弱酸性的原因:H2O+CO2H2CO3、H2CO3HCO3-+H+。
4.金属腐蚀的防护方法
(1)改变金属内部组成结构,可以增强金属耐腐蚀的能力。如将Cr、Ni等金属加进钢里制成合金钢。
(2)在金属表面覆盖一层保护层,以断绝金属与外界物质接触,达到耐腐蚀的效果如油脂、油漆、搪瓷、塑料、电镀(Zn,Cr等易氧化形成致密的氧化物薄膜)金属。
(3)电化学保护法
①牺牲阳极的阴极保护法:形成原电池反应时,让被保护金属做正极、不反应、被保护;而活泼金属做负极、被氧化。例如:轮船外壳贴锌块,并及时更换。
注:牺牲阳极的阴极保护法实则消耗负极(如锌)、保护正极(如铁)。
②外加电源的阴极保护法,如大型水坝的船闸的保护就是让铁闸门和电源负极相连。
考点三、玻璃、陶瓷和水泥
1.玻璃
(1)主要原料
纯碱(Na2CO3)、石灰石(CaCO3)和石英(SiO2)。
(2)生产原理:复杂的物理、化学变化,主要反应是:
Na2CO3+SiO2Na2SiO3+CO2↑
CaCO3+SiO2CaSiO3+CO2↑
(3)玻璃的主要成分:Na2SiO3、CaSiO3、SiO2
2.陶瓷
(1)主要原料:黏土;
(2)反应原理:复杂的物理、化学变化
(3)陶瓷的性质:抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型。
3.水泥
(1)主要原料:粘土和石灰石;辅助原料:石膏—作用是调节水泥硬化速度。
(2)反应原理:复杂的物理、化学变化
(3)主要成分:硅酸三钙(3CaO·SiO2)、硅酸二钙(2CaO·SiO2)、铝酸三钙(3CaO·Al2O3)等。
(4)主要性质:①水硬性;②吸水性。
4.玻璃和陶瓷的新发展
(1)光导纤维
光导纤维简称光纤,是一种能高质量传导光的玻璃纤维。特点:传导光的能力非常强,信息量大,抗干扰性能好。不发生电辐射,防窃听,不怕腐蚀,铺设方便等。
(2)高温结构陶瓷
①氧化铝陶瓷:又称人造刚玉,具有熔点很高、硬度高的优点。可用于作坩埚、高温炉管、球磨机、高压钠灯的灯管等。
②氮化硅陶瓷
③碳化硅陶瓷等
考点四、塑料、纤维和橡胶
1.合成材料
(1)塑料
①塑料:主要成分是合成树脂。
②树脂:是指还没有跟各种添加剂混合的高聚物。
③分类:按受热特征
a:热塑性塑料—线型,受热软化,可反复塑制
b:热固性塑料—体型,加工成型后不受热熔化
(2)纤维
常见纤维的种类及主要性能如表
常见纤维
化学组成
主要性能
天然纤维
棉纤维
纤维素
吸水性好,易干,穿着舒适,不起静电,不耐磨
蚕丝
蛋白质
吸水性好,手感柔和,有光泽,不起静电,不起球
羊毛
蛋白质
弹性强,隔热性、保暖性好;水洗后收缩,易起球
化学纤维
人造纤维
纤维素
吸水性好,穿着舒适,不起静电,不耐洗;不耐穿
合成纤维
各种线性有机高分子
强度高,耐磨,不易染色;吸湿性、透气性差
(3)橡胶
①天然橡胶:天然橡胶是一种以聚异戊二烯为主要成分的天然高分子化合物。
②合成橡胶:以异戊二烯为单体进行聚合反应,就制得合成橡胶——异戊橡胶。随着石油化工的发展,人们开发了一系列的合成橡胶。常用的有丁苯橡胶、顺丁橡胶、氯丁橡胶等,它们都是通用橡胶。特种橡胶有耐热和耐酸碱的氟橡胶、耐高温和耐严寒的硅橡胶等。
③硫化橡胶:用硫与橡胶分子作用,使线性橡胶分子间通过硫桥交联起来,形成体型网状结构。
2.复合材料
复合材料是以一种材料为基体,另一种材料为增强体组合而成的材料。各种材料在性能上互相取长补短,产生协同效应,使复合材料的综合性能优于原组成材料而满足各种不同的要求。玻璃钢就是玻璃纤维和合成树脂组成的复合材料。
【典型例题】
类型一:合金
例1.有关合金的叙述不正确的是( )
A.合金的熔点比它的各成分金属的熔点低 B.合金一定是金属熔合而成的物质
C.合金的硬度和强度一般比纯金属高 D.硬铝、黄铜、钢等均为合金
【思路点拨】合金是由两种或两种以上金属(或与非金属)熔合而成的具有金属特性的物质。
【答案】B
【解析】合金有如下三个特征:熔、沸点一般比任一组分低,硬度比任一组分大,密度介于两者之间。
【总结升华】通过添加合金元素的种类、含量和生成合金的条件等调节其性能,使合金具有良好的物理、化学和机械的性能。其硬度比纯金属大、熔点一般比各成分金属的低。总之,合金的性质优于金属单质。另外根据人们的需要还研制出具有特殊功能、性质的新型合金。
举一反三:
【变式1】以下叙述不正确的是( )
A.不锈钢是化合物
B.黄铜是合金
C.钛和钛合金是制造飞机轮胎的重要材料
D.铝是地壳中含量最多的金属元素
【答案】A
【解析】不锈钢和黄铜都是合金,属于混合物。钛和钛合金因具有强度高、耐蚀性好等特点,被广泛用于各个领域。地壳中元素含量的前五位是氧、硅、铝、铁、钙。
【变式2】下列说法不正确的是( )
A.我国最早使用的合金是由铜锌合金制成的青铜器
B.储氢合金是一类能大量吸收H2,并与H2结合成金属氢化物的材料
C.一般汽车配件中的发动机使用的是密度小、强度大且耐腐蚀的铝合金材料
D.钛合金、形状记忆合金、耐热合金以及储氢合金都属于新型合金
【答案】A
【解析】青铜器是指铜锡合金。
类型二:金属的腐蚀与防护
例2.以下现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的锅锣不易产生铜绿
B.生铁比软铁芯(几乎是纯铁)容易生锈
C.铁质器件附有铜质配件,在接触处易生铁锈
D.银质奖牌久置后表面变暗
【思路点拨】电化学腐蚀发生的前提是:必须满足组成原电池的条件。
【答案】D
【解析】A项中黄铜(铜锌合金)可以构成原电池,被腐蚀的金属应是金属性较强的锌而不是铜,所以不会产生铜绿。B项中生铁中含有碳,可以构成原电池从而使铁腐蚀生锈。C项中铁与铜接触构成原电池,铁比铜活泼,铁就被腐蚀生成铁锈。D项中银质奖牌是由较纯的银制作的,不构成原电池,久置后变暗是跟空气中的物质发生氧化还原反应造成的
【总结升华】金属的腐蚀分为化学腐蚀和电化学腐蚀,两者的本质区别是有无电流产生,这两种腐蚀往往同时发生,只是电化学腐蚀比化学腐蚀要普遍得多;而电化学腐蚀中吸氧腐蚀发生的要多一些。
举一反三:
【变式1】有关钢铁腐蚀的说法正确的是( )
A.无论是析氢腐蚀还是吸氧腐蚀,都是铁被腐蚀
B.吸氧腐蚀时,负极放出氧气
C.析氢腐蚀时,正极放出氢气
D.化学腐蚀超过电化学腐蚀速度
【答案】AC
【变式2】钢铁闸门易被腐蚀,发生的原电池反应为:2Fe+2H2O+O2==2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为:Fe-3e-==Fe3+
B.正极发生的反应为:2H2O+O2+2e-==4OH-
C.可将闸门与锌块相连接以保护闸门不被腐蚀
D.钢柱在水下部分比在空气与水交界处更容易被腐蚀
【答案】C
【解析】负极中铁失电子只能生成Fe2+;而不会生成Fe3+,A错;正极反应式为O2+2H2O+4e-==4OH-,B错;将铁闸门与锌连接后,锌为负极,首先被腐蚀,C对;钢柱在水下部分接触到的氧气少,不如在空气与水的交界处更容易被腐蚀,D错。
【变式3】钢铁的锈蚀过程中,下列五种变化可能发生的是( )
①Fe由+2价转化为+3价 ②O2被还原 ③H+被还原 ④有Fe2O3·H2O生成 ⑤杂质碳被氧化除去
A.①② B.③④ C.①②③④ D.①②③④⑤
【答案】C
【解析】钢铁在发生电化学腐蚀时,依据介质的不同可以发生两类原电池反应,(1)当钢铁表面的电解质溶液酸性较强时,发生析氢腐蚀,电极反应为:正极:2H++2e-==H2↑,负极:Fe-2e-==Fe2+;(2)当钢铁表面的电解质溶液酸性很弱或呈中性时,钢铁发生吸氧腐蚀,电极反应为:正极:O2+2H2O+4e-==4OH-,负极:2Fe-4e-==2Fe2+。同时在电解质溶液中还发生了如下一系列反应:Fe2++2OH-==Fe(OH)2↓,4Fe(OH)2+2H2O+O2==4Fe(OH)3,2Fe(OH)3==Fe2O3·H2O+2H2O。
类型三:无机非金属材料
例3.有关材料的用途不正确的是( )
A.高温结构陶瓷可以制作耐酸设备 B.氧化铝陶瓷不可以用于制作耐高温设备
C.氮化硅陶瓷可以制造轴承 D.光导纤维可用于传能传像、照明等
【思路点拨】高温结构陶瓷、氧化铝陶瓷、氮化硅陶瓷、光导纤维等新型无机非金属材料具有很多优点,如耐高温、高硬度、不怕氧化等。
【答案】B
【解析】高温结构陶瓷、氧化铝陶瓷、氮化硅陶瓷都是新型结构陶瓷,具有耐高温、耐酸碱、高硬度、不怕氧化等特点,AC正确,B错;光导纤维传导光的能力强,可用于通信、 传能传像、照明等。
【总结升华】制造玻璃、陶瓷、水泥等产品的工业都属硅酸盐工业,硅酸盐材料是传统无机非金属材料。硅酸盐制品性质稳定,熔点较高,大都难溶于水;缺点为质地较脆,经不起热冲击。注意记忆水泥、玻璃和陶瓷的主要化学成分、生产原料及生产原理。而新型无机非金属材料克服了传统无机非金属材料的弱点,本身还具有很多优点,如耐高温、高硬度、不怕氧化等,如新型陶瓷——高温结构陶瓷。
举一反三:
【变式1】与普通玻璃成分相同的是( )
A.有色玻璃 B.钢化玻璃 C.光学玻璃 D.石英玻璃
【答案】B
【解析】有色玻璃的成分是在原料中加入了一些金属氧化物(如氧化钴等),使玻璃有色;钢化玻璃是普通玻璃经加热、急速冷却得到的,所以成分与普通玻璃相同,但机械性能与普通玻璃不同;光学玻璃是指硼酸盐玻璃等;石英玻璃是指由较纯净的石英制得的玻璃。故本题选B。
【变式2】下列说法正确的是( )
A.氮化硅、氧化铝均为高温结构材料
B.汽油、乙烯均为石油分馏产品
C.明矾、漂白粉均为自来水消毒剂
D.光导纤维、涤纶均为合成高分子材料
【答案】A
【变式3】氮化硅是一种高温陶瓷材料,它的硬度大、熔点高、化学性质稳定,工业上曾普遍采用高纯硅与纯氮在1300℃反应获得。
①根据性质,推测氮化硅陶瓷的用途是____________(填序号)
A、制汽轮机叶片 B、制有色玻璃 C、制永久性模具 D、制造柴油机
②写出N的原子结构示意图:__________,根据元素周期律知识,请写出氮化硅的化学式:_________。
③氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应。试推测该陶瓷被氢氟酸腐蚀的化学方程式:____________。
④现用四氯化硅和氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为____________。
【答案】
①A、C、D
② ;Si3N4
③Si3N4+12HF=3SiF4+4NH3
④3SiCl4+2N2+6H2 Si3N4+12HCl
相关文档
- 2020届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-098页
- 2020届高考化学一轮复习化学与材料2021-07-0910页
- 2021届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应与2021-07-0929页
- 2020届高考化学一轮复习化学反应速2021-07-0918页