- 364.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
全国卷热考微专题(21)有机物制备型实验探究题
分析制备流程
熟悉重要仪器
依据有机反应特点作答
①有机物易挥发,反应中通常采用冷凝回流装置,以提高原料的利用率和产物的产率。
②有机反应通常都是可逆反应,且易发生副反应,因此常使价格较低的反应物过量,以提高另一反应物的转化率和产物的产率,同时在实验中需要控制反应条件,以减少副反应的发生。
③根据产品与杂质的性质特点,选择合适的分离提纯方法,如蒸馏、分液等。
乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室制备乙酸异戊酯的反应、装置示意图和有关数据如下:
项目
相对分
子质量
密度/(g·cm3)
沸点/℃
水中溶解性
异戊醇
88
0.812 3
131
微溶
乙酸
60
1.049 2
118
溶
乙酸异戊酯
130
0.867 0
142
难溶
实验步骤:
在A中加入4.4 g异戊醇、6.0 g乙酸、数滴浓硫酸和2~3片碎瓷片。开始缓慢加热A,回流50 min。反应液冷至室温后倒入分液漏斗中,分别用少量水、饱和碳酸氢钠溶液和水洗涤;分出的产物加入少量无水MgSO4固体,静置片刻,过滤除去MgSO4固体,进行蒸馏纯化,收集140~143 ℃馏分,得乙酸异戊酯3.9 g。
回答下列问题:
(1)仪器B的名称是________________。
(2)在洗涤操作中,第一次水洗的主要目的是____________________,第二次水洗的主要目的是_______________
______________________________________________________。
(3)在洗涤、分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
a.直接将乙酸异戊酯从分液漏斗的上口倒出
b.直接将乙酸异戊酯从分液漏斗的下口放出
c.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
d.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
(4)本实验中加入过量乙酸的目的是_______________________
_____________________________________________________。
(5)实验中加入少量无水MgSO4的目的是__________________。
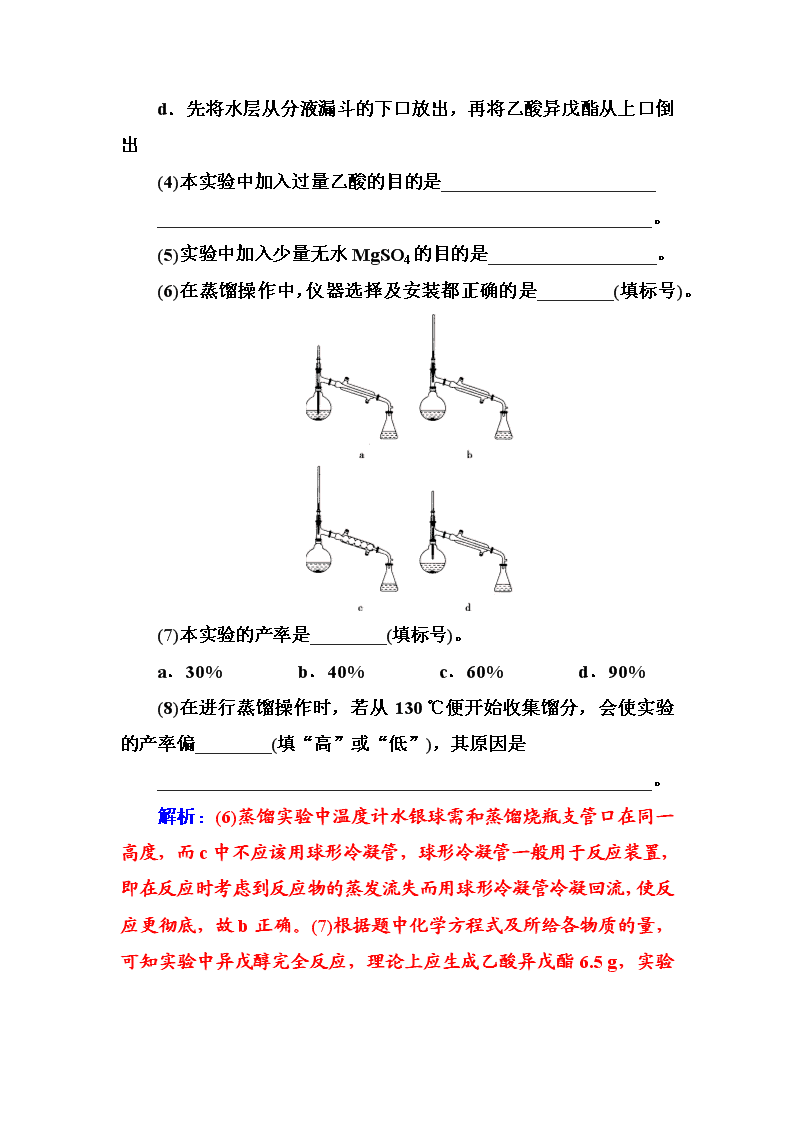
(6)在蒸馏操作中,仪器选择及安装都正确的是________(填标号)。
(7)本实验的产率是________(填标号)。
a.30% b.40% c.60% d.90%
(8)在进行蒸馏操作时,若从130 ℃便开始收集馏分,会使实验的产率偏________(填“高”或“低”),其原因是
_____________________________________________________。
解析:(6)蒸馏实验中温度计水银球需和蒸馏烧瓶支管口在同一高度,而c中不应该用球形冷凝管,球形冷凝管一般用于反应装置,即在反应时考虑到反应物的蒸发流失而用球形冷凝管冷凝回流,使反应更彻底,故b正确。(7)根据题中化学方程式及所给各物质的量,可知实验中异戊醇完全反应,理论上应生成乙酸异戊酯6.5 g,
实验中实际生成乙酸异戊酯3.9 g,故乙酸异戊酯的产率为×100%=60%。(8)若从130 ℃便开始收集馏分,则收集得到的是乙酸异戊酯和少量未反应的异戊醇的混合物,导致所测出的实验产率偏高。
答案:(1)球形冷凝管
(2)洗掉大部分硫酸和乙酸 洗掉碳酸氢钠溶液
(3)d (4)提高异戊醇的转化率 (5)干燥 (6)b (7)c
(8)高 收集少量未反应的异戊醇
1.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
;
可能用到的有关数据如下:
项目
相对分
子质量
密度/(g·cm-3)
沸点/℃
溶解性
环己醇
100
0.961 8
161
微溶于水
环己烯
82
0.810 2
83
难溶于水
【合成反应】
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
【分离提纯】
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________________。
(2)加入碎瓷片的作用是________________________________;
如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填字母,下同)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_______________
_____________________________________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________。
A.圆底烧瓶 B.温度计
C.吸滤瓶 D.球形冷凝管
E.接收器
(7)本实验所得到的环己烯产率是________。
A.41% B.50%
C.61% D.70%
解析:(1)装置b为直形冷凝管,可用于冷凝回流。(2)加入碎瓷片的作用是防止有机物在加热时发生暴沸。如果在加热时发现忘记加碎瓷片,这时必须停止加热,待冷却后补加碎瓷片。(3)醇分子间最容易发生脱水反应生成醚类化合物。(4)分液漏斗在使用前必须要检漏。实验生成环己烯的密度比水的要小,所以环己烯应从上口倒出。(5)加入无水氯化钙的目的:除去水(作干燥剂)和除去环己醇(因为乙醇可以和氯化钙反应,类比推知,环己醇和氯化钙也可以反应)。(6)观察题中实验装置图知蒸馏过程中不可能用到吸滤瓶及球形冷凝管。(7)加入20 g环己醇的物质的量为=0.2 mol,理论上生成环己烯的物质的量为0.2 mol,环己烯的质量为0.2 mol×82 g·mol-1=16.4 g,实际得到环己烯的质量为10 g,则产率为×100%≈61%。
答案:(1)直形冷凝管 (2)防止暴沸 B
(3)
(4)检漏 上口倒出 (5)干燥(或除水除醇)
(6)CD (7)C
2.实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的物理性质见附表)。
项目
相对分子质量
密度/
(g·cm-3)
沸点/℃
溴
160
3.119
58.8
苯甲醛
106
1.04
179
1,2二氯乙烷
99
1.235 1
83.5
间溴苯甲醛
185
1.587
229
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2二氯乙烷和苯甲醛(5.3 g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤。
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7 g。
(1)实验装置中采用的加热方式为________,冷凝管的作用为________,锥形瓶中的试剂应为________。
(2)步骤1所加入的无水AlCl3的作用为________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的________________(填化学式)。
(4)步骤3中加入的无水硫酸钙固体的目的是__________。
(5)步骤4中,某种技术为__________________。
(6)本实验所得到的间溴苯甲醛产率是________。
解析:(1)由于温度低于100 ℃,因此为便于控制温度,应该采用水浴加热;因溴易挥发,为使溴充分反应,应进行冷凝回流,
以增大产率,因此冷凝管的作用为导气、冷凝回流等;反应发生取代反应,生成间溴苯甲醛的同时生成HBr,用氢氧化钠溶液吸收,防止污染空气;
(2)将三颈瓶中的一定配比的无水AlCl3、1,2二氯乙烷和苯甲醛充分混合,三种物质中无水AlCl3为催化剂,1,2二氯乙烷为溶剂,苯甲醛为反应物;
(3)反应混合物含有溴,将其缓慢加入一定量的稀盐酸中,加入碳酸氢钠可与Br2、HCl反应,因此是为了除去溶于有机相的Br2、HCl(盐酸);
(4)经洗涤的有机物含有水,加入适量无水硫酸钙固体,可起到除去有机物中水的作用;
(5)减压蒸馏,可降低沸点,避免温度过高,导致间溴苯甲醛被氧化,因此该技术是减压蒸馏;
(6)5.3 g苯甲醛理论上可生成产品的质量是×185 g=9.25 g,所以产率是×100%=40.0%。
答案:(1)水浴加热 导气 冷凝回流 NaOH溶液
(2)催化剂 (3)Br2、HCl(盐酸)
(4)除去有机物的水(或干燥或除水都给分)
(5)减压蒸馏 (6)40.0%
3.苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:+3H2 +2H2O。其部分装置及有关数据如下:
项目
沸点/℃
密度(g/mL)
溶解性
硝基苯
210.9
1.20
不溶于水,易溶于乙醇、乙醚
苯胺
184.4
1.02
微溶于水,易溶于乙醇、乙醚
乙醚
34.6
0.71
不溶于水,易溶于硝基苯、苯胺
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186 ℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在_______________________
_____________________________________________________。
(2)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_______________________________________________________
_____________________________________________________。
(4)蒸馏前,步骤⑤中加入生石灰的作用是_________________
_____________________________________________________。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:
苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是______________________________________________________
_____________________________________________________;
在分液漏斗中进行萃取分液时,应注意不时放气,其目的是
_____________________________________________________。
解析:(1)步骤⑥中收集182~186 ℃馏分,得到较纯苯胺,反应时温度计需测量苯胺蒸气的温度,所以温度计的水银球应该放在三颈瓶出气口(等高线)附近;
(2)冷凝管水流遵循逆流原理,即冷水从冷凝管下口进入,上口流出,这样冷凝效果好,该实验冷凝管的冷水应该从a进从b出,A
错误;用硝基苯与H2制备苯胺,反应温度为:140 ℃,实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度,B正确;装置A为制取氢气的简易装置,使用锌粉,虽有利于加快生成H2的速率,但固液无法分离,无法控制反应速率,C错误;沸石的多孔结构,液体变气体会逐步释放,防止突然迸发,所以沸石能防沸,D正确。
(3)若实验中步骤③和④的顺序颠倒,则实验装置中的空气无法排除,加热时氢气遇氧气发生爆炸,苯胺为无色液体,还原性强,易被氧化,生成的苯胺被氧气氧化;
(4)生石灰为氧化钙能和水反应生成氢氧化钙;苯胺为无色液体,有碱性,与生石灰不反应,所以蒸馏前加入生石灰, 能除去反应中生成的水;
(5)苯胺在酸性条件下生成盐酸苯胺被水萃取,去除了一部分不溶于酸的杂质,在碱性溶液中又被有机溶剂反萃取,又去除了一部分不溶于碱的杂质,实验中反萃能除去苯胺中较多的杂质,有利于蒸馏,在分液漏斗中进行萃取分液时,不时放气,降低漏斗内的压力,使漏斗内外压强一致,易于分液漏斗中液体流出。
答案:(1)三颈烧瓶出气口(等高线)附近(其他合理答案参照给分)
(2)AC
(3)加热时氢气遇氧气发生爆炸;生成的苯胺被氧气氧化
(4)除去反应中生成的水
(5)除去苯胺中较多的杂质,有利于蒸馏提纯(其他合理答案参照给分)
降低漏斗内的压力,使漏斗内外压强一致(其他合理答案参照给分)
4.实验室制备硝基苯的反应原理和实验装置如下:
ΔH<0
反应中存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。有关数据如下表:
物质
熔点/℃
沸点/℃
密度/(g·cm-3)
溶解性
苯
5.5
80
0.88
微溶于水
硝基苯
5.7
210.9
1.205
难溶于水
间二硝基苯
89
301
1.57
微溶于水
浓硝酸
83
1.4
易溶于水
浓硫酸
338
1.84
易溶于水
实验步骤如下:①取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混和酸,将混合酸小心加入B中;②把18 mL(15.84 g)苯加入A中;③向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60 ℃下发生反应,直至反应结束;④将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液;⑤分出的产物加入无水CaCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18 g。回答下列问题:
(1)图中装置C的作用是_______________________。
(2)配制混合酸时,能否将浓硝酸加入到浓硫酸中,说明理由:
_______________________________________________________
______________________________________________________。
(3)为了使反应在50℃~60℃下进行,常用的方法是________________________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是________________________。
(4)在洗涤操作中,第二次水洗的作用是____________________
_____________________________________________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_________________________
______________________________________________________。
(6)本实验所得到的硝基苯产率是________________________
_____________________________________________________。
解析:(1)由仪器的结构特征分析,装置C为冷凝管,其作用为冷凝回流。
(2)浓硝酸与浓硫酸混合会放出大量的热,若将浓硝酸加入到浓硫酸中,硝酸的密度小于浓硫酸,可能会导致液体迸溅。
(3)因为反应在50 ℃~60 ℃下进行,低于水的沸点,可以利用水浴加热,反应后硝基苯中溶有浓硝酸分解产生的NO2(或硝酸)等杂质,使硝基苯显示黄色。
(4)先用水洗除去浓硫酸和硝酸,再用氢氧化钠除去溶解的少量的酸,最后水洗除去未反应的氢氧化钠以及生成的盐。
(5)硝基苯沸点高,用空气冷凝与水冷凝相比效果几乎无差异,且冷凝管通水冷却时导致温度差过大可能发生炸裂,所以选用空气冷凝。
(6)苯完全反应生成硝基苯的理论产量为15.84×,所以硝基苯的产率为18÷(15.84×)×100%=72.06%。
答案:(1) 冷凝回流
(2)不能;易暴沸飞溅
(3)水浴加热 溶有浓硝酸分解产生的NO2(或硝酸)等杂质
(4)洗去残留的NaOH及生成的钠盐
(5)硝基苯沸点高,用空气冷凝与水冷凝相比效果几乎无差异(从简约装置、节约开支回答或水冷却温差大可能造成冷凝管炸裂等合理答案均计分)
(6) 72.06%(72%至72.1%及之间的任何值均计分)
相关文档
- 2020届高考化学一轮复习化学反应与2021-07-0911页
- 2021届高考化学一轮复习化学反应速2021-07-099页
- 2020届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-098页
- 2020届高考化学一轮复习化学与材料2021-07-0910页
- 2021届高考化学一轮复习化学反应速2021-07-0913页