- 843.43 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
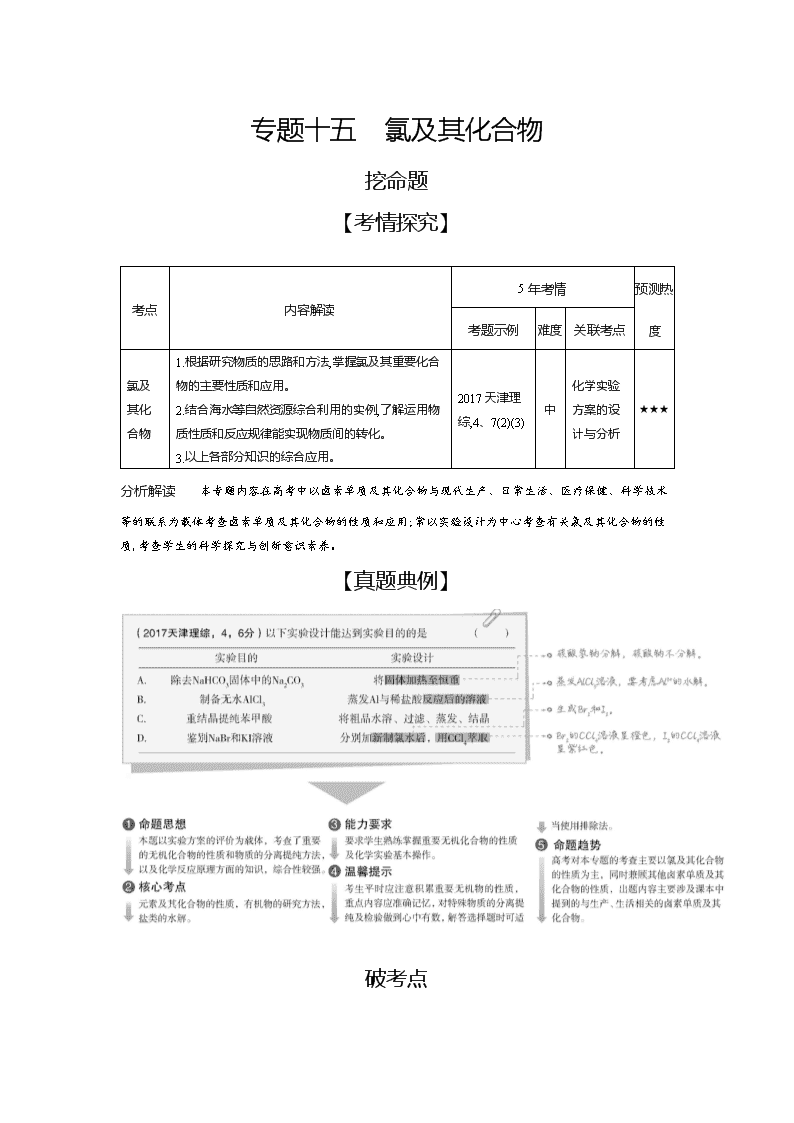
专题十五 氯及其化合物
挖命题
【考情探究】
考点
内容解读
5年考情
预测热度
考题示例
难度
关联考点
氯及其化合物
1.根据研究物质的思路和方法,掌握氯及其重要化合物的主要性质和应用。
2.结合海水等自然资源综合利用的实例,了解运用物质性质和反应规律能实现物质间的转化。
3.以上各部分知识的综合应用。
2017天津理综,4、7(2)(3)
中
化学实验方案的设计与分析
★★★
分析解读 本专题内容在高考中以卤素单质及其化合物与现代生产、日常生活、医疗保健、科学技术等的联系为载体考查卤素单质及其化合物的性质和应用;常以实验设计为中心考查有关氯及其化合物的性质,考查学生的科学探究与创新意识素养。
【真题典例】
破考点
【考点集训】
考点 氯及其化合物
1.氯水中存在多种分子和离子,可通过实验的方法加以确定。下列有关氯水中存在的粒子的说法中错误的是( )
选项
实验操作及现象
结论
A
加入含有NaHSO3的石蕊试液,红色褪去
说明有Cl2分子存在
B
加入有色布条,有色布条褪色
说明有HClO分子存在
C
氯水呈浅黄绿色,且有刺激性气味
说明有Cl2分子存在
D
加硝酸酸化的AgNO3溶液,产生白色沉淀
说明有Cl-存在
答案 A
2.某同学在一pH试纸上滴几滴新制的氯水,现象如图所示,下列有关该实验的说法中正确的是( )
A.该实验说明Cl2分子具有漂白性
B.该实验说明H+扩散速度比HClO分子快
C.将实验后的pH试纸在酒精灯上微热,试纸又恢复为原来的颜色
D.若用久置的氯水进行实验,现象相同
答案 B
3.从海带中提取碘单质,成熟的工艺流程如下,下列关于海水制碘的说法,不正确的是( )
干海带 海带灰 悬浊液 滤液含碘水溶液I2的CCl4溶液 I2
A.实验室在蒸发皿中灼烧干海带,并且用玻璃棒搅拌
B.含I-的滤液中加入稀硫酸和双氧水后,碘元素发生氧化反应
C.在含碘水溶液中加入几滴淀粉溶液,溶液变蓝色
D.含碘水溶液中加入CCl4得到I2的CCl4溶液,该操作为“萃取、分液”
答案 A
炼技法
【方法集训】
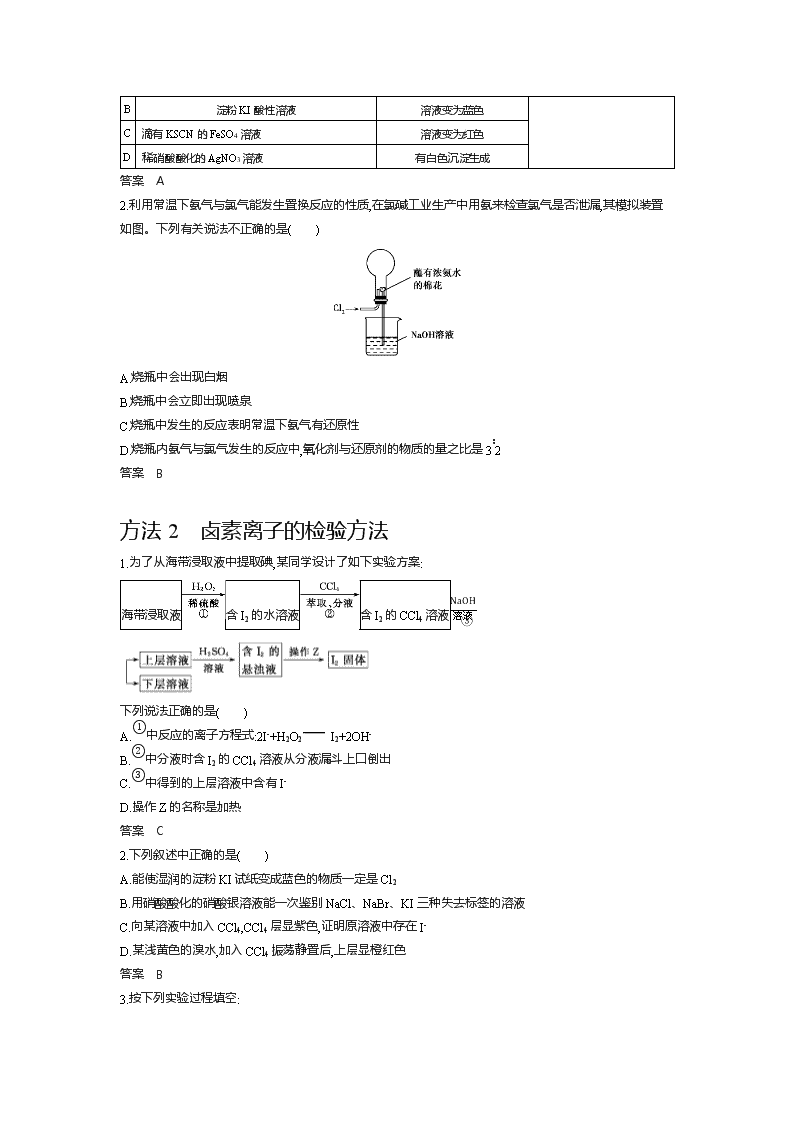
方法1 氯气的实验室制法和氯气的性质实验
1.向盛有H2O2的试管中滴入一定量浓盐酸,有刺激性气味的气体生成。经实验证明该气体中只含有O2、Cl2、HCl和水蒸气。将气体通入X溶液(如图),依据观察到的现象,能判断气体中含有Cl2的是( )
X溶液
现象
A
紫色石蕊溶液
溶液先变红后褪色
B
淀粉KI酸性溶液
溶液变为蓝色
C
滴有KSCN的FeSO4溶液
溶液变为红色
D
稀硝酸酸化的AgNO3溶液
有白色沉淀生成
答案 A
2.利用常温下氨气与氯气能发生置换反应的性质,在氯碱工业生产中用氨来检查氯气是否泄漏,其模拟装置如图。下列有关说法不正确的是( )
A.烧瓶中会出现白烟
B.烧瓶中会立即出现喷泉
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧瓶内氨气与氯气发生的反应中,氧化剂与还原剂的物质的量之比是3∶2
答案 B
方法2 卤素离子的检验方法
1.为了从海带浸取液中提取碘,某同学设计了如下实验方案:
海带浸取液含I2的水溶液含I2的CCl4溶液NaOH溶液③
下列说法正确的是( )
A.①中反应的离子方程式:2I-+H2O2 I2+2OH-
B.②中分液时含I2的CCl4溶液从分液漏斗上口倒出
C.③中得到的上层溶液中含有I-
D.操作Z的名称是加热
答案 C
2.下列叙述中正确的是( )
A.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2
B.用硝酸酸化的硝酸银溶液能一次鉴别NaCl、NaBr、KI三种失去标签的溶液
C.向某溶液中加入CCl4,CCl4层显紫色,证明原溶液中存在I-
D.某浅黄色的溴水,加入CCl4振荡静置后,上层显橙红色
答案 B
3.按下列实验过程填空:
浅绿色FeBr2溶液 黄色液体
写出上述反应的化学方程式:(1) ;
(2) ;(3) 。
答案 ①棕黄 ②蓝 ③橙红 ④蓝
(1)2FeBr2+3Cl2 2FeCl3+2Br2
(2)2FeCl3+2KI 2FeCl2+2KCl+I2
(3)2KI+Br2 2KBr+I2
过专题
【五年高考】
考点 氯及其化合物
统一命题、省(区、市)卷题组
1.(2016课标Ⅲ,7,6分)化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质
实际应用
A.
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B.
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
续表
化学性质
实际应用
C.
次氯酸盐具有氧化性
漂白粉漂白织物
D.
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
答案 B
2.(2014江苏单科,13,4分)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl-
C.向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+
D.向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO
答案 D
3.(2015课标Ⅱ,12,6分)海水开发利用的部分过程如图所示。下列说法错误··的是( )
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
答案 C
4.(2016上海单科,15,3分)下列气体的制备和性质实验中,由现象得出的结论错误的是( )
选项
试剂
试纸或试液
现象
结论
A
浓氨水、生石灰
红色石蕊试纸
变蓝
NH3为碱性气体
B
浓盐酸、浓硫酸
pH试纸
变红
HCl为酸性气体
C
浓盐酸、二氧化锰
淀粉碘化钾试液
变蓝
Cl2具有氧化性
D
亚硫酸钠、硫酸
品红试液
褪色
SO2具有还原性
答案 D
5.(2014江苏单科,5,2分)下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是( )
A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
答案 C
6.(2014浙江理综,12,6分)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。下列表述正确的是( )
A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
答案 C
7.(2015海南单科,20-Ⅰ,6分)下列有关海水综合利用的说法正确的是( )
A.电解饱和食盐水可制得金属钠
B.海带提碘只涉及物理变化
C.海水提溴涉及氧化还原反应
D.海水提镁涉及复分解反应
答案 CD
8.(2016课标Ⅰ,28,14分)NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)NaClO2中Cl的化合价为 。
(2)写出“反应”步骤中生成ClO2的化学方程式 。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为 、 。“电解”中阴极反应的主要产物是 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为 ,该反应中氧化产物是 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为 。(计算结果保留两位小数)
答案 (1)+3
(2)2NaClO3+SO2+H2SO4 2ClO2+2NaHSO4
(3)NaOH溶液 Na2CO3溶液 ClO2-(或NaClO2)
(4)2∶1 O2
(5)1.57
9.(2015重庆理综,9,15分)ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛。某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究。
(1)仪器D的名称是 。安装F中导管时,应选用图2中的 。
(2)打开B的活塞,A中发生反应:2NaClO3+4HCl 2ClO2↑+Cl2↑+2NaCl+2H2O,为使ClO2在D中被稳定剂充分吸收,滴加稀盐酸的速度宜 (填“快”或“慢”)。
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是 。
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为 。在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是 。
(5)已吸收ClO2气体的稳定剂Ⅰ和稳定剂Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示。若将其用于水果保鲜,你认为效果较好的稳定剂是 ,原因是 。
图3
答案 (15分)(1)锥形瓶 b (2)慢 (3)吸收Cl2
(4)4H++5ClO2- Cl-+4ClO2↑+2H2O 验证是否有ClO2生成 (5)稳定剂Ⅱ 稳定剂Ⅱ可以缓慢释放ClO2,能较长时间维持保鲜所需的浓度
10.(2014江苏单科,19,15分)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为 ;该操作将I2还原为I-的目的是 。
(2)操作X的名称为 。
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40 ℃左右反应(实验装置如下图所示)。
实验控制在较低温度下进行的原因是 ;锥形瓶里盛放的溶液为 。
(4)已知:5SO32-+2IO3-+2H+ I2+5SO42-+H2O
某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在; 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液。
答案 (15分)(1)SO32-+I2+H2O 2I-+SO42-+2H+
使CCl4中的碘进入水层
(2)分液
(3)使氯气在溶液中有较大的溶解度(或防止I2升华或防止I2进一步被氧化) NaOH溶液
(4)从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加FeCl3溶液,若溶液变蓝,说明废水中含有I-;若溶液不变蓝,说明废水中不含有I-。另从水层取少量溶液,加入1~2 mL淀粉溶液,加盐酸酸化,滴加Na2SO3溶液,若溶液变蓝,说明废水中含有IO3-;若溶液不变蓝,说明废水中不含有IO3-
教师专用题组
11.(2015北京理综,27,14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%。写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋碳循环中,通过如图所示的途径固碳。
①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O。用18O标记物质的光合作用的化学方程式如下,将其补充完整:
+ (CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础。测量溶解无机碳,可采用如下方法:
①气提、吸收CO2。用N2从酸化后的海水中吹出CO2并用碱液吸收(装置示意图如下)。将虚线框中的装置补充完整并标出所用试剂。
②滴定。将吸收液吸收的无机碳转化为NaHCO3,再用x mol·L-1 HCl溶液滴定,消耗y mL HCl溶液。海水中溶解无机碳的浓度= mol·L-1。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。
①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是
。
答案 (14分)(1)CO2+H2O H2CO3、H2CO3 H++HCO3-
(2)①2HCO3-+Ca2+ CaCO3↓+CO2↑+H2O
②xCO2 2xH218O
(3)①
②x·yz
(4)①a室:2H2O-4e- 4H++O2↑,H+通过阳离子膜进入b室,发生反应:H++HCO3- CO2↑+H2O
②c室的反应:2H2O+2e- 2OH-+H2↑,用c室排出的碱液将从b室排出的酸性海水调至接近装置入口海水的pH
【三年模拟】
一、选择题(每题6分,共54分)
1.(2018天津南开中学高三第五次月考,5)下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量的CO2制取Al(OH)3:AlO2-+CO2+2H2O Al(OH)3↓+HCO3-
D.在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3 2FeO42-+3Cl-+H2O+4H+
答案 C
2.(2017天津河北区一模,3)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq) I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法不正确的是( )
A.温度为T1时,向该平衡体系中加入KI固体,平衡正向移动
B.反应I2(aq)+I-(aq) I3-(aq) ΔH<0
C.T1时,反应进行到状态d,一定有v正>v逆
D.状态a与状态b相比,状态b时I2的转化率更高
答案 D
3.(2019届天津实验中学第二次月考,4)已知H2SO3+Br2+H2O H2SO4+2HBr,将0.1 mol Cl2通入100 mL含等物质的量HBr与H2SO3的混合溶液中,有一半的HBr被氧化,则下列说法正确的是( )
A.物质的还原性:HBr>H2SO3>HCl
B.HBr与H2SO3的物质的量浓度均为0.6 mol·L-1
C.通入0.1 mol Cl2发生反应的离子方程式为5Cl2+4H2SO3+2Br-+4H2O 4SO42-+Br2+10Cl-+16H+
D.若再通入0.05 mol Cl2,恰好能将HBr和H2SO3完全氧化
答案 C
4.(2018天津和平二模,2)下列有关物质应用的说法正确的是( )
A.碳酸钠溶液呈碱性,可用热的纯碱溶液除去金属表面的煤油
B.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
C.向饱和硼酸溶液中滴加Na2CO3溶液,有CO2气体生成
D.铝表面易形成致密的氧化膜,铝制器皿可长时间盛放咸菜等腌制食品
答案 B
5.(2018天津红桥一模,4)下列根据实验现象所得到的结论正确的是( )
选项
实验操作
现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X
产生白色沉淀
X一定是Cl2
B
向NaClO和NaOH的混合溶液中加入H2O2浓溶液
产生大量气泡
碱性条件下,H2O2被ClO-氧化成O2
C
等体积pH=3的HA和HB两种酸溶液分别与足量的锌反应
HA放出的H2多
酸性:HA>HB
D
将铜片和铁片用导线连接插入浓硝酸中
铁片表面有气泡产生
金属活动性:Cu>Fe
答案 B
6.(2018天津南开中学6月模拟,2)实验室制备下列气体时,所用方法及相关说法正确的是( )
A.制氨气时,可直接加热氯化铵固体
B.制氯气时,可用二氧化锰与浓盐酸加热制得
C.制乙炔时,可用电石和饱和食盐水反应,所得气体能使酸性高锰酸钾溶液的紫红色褪去,证明乙炔具有还原性
D.制二氧化硫时,可用硫代硫酸钠和稀硝酸反应
答案 B
7.(2018天津高三下模拟,7)已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2。下列有关离子反应或离子方程式的叙述中,正确的是( )
A.向溴水中加入足量氯化亚铁溶液,溴水褪色
B.能使pH试纸显蓝色的溶液中,Fe3+、Cl-、Ba2+、Br-能大量共存
C.向NaClO溶液中通入少量二氧化碳,反应的离子方程式为2ClO-+CO2+H2O 2HClO+CO32-
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为2Fe2++Cl2 2Fe3++2Cl-
答案 A
8.(2018天津高三下模拟,8)下列有关实验装置,能达到实验目的的是( )
A.用图1所示装置制取少量Cl2
B.用图2所示装置制取干燥的NH3
C.用图3制备并检验H2的可燃性
D.用图4装置鉴别碳酸钠和碳酸氢钠
答案 D
9.(2018天津部分区县高三期末,2)下列物质的性质与应用对应关系正确的是 ( )
物质的性质
应用
A
次氯酸有酸性
可用于漂白、杀菌消毒
B
纯碱能与酸反应
可用作治疗胃酸过多的药物
C
液氨汽化时要吸收大量的热
工业上可用作制冷剂
D
晶体硅的熔点高、硬度大
可用于制作半导体材料
答案 C
二、非选择题(共16分)
10.(2018天津一中高三5月月考,9)(16分)POCl3常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.实验室制备POCl3。采用氧气氧化液态PCl3法制取POCl3,实验装置(加热及夹持仪器略)如图。
资料:①Ag++SCN- AgSCN↓,Ksp(AgCl)>Ksp(AgSCN);
②PCl3和POCl3的相关信息如下表。
物质
熔点/℃
沸点/℃
相对分子质量
其他
PCl3
-112.0
76.0
137.5
两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢
POCl3
2.0
106.0
153.5
(1)装置B的作用是观察氧气的流速和 、 ,干燥管的作用是 。
(2)反应温度要控制在60~65 ℃,原因是 。
Ⅱ.测定POCl3产品的含量。
实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7 g产品(杂质不含氯元素),置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL 3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN 溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN 溶液。
(3)实验室用5.0 mol/L AgNO3溶液配制100 mL 3.2 mol/L AgNO3标准溶液,所使用的仪器除烧杯和玻璃棒外,还有 。
(4)步骤③若不加入硝基苯将导致测量结果 (填“偏高”“偏低”或“无影响”)。
(5)步骤④中X可以选择 。
(6)反应中POCl3的质量百分含量为 ,通过 (填操作)可以提高产品的纯度。
答案 (1)干燥氧气 当压强过大时,长颈漏斗中液面上升,平衡气压 防止空气中的水蒸气进入三颈烧瓶 (2)温度过低,反应速率太慢;温度过高,PCl3易挥发,利用率低 (3)100 mL容量瓶、100 mL量筒、胶头滴管 (4)偏低
(5)Fe(NO3)3 (6)50% 蒸馏
相关文档
- 2020届高考化学一轮复习化学反应与2021-07-0911页
- 2021届高考化学一轮复习化学反应速2021-07-099页
- 2020届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-098页
- 2020届高考化学一轮复习化学与材料2021-07-0910页
- 2021届高考化学一轮复习化学反应速2021-07-0913页