- 265.97 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点29 化学反应中的热效应
知识条目
必考要求
加试要求
1.化学反应中能量转化的主要形式
a
b
2.吸热反应和放热反应
a
a
3.从化学反应中的反应物的总能量与生成物的总能量变化理解反应中的热效应
b
b
4.化学键的断裂和形成与反应中能量变化的关系
b
c
5.热化学方程式的书写
a
b
6.利用热化学方程式进行简单计算
b
c
7.反应热,焓变的含义
a
8.焓变与键能的关系
c
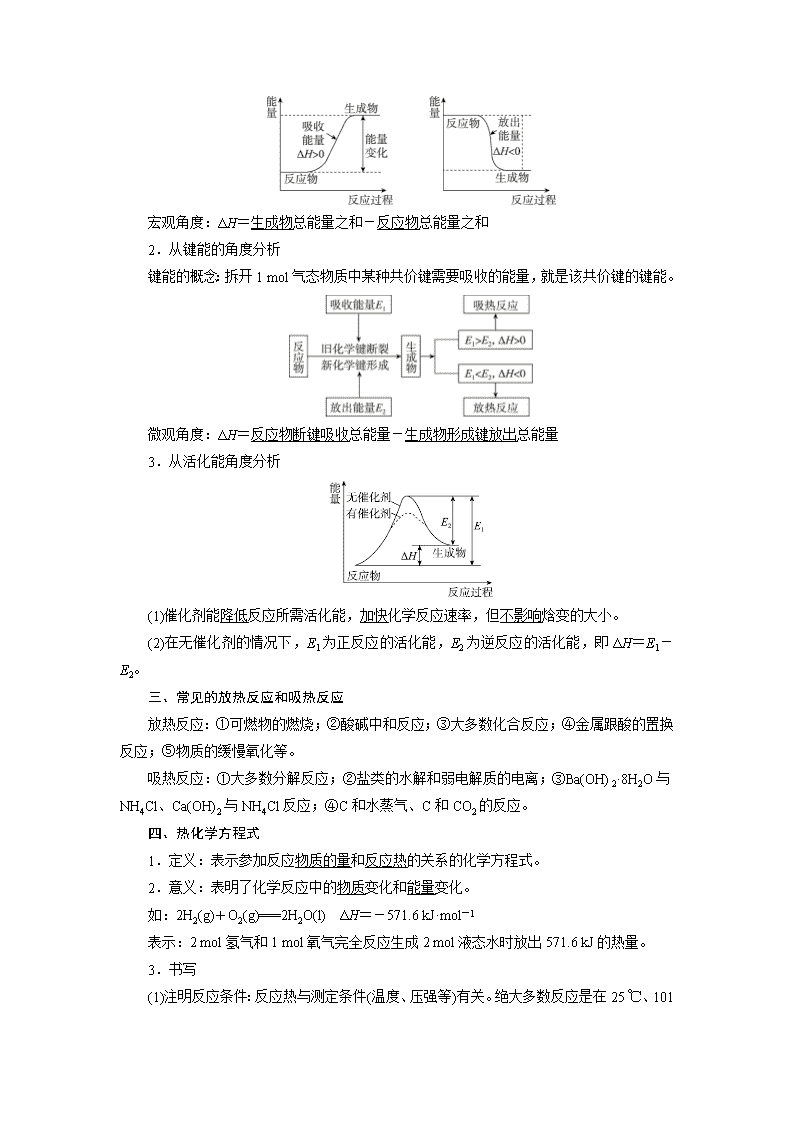
一、化学反应过程中既有物质变化,又有能量变化
化学反应中的能量变化有多种形式,释放或吸收热量是化学反应中能量变化的主要形式之一。因此化学反应分为两类:放热反应和吸热反应。化学上把有热量放出的化学反应称为放热反应,把吸收热量的化学反应称为吸热反应。
二、反应热
(一)基本概念:
①反应热:在化学反应过程中,当反应物和生成物具有相同温度时,所吸收或放出的热量称为反应的反应热。
②焓变:在恒温、恒压条件下,化学反应过程中吸收或释放的热量称为反应的焓变。
(二)从三个角度理解反应热
1.从物质具有的总能量角度分析
宏观角度:ΔH=生成物总能量之和-反应物总能量之和
2.从键能的角度分析
键能的概念:拆开1 mol气态物质中某种共价键需要吸收的能量,就是该共价键的键能。
微观角度:ΔH=反应物断键吸收总能量-生成物形成键放出总能量
3.从活化能角度分析
(1)催化剂能降低反应所需活化能,加快化学反应速率,但不影响焓变的大小。
(2)在无催化剂的情况下,E1为正反应的活化能,E2为逆反应的活化能,即ΔH=E1-E2。
三、常见的放热反应和吸热反应
放热反应:①可燃物的燃烧;②酸碱中和反应;③大多数化合反应;④金属跟酸的置换反应;⑤物质的缓慢氧化等。
吸热反应:①大多数分解反应;②盐类的水解和弱电解质的电离;③Ba(OH)2·8H2O与NH4Cl、Ca(OH)2与NH4Cl反应;④C和水蒸气、C和CO2的反应。
四、热化学方程式
1.定义:表示参加反应物质的量和反应热的关系的化学方程式。
2.意义:表明了化学反应中的物质变化和能量变化。
如:2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
表示:2 mol氢气和1 mol氧气完全反应生成2 mol液态水时放出571.6 kJ的热量。
3.书写
(1)注明反应条件:反应热与测定条件(温度、压强等)有关。绝大多数反应是在25 ℃、101
kPa下进行的,可不注明。
(2)注明物质状态:常用s、l、g、aq分别表示固体、液体、气体、溶液。
(3)注意符号单位:ΔH应包括“+”或“-”(“+”可省略)、数字和单位(kJ·mol-1)。
(4)注意守恒关系:①原子守恒和得失电子守恒;②能量守恒。(ΔH与化学计量数相对应)
(5)区别于普通方程式:一般不标注“↑”“↓”以及“点燃”“加热”等。
(6)注意热化学方程式的化学计量数
热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,可以是整数,也可以是分数。且化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。
【例1】 已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列
叙述不正确的是( )
A.该反应的ΔH值与反应物用量无关
B.该反应的化学能可以转化为电能
C.反应物的总能量高于生成物的总能量
D.该反应中反应物的化学键断裂放出能量,生成物的化学键形成吸收能量
【解析】 A.作为一个描述系统状态的状态函数,焓变没有明确的物理意义,ΔH(焓变)表示的是系统发生一个过程的焓的增量,确定了一个化学方程式,就确定了一个焓变,焓变并不随反应物的增加而增加,焓变与化学方程式的写法有关,故A正确;B.反应是氧化还原反应,可以设计成原电池,锌做负极,失电子,溶液中氢离子在正极得到电子实现化学能转化为电能,故B正确;C.该反应是放热反应,依据能量守恒,反应物总能量大于生成物总能量,故C正确;D.断裂化学键吸收能量,生成化学键会放热,故D错误。
【答案】 D
【提炼】 本题主要考查热化学方程式的意义及化学反应中能量变化的原因。
【例2】 铁系氧化物材料在光催化、电致变色、气敏传感器以及光电化学器件中有着广泛的应用和诱人的前景。实验室中可利用FeCO3和O2为原料制备少量铁红,每生成160 g固体铁红放出130 kJ热量,则下列有关该反应的热化学方程式书写正确的是( )
A.2FeCO3(s)+O2(g)===Fe2O3(s)+2CO2(g) ΔH=-130 kJ·mol-1
B.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=+260 kJ·mol-1
C.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=-260 kJ·mol-1
D.4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g) ΔH=+130 kJ·mol-1
【解析】 每生成160 g固体铁红的物质的量为1 mol,放出130 kJ热量,所以生成2 mol氧化铁放出的热量为260 kJ,所以热化方程式为4FeCO3(s)+O2(g)===2Fe2O3(s)+4CO2(g)
ΔH=-260 kJ·mol-1,故C项正确。
【答案】 C
【提炼】 本题主要考查热化学方程式的书写。热化学方程式中各物质化学式前面的化学计量数仅表示该物质的物质的量,且化学计量数必须与ΔH相对应。
【例3】 已知
①H2(g)+O2(g)===H2O(g) ΔH1=a kJ/mol
②2H2(g)+O2(g)===2H2O(g) ΔH2=b kJ/mol
③H2(g)+O2(g)===H2O(l) ΔH3=c kJ/mol
④2H2(g)+O2(g)===2H2O(l) ΔH4=d kJ/mol
下列关系式正确的是( )
A.a<c<0 B.b>d>0 C.2a=b<0 D.2c=d>0
【解析】 A.反应③与①方程式化学计量系数相同,但是③生成的是液态水,放出的热量更多,而ΔH<0,所以c<a<0,故A项错误;B.反应④与②方程式化学计量系数相同,但是④生成的是液态水,放出的热量更多,而ΔH<0,所以d<b<0,故B项错误;C.反应①与②对应反应物、生成物的状态均相同,方程式计量系数相差一倍,故ΔH也呈倍数关系,而该反应为放热反应,ΔH<0,故C项正确;D.反应③与④对应反应物、生成物的状态均相同,方程式计量系数相差一倍,故ΔH也呈倍数关系,而该反应为放热反应,ΔH<0,故D项错误。
【答案】 C
【提炼】 识记常见的吸、放热反应,如燃烧是典型的放热反应,同时应注意热化学方程式中ΔH的大小比较是包含符号的,其数值与化学计量数成正比关系。
【例4】 根据能量变化示意图,下列热化学方程式正确的是( )
A.N2(g)+3H2(g)===2NH3(g) ΔH=-(b-a)kJ·mol-1
B.N2(g)+3H2(g)===2NH3(g) ΔH=-(a-b)kJ·mol-1
C.2NH3(l)===N2(g)+3H2(g) ΔH=2(a+b-c)kJ·mol-1
D.2NH3(l)===N2(g)+3H2(g) ΔH=2(b+c-a)kJ·mol-1
【解析】 根据ΔH=反应物断键吸收总能量-生成物形成键放出总能量,由图可知1/2N2(g)+3/2H2(g)===NH3(g) ΔH=(a-b)kJ·mol-1,1/2N2(g)+3/2H2(g)===NH3(l) ΔH
=(a-b-c)kJ·mol-1。热化学方程式书写中化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。如果反应物与生成物互换,则ΔH数值不变,符号相反。因此只有D选项是正确的。
【答案】 D
【提炼】 本题考查键能与焓变的关系、热化学方程式的书写及注意点。
【例5】 化学键的键能是指气态原子间形成1 mol化学键时释放的能量。下表列出了某些化学键的键能:
化学键
H—H
Cl—Cl
H—Cl
键能(kJ·mol-1)
436
x
431
请回答下列问题:
(1)如图表示某反应的能量变化关系图,此反应为________(填“放热”或“吸热”)反应,其中ΔH=________kJ·mol-1(用含C和D的字母表示)。
(2)若此能量变化关系图表示反应H2(g)+Cl2(g)===2HCl(g) ΔH=-183kJ·mol-1,则B=________kJ·mol-1,x=________。
【解析】 (1)根据能量变化关系图,反应物的总能量比生成物的高,此反应为放热反应,焓变值=生成物总能量-反应物总能量ΔH=(C-D)kJ·mol-1;(2)B为2 mol HCl的总键能,因此B=431 kJ·mol-1×2=862 kJ·mol-1,焓变值=反应物的键能之和-生成物的键能之和,ΔH=-183 kJ·mol-1=436 kJ·mol-1+x kJ·mol-1-431 kJ·mol-1×2,x=243 kJ·mol-1。
【答案】 (1)放热 C-D (2)862 243
【提炼】 本题主要从宏观角度和微观角度理解反应热:ΔH=生成物总能量之和-反应物总能量之和;
ΔH=反应物断键吸收总能量-生成物形成键放出总能量。
相关文档
- 2019届高考化学一轮复习化学反应中2021-07-0914页
- 2021届高考化学一轮复习化学平衡状2021-07-098页
- 2020届高考化学一轮复习化学反应与2021-07-0911页
- 2021届高考化学一轮复习化学反应速2021-07-099页
- 2020届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 2020年高考化学一轮复习化学反应速2021-07-0913页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-098页