- 80.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
烃的衍生物
知识结构
1.脂肪醇、芳香醇、酚的比较
类别
脂肪醇
芳香醇
酚
实例
CH3CH2OH
C6H5-CH2OH
C6H5-OH
官能团
-OH
-OH
-OH
结构特点
-OH与链烃基相连
-OH与芳烃侧链相连
-OH与苯环直接相连
主要化性
(1)与钠反应 (2)取代反应 (3)脱水反应 (4)氧化反应(5)酯化反应
(1)弱酸性 (2)取代反应 (3)显色反应
特性
红热铜丝插入醇中有刺激性气味(生成醛或铜)
与FeCl3溶液显紫色
2.苯、甲苯、苯酚的分子结构及典型性质比较
类 别
苯
甲苯
苯酚
结构简式
氧化反应
不被KmnO4溶液氧化
可被KmnO4溶液氧化
常温下在空气中被氧化呈红色
溴
代
反
应
溴状态
液溴
液溴
溴水
条件
催化剂
催化剂
无催化剂
产物
C6H5-Br
邻、间、对三种溴苯
三溴苯酚
结论
苯酚与溴的取代反应比苯、甲苯易进行
原因
酚羟基对苯环的影响使苯环上的氢原子变得活泼、易被取代
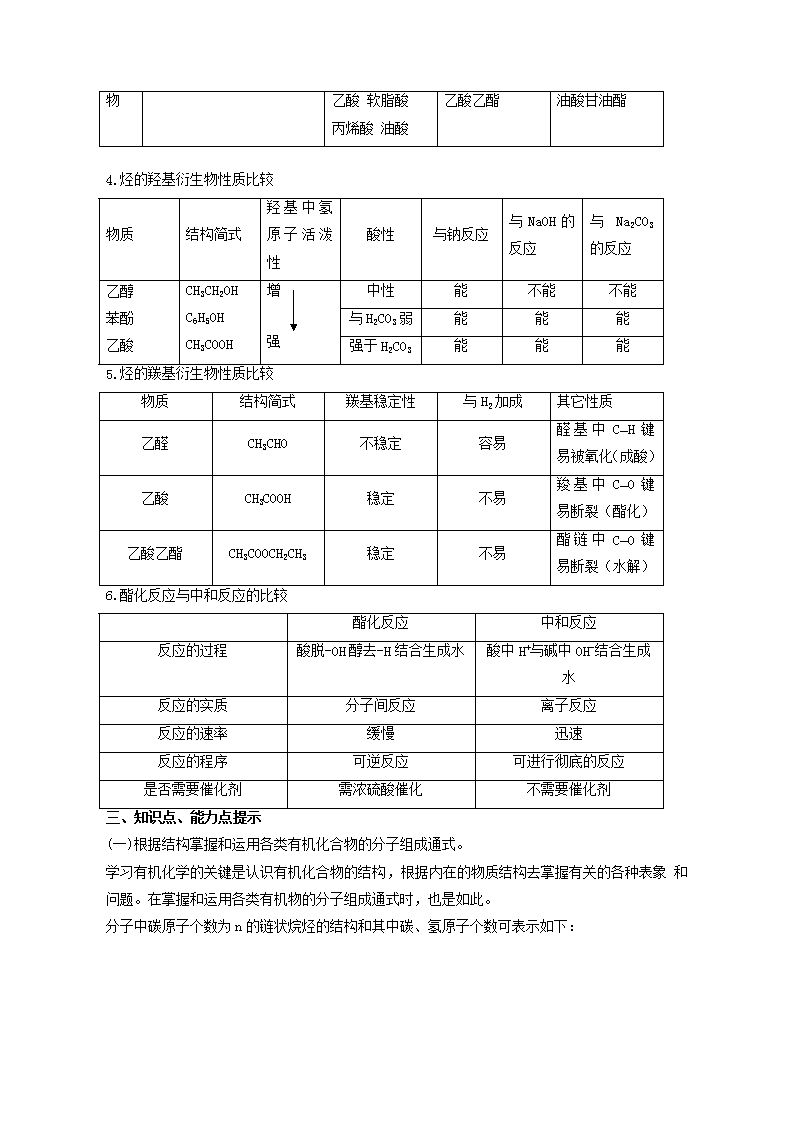
3.醛、羰酸、酯(油脂)的综合比较
通
式
醛
R—CHO
羰酸
R—COOH
酯
R COOR′
油脂
化学
性质
①加氢
②银镜反应
③催化氧化成酸
①酸性
②酯化反应
③脱羰反应
酸性条件
水解
碱性条件
水解
氢化(硬化、还原)
甲醛、乙醛
甲酸 硬脂酸
硝酸乙酯
硬脂酸甘油酯
代表物
乙酸 软脂酸
丙烯酸 油酸
乙酸乙酯
油酸甘油酯
4.烃的羟基衍生物性质比较
物质
结构简式
羟基中氢原子活泼性
酸性
与钠反应
与NaOH的反应
与Na2CO3的反应
乙醇
苯酚
乙酸
CH3CH2OH
C6H5OH
CH3COOH
增
强
中性
能
不能
不能
与H2CO3弱
能
能
能
强于H2CO3
能
能
能
5.烃的羰基衍生物性质比较
物质
结构简式
羰基稳定性
与H2加成
其它性质
乙醛
CH3CHO
不稳定
容易
醛基中C—H键易被氧化(成酸)
乙酸
CH3COOH
稳定
不易
羧基中C—O键易断裂(酯化)
乙酸乙酯
CH3COOCH2CH3
稳定
不易
酯链中C—O键易断裂(水解)
6.酯化反应与中和反应的比较
酯化反应
中和反应
反应的过程
酸脱-OH醇去-H结合生成水
酸中H+与碱中OH-结合生成水
反应的实质
分子间反应
离子反应
反应的速率
缓慢
迅速
反应的程序
可逆反应
可进行彻底的反应
是否需要催化剂
需浓硫酸催化
不需要催化剂
三、知识点、能力点提示
(一)根据结构掌握和运用各类有机化合物的分子组成通式。
学习有机化学的关键是认识有机化合物的结构,根据内在的物质结构去掌握有关的各种表象 和问题。在掌握和运用各类有机物的分子组成通式时,也是如此。
分子中碳原子个数为n的链状烷烃的结构和其中碳、氢原子个数可表示如下:
由此确定烷烃的分子组成通式为CnH2n+2。而且当分子中碳原子个数为n个,其中氢原子个数的最大数为2n+2,是氢原子个数上限值。除了链状烷烃之外的各类有机物分子组成通式中,氢原子的个数都不大于此数值。若给出的有机物分子中,氢原子和碳原子的个数比大于
时,此分子组成肯定不正确。
以链状烷烃分子结构和分子组成通式(CnH2n+2)为基础进行分析和比较:在结构中 , 若增加一个双键,就要少2个氢原子;若增加一个CC叁键,要少4个氢原子,在结构中出现一个环状结构,也要少2个氢原子 。所以,烯烃和环烷烃的分子组成通式为CnH2n,炔烃和二烯烃的分子组成通式为CnH2n-2。苯和苯的同系物结构中有苯环结构,苯的结构用凯库勒式表示为,可看成是具有3个C C双键和1个环 状结构,分子中碳原子个数为n时,氢原子个数应是在2n+1的基础上减去2×4,得到苯和苯 的同系物分子组成通式为CnH2n-6(n≥6),其他各类烃的分子组成通式,也可用同 样的方法进行确定。
烃的衍生物中,卤代烃是饱和链烃基和卤素相结合,根据卤代烃的结构,分子组成通式为
CnH2n+2-mxm,若其中的烃基不是烷烃基时,氢原子个数在此基础上, 按前面所述根据不饱和键和环状结构的数量而减少,烃的含氧衍生物中,分子中碳原子个数 为n个,每出现1个C O时,也同样减少2个氢原子,单纯氧原子的 个数多少,并不影响氢原子的个数,比如,1个碳原子与氢原子相连,或是与1个羟基相连, 氢原子个数都是1。因此,在醇的分子组成通式中,饱和一元醇和醚是CnH2n+2O多 元醇就是CnH2n+2Om,苯酚及其同系物、芳香醇是CnH2n-6O,醛酮的分子结构中存在C O键,分子组成通式为CnH2nO,羰酸或酯就是CnH2nO2。若醛、酮、羰酸和酯的分子结构中烃基也出现碳碳不饱和键和环状结构时,仍要在原烃的衍生物分子组成通式中,相应减少一定个数的氢原子。如某醛分子式为C3H6O,符合通式CnH2nO,可确定为丙醛,分子组成为C3H4O,与C3H6O相比较少2个氢原子,可知C3H4O为丙烯醛,若将结构中的C O键换成C C双键时,分子式为C3H6O的有机物还可 以是丙烯醇,从而可进一步确定:具有相同碳原子个数的醛、酮和烯醇互为同分异构体。
从上面的叙述和分析过程中,认识到:“分子结构是学好有机化学的关键”,对于“各类有 机物的分子组成通式的掌握不应靠单纯的记忆,也不宜完全依赖数学中的单一数字推导,如 苯的同系物看成由苯基和烷基结合而成,苯基为C6H5;烷基设为CmH2m+1,两 者结合后化学式为Cm+6H2m+6,即Cm+6H2(m+6)-6,设m+6=n时, 才最终得到苯和苯的同系物分子组成通式为CnH2n-6,这一推导过程明显过于呆滞 ,不利于对各类有机物分子组成通式的掌握,也不便于应用。
(二)通过分析、比较、综合、归纳掌握同分异构现象及其有关的知识内容。
在有机物中,经常出现由于分子中各原子的可能排列顺序和方式的变化,形成分子式虽然相同,但结构不同的化合物,而出现同分异构现象,这些具有同分异构现象的化合物互称为同分异构体。这就是有机物种类繁多的原因所在。同分异构体的概念中,有两个突出的要点:一是同分异构体间的共性,即“分子式相同”或是“分子组成相同”;另一是同分异构体间的差异,即“结构不同”且两个要点必须同时具备。现将一些存在“相同”和“相异”的概念比较如下:
相同点
不同点
同分异构体
分子式
结构
同系物
性质相似
分子组成中相差1个或n个CH2基因
同位素
质子数
中子数
同素异形体
同种元素
不同单质
将同分异构体和同系物两概念相比较时,同分异构体概念中强调“分子式相同”,所以分子量必相等,而同系物强调“分子组成上相差一个或几个CH2原子团,所以分子量必不等。因此,在互为同分异构体的各物质中,不可能存在互为同系物的物质,在互为同系物的各物质中,也不可能存在同分异构现象。
根据分子组成判断各同分异构体的结构和总数,是有机化学学习的重点内容之一。同分异构现象可分为3类:
(1)碳链异构(或称碳骨架异构):如乙苯和二甲苯,丁酸和异丁酸。
(2)相同官能团的位置异构:如1—丁烯和2—丁烯。
(3)官能团的种类异构:如丙醛和丙酮,乙醇和甲醚。
官能团的异构列表如下:
官能团异构类型
分子组成通式
烯烃—环烷烃
CnH2n
炔烃—二烯烃
CnH2n+2O
醇类—醚类
CnH2n-6O
酚类—芳香醇—芳香醚
CnH2n-6O
醛类—酮类—烯醇类—环氧烷—环烷醇
CnH2nO
羰酸—酯类—羟基醛
CnH2nO2
硝基化合物—氨基酸
CnH2n+1NO2
(三)重视各类物质性质的比较和分析,培养综合归纳的能力。
在有机化学的学习过程中,分别对各类有机物的主要性质,尤其是化学性质,有了比较系统的掌握之后,应注意,各类物质性质的横向比较,认识不同类的相关有机物在性质上的异同 。这本身也是对各种有机物性质的分析和归纳,见前面知识结构内容。
(四)定量认识有机物之间的相互反应。
在学习有机物的化学性质、制备和检验时,都要涉及有关的反应,对待反应的化学方程式, 除了明确反应物,生成物的组成和结构以及反应条件等定性内容之外,还必须同时明确各 物质之间的定量关系,不断强化理解学习的定量意识,现通过一些具体反应,举例说明如下:
(1)在烷烃和芳香烃与卤素(X2)的一卤取代反应中,被取代的H原子和卤素单质及生成的卤代烃物质的量之比为1∶1∶1。
(2)在不饱和烃与氢气或卤素的加成反应中, C C双键与氢气或卤素单质的量之比都是1∶1,若是CC叁键,则为1∶2
(3)当醇与金属钠反应时,醇羟基和反应消耗的Na及生成氢气物质的量之比为2∶2∶1。若醇羟基换成酚羟基或羰基,与金属钠反应时,也有同样的量关系。
(4)当醇被氧化成醛或酮时,反应中被氧化的醇羟基和消耗的O2与生成C O双键、H2O物质的量之比为2∶1;2∶2;若将氧化剂O2换成CuO,上述量关系 为1∶1∶1∶1。
(5)在银镜反应中,醛基和消耗的[Ag(NH3)2]+与生成的羟基,析出Ag物质的量之比为1∶2∶1∶2。
在醛和新制的Cu(OH)2悬浊液反应时,醛基、Cu(OH)2和生成的羰基、Cu2O物质的量之比为1∶2∶2∶1。
(6)在有机物(CxHyOz)完全燃烧的反应中,有机物和消耗的氧气、与生成的CO2、H2O物质的量之比为:
1∶(X+-)∶X∶。
(五)正确利用新信息迁移题,培养分析问题,解决问题的能力。
新信息迁移题,其特点是在题中联系社会实践和科学发展给予一定量的新的问题情境或有关信息,结合教材中所学知识而构成的一类新题型。在解题过程中,可体会到一些科学、社会的发展与化学学科间的重要性质,接触并学习一些新知识,从而提高自身的科学素养和文化素质,同时达到培养自学能力、信息接受和处理能力、问题的分析和解决能力。
在解新信息迁移题时,首先是全面地、认真地分析题中给予的信息内容、要点和规律,然后迁移到教材中有关的知识内容上,解决题中要求的问题。
相关文档
- 2020届高考化学一轮复习化学键 分2021-07-0915页
- 2019届高考化学一轮复习化学反应中2021-07-0914页
- 2021届高考化学一轮复习化学平衡状2021-07-098页
- 2020届高考化学一轮复习化学反应与2021-07-0911页
- 2021届高考化学一轮复习化学反应速2021-07-099页
- 2020届高考化学一轮复习化学反应速2021-07-0913页
- 2020届高考化学一轮复习化学反应速2021-07-094页
- 2021届高考化学一轮复习化学平衡常2021-07-0916页
- 2020届高考化学一轮复习化学平衡状2021-07-099页
- 2020年高考化学一轮复习化学反应速2021-07-0913页