- 303.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
甘肃省甘南藏族自治州合作第一中学2019-2020学年高一上学期期中考试试题
一、选择题:本题共12个小题,每小题4分,共48分。(四个选项中,只有一项符合题目)
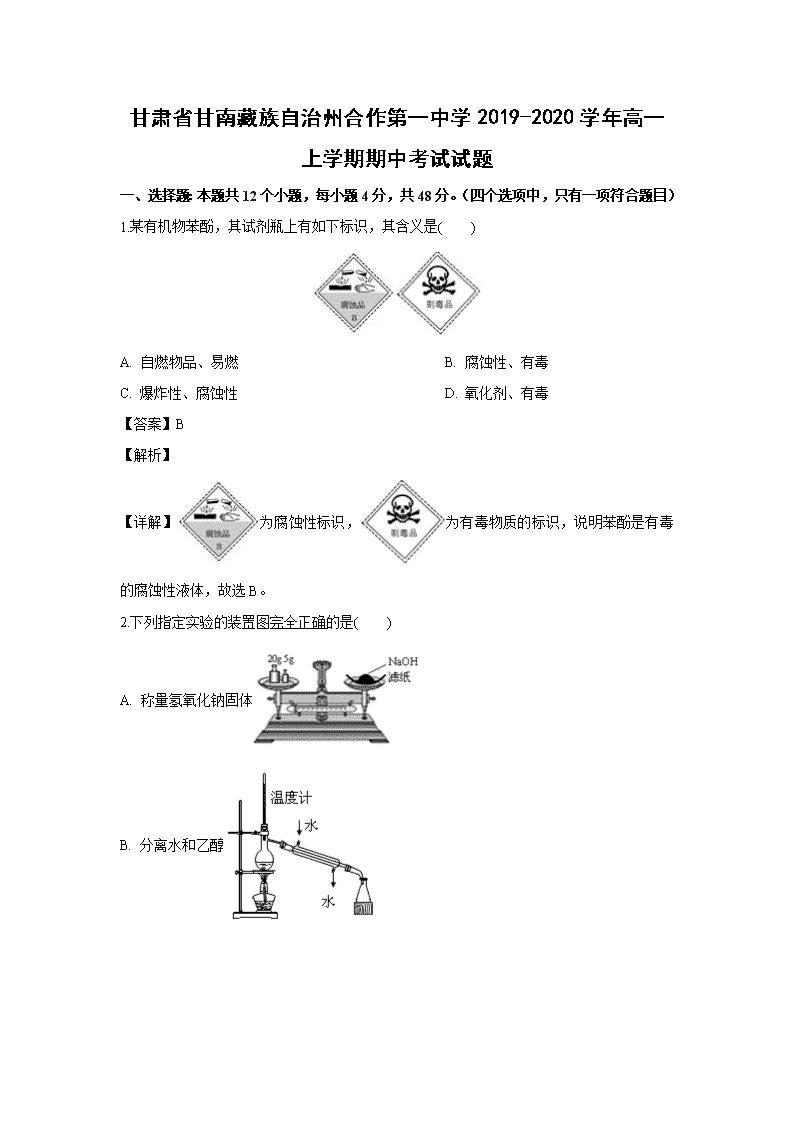
1.某有机物苯酚,其试剂瓶上有如下标识,其含义是( )
A. 自燃物品、易燃 B. 腐蚀性、有毒
C. 爆炸性、腐蚀性 D. 氧化剂、有毒
【答案】B
【解析】
【详解】为腐蚀性标识,为有毒物质的标识,说明苯酚是有毒的腐蚀性液体,故选B。
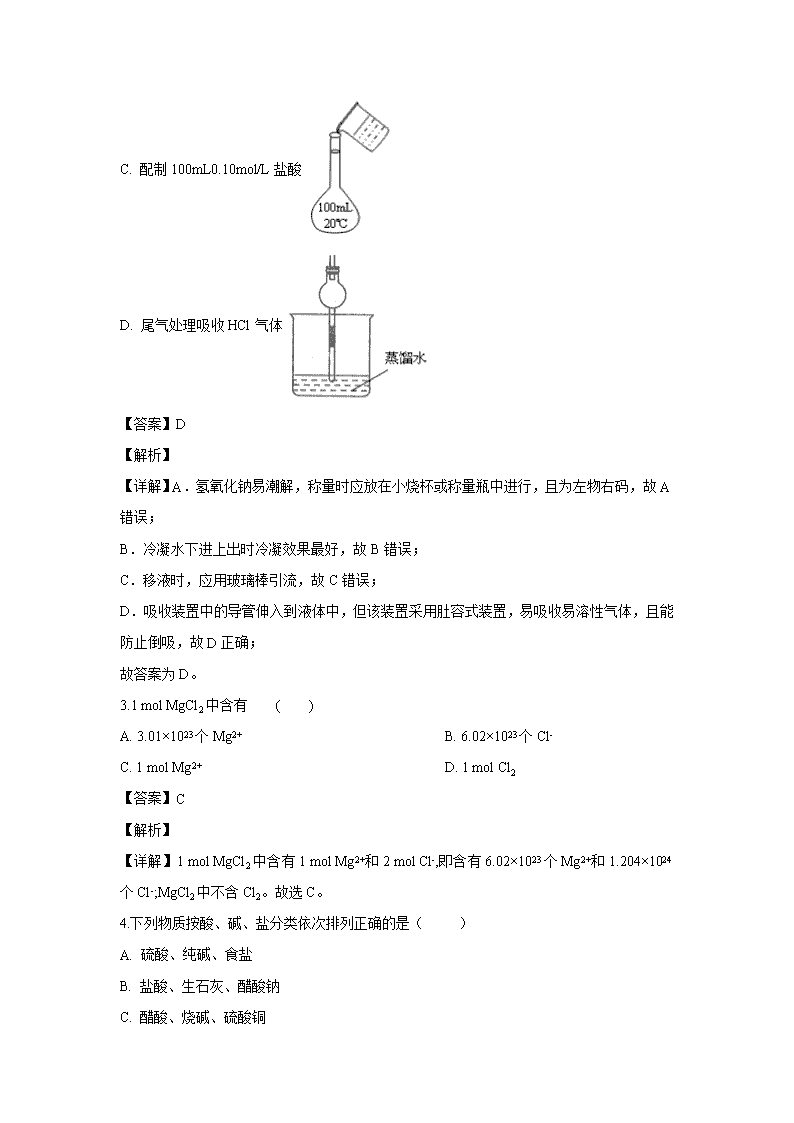
2.下列指定实验的装置图完全正确的是( )
A. 称量氢氧化钠固体
B. 分离水和乙醇
C. 配制100mL0.10mol/L盐酸
D. 尾气处理吸收HCl气体
【答案】D
【解析】
【详解】A.氢氧化钠易潮解,称量时应放在小烧杯或称量瓶中进行,且为左物右码,故A错误;
B.冷凝水下进上出时冷凝效果最好,故B错误;
C.移液时,应用玻璃棒引流,故C错误;
D.吸收装置中的导管伸入到液体中,但该装置采用肚容式装置,易吸收易溶性气体,且能防止倒吸,故D正确;
故答案为D。
3.1 mol MgCl2中含有 ( )
A. 3.01×1023个Mg2+ B. 6.02×1023个Cl-
C. 1 mol Mg2+ D. 1 mol Cl2
【答案】C
【解析】
【详解】1 mol MgCl2中含有1 mol Mg2+和2 mol Cl-,即含有6.02×1023个Mg2+和1.204×1024个Cl-;MgCl2中不含Cl2。故选C。
4.下列物质按酸、碱、盐分类依次排列正确的是( )
A. 硫酸、纯碱、食盐
B. 盐酸、生石灰、醋酸钠
C. 醋酸、烧碱、硫酸铜
D. 磷酸、石灰石、苛性钠
【答案】C
【解析】
【详解】A.纯碱的主要成分为碳酸钠,不属于碱,A不正确;
B.生石灰的主要成分为氧化钙,不属于碱,B不正确;
C.醋酸、烧碱、硫酸铜分别属于酸、碱、盐,C正确;
D.石灰石的主要成分为碳酸钙,不属于碱,苛性钠的主要成分为氢氧化钠,不属于盐,D不正确;
故选C。
5.下列物质不属于电解质的是( )
A. C2H5OH B. KOH C. HNO3 D. BaCl2
【答案】A
【解析】
【详解】在水溶液或熔融状态下能够导电的化合物为电解质。
A. 乙醇的水溶液或熔融状态下均不导电,乙醇是非电解质,故A符合题意;
B. 氢氧化钾在水溶液或者熔融状态都能导电,属于电解质,故B不符合题意;
C. 硝酸的水溶液可以导电,硝酸是电解质,故C不符合题意;
D. 氯化钡为离子化合物,在水溶液中或熔融状态导电,属于电解质,故D不符合题意;
故答案为A。
6.用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为NA
B. NA个CO2分子占有的体积为22.4L
C. 物质的量浓度为1mol/L的MgCl2溶液中,含有Cl-个数为2NA
D. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA
【答案】D
【解析】
【详解】A.标准状况下,H2O呈液态,无法计算其含有的分子数,A不正确;
B.NA个CO2分子为1mol,但不一定是标准状况,所以占有的体积不一定为22.4L,B不正确;
C.物质的量浓度为1mol/L的MgCl2溶液中,由于溶液的体积未知,无法求出含有Cl-
的个数,C不正确;
D.1.06g Na2CO3物质的量为=0.01mol,含有的Na+离子数为0.02NA,D正确;
故选D。
7.下列溶液中Cl-的物质的量浓度最大的是( )
A. 200mL2mol/L MgCl2溶液 B. 1000mL 2.5mol/L MgCl2溶液
C. 250mL 1.5mol/L AlCl3溶液 D. 300mL 3mol/L KCl溶液
【答案】B
【解析】
【详解】A.200mL2mol/L MgCl2溶液,c(Cl-)=4mol/L;
B.1000mL 2.5mol/L MgCl2溶液,c(Cl-)=5mol/L;
C.250mL 1.5mol/L AlCl3溶液,c(Cl-)=4.5mol/L;
D.300mL 3mol/L KCl溶液,c(Cl-)=3mol/L;
比较以上数据,可以得出,Cl-的最大浓度为5mol/L,故选B。
8.配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因可能是( )
A. 所用NaOH已潮解
B. 定容时,俯视刻度线
C. 用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
D. 托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
【答案】B
【解析】
【分析】分析溶液配制过程中所产生的误差时,可采用以下公式进行分析c==。
【详解】A.所用NaOH已潮解,m偏小,则c偏低,A不合题意;
B.定容时,俯视刻度线,V偏小,则c偏大,B符合题意;
C.采用左码右物法称量物品,药品质量m可能偏小,则c可能偏低,C不合题意;
D.NaOH固体放在纸上,称量过程中潮解,m偏小,则c偏低,D不合题意;
故选B。
9.实验室中需要配制2 mol·L-1的NaCl溶液950 mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A. 950 mL,111.2 g B. 500 mL,117 g
C. 1 000 mL,117 g D. 任意规格,111.2 g
【答案】C
【解析】
【详解】实验室没有950mL的容量瓶,应用1000mL的容量瓶进行配制,则n(NaCl)=1L×2mol·L-1=2mol,m(NaCl)=2mol×58.5g=117g;选C,故答案为:C。
10. 下列反应的离子方程式正确的是( )
A. Fe与稀H2SO4反应:2Fe + 6H+ = 2Fe3+ + 3H2↑
B. 硫酸铜溶液与氢氧化钡溶液反应 :Ba2++ SO42― = BaSO4↓
C. 氧化铜溶于硫酸:O2―+2H+= H2O
D. NaCl溶液与AgNO3溶液反应:Ag++Cl―= AgCl↓
【答案】D
【解析】
【详解】A.Fe与稀H2SO4反应产生硫酸亚铁和氢气,反应的离子方程式是:Fe + 2H+ = Fe2+ + H2↑,A错误;
B.硫酸铜溶液与氢氧化钡溶液反应产生硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式是 :Ba2++2OH-+Cu2++ SO42―=BaSO4↓+Cu(OH)2↓,B错误;
C.氧化铜溶于硫酸,氧化铜难溶于水,应该写化学式,离子方程式是:CuO+2H+ = Cu2++H2O,C错误;
D. 反应符合反应事实,拆写符合离子方程式的原则,D正确。
答案选D。
11.下列变化中,需加入氧化剂的是( )
A. 2Cl-→Cl2 B. Fe3+ →Fe2+
C. Cu2+ →Cu D. MnO4-→MnO2
【答案】A
【解析】
【分析】需要加入氧化剂,则选项中为还原剂的氧化反应,还原剂中某元素的化合价升高,以此来解答。
【详解】A.Cl元素的化合价升高,需要加氧化剂,故A正确;
B.Fe元素的化合价降低,需要加还原剂,故B错误;
C.Cu元素的化合价降低,需要加还原剂,故C错误;
D.Mn元素的化合价降低,需要加还原剂,故D错误;
故选A。
12.在溶液中,能大量共存的离子组是( )
A. Na+、Mg2+、SO42-、OH- B. Na+、Ba2+、Cl-、SO42-
C Cu2+、Ca2+、Cl-、NO3- D. Ag+、K+、NO3-、Cl-
【答案】C
【解析】
【详解】A.Mg2+和OH-发生离子反应生成氢氧化镁沉淀,不能大量共存,故A错误;
B.Ba2+和SO42-发生离子反应生成硫酸钡沉淀,不能大量共存,故B错误;
C.离子组Cu2+、Ca2+、Cl-、NO3-在同一溶液中彼此间不发生离子反应,能大量共存,故C正确;
D.Ag+和Cl-发生离子反应生成AgCl沉淀,不能大量共存,故D错误;
故答案为C。
二、非选择题:包括第13—第16题4个大题,每空2分共52分。
13.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__,装置B中玻璃棒的作用是__,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__,①中加入沸石的作用是__,冷却水的方向是__。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__(填代表装置图的字母,下同);除去自来水中的Cl−等杂质,选择装置__。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__,不产生白色沉淀表明Cl−已除净。
【答案】(1). 引流 (2). 搅拌 (3). 蒸馏烧瓶 (4). 防止液体暴沸 (5). 下进上出 (6). B (7). C (8). 稀硝酸和硝酸银溶液
【解析】
【详解】(1)过滤时玻璃棒的作用是引流,蒸发时玻璃棒的作用是搅拌;
(2)根据其结构可知①的名称是蒸馏烧瓶;加入沸石或碎瓷片可以防止暴沸;直形冷凝管在使用时为了保证冷凝效果,冷却水要下进上出;
(3)从氯化钠溶液中得到氯化钠固体可以采用蒸发结晶的方法,选择装置B;除去自来水中Cl-等杂质,可用蒸馏法,选择装置A;检验氯离子一般用硝酸酸化的硝酸银溶液。
14.(1)标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为__________。
(2)2L Fe2(SO4)3溶液中含Fe3+22.4g,则溶液中Fe3+的物质的量浓度为____________。
(3)现有4.4g CO2气体,在标准状况下其体积为___________,氧原子的个数为___________(用NA表示阿伏加德罗常数)
【答案】(1). 64g/mol (2). 0.2mol/L (3). 2.24L (4). 0.2NA
【解析】
【分析】(1)先求出标况下672mL气体的物质的量,再利用质量1.92g求出该气体的摩尔质量。
(2)先利用Fe3+的质量22.4g求出Fe3+的物质的量,再除以体积,便得出溶液中Fe3+的物质的量浓度。
(3)先求出4.4g CO2气体的物质的量,再乘以22.4L/mol,便求出标准状况下体积;再乘以分子中所含的氧原子数,即得氧原子的个数。
【详解】(1)标况下672mL气体的物质的量n==0.03mol,再利用质量1.92g求出该气体的摩尔质量M==64g/mol。答案为:64g/mol;
(2) Fe3+的物质的量n==0.4mol,溶液中Fe3+的物质的量浓度以c(Fe3+)==0.2mol/L。答案为:0.2mol/L;
(3)4.4g CO2气体的物质的量n==0.1mol,标准状况下体积V=0.1mol×22.4L/mol=2.24L;氧原子的个数为0.1mol×2×NAmol-1=0.2NA。答案为:2.24L;0.2NA。
15.实验室需要0.1mol/LNaOH溶液500mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是______________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________________________。
(2)在容量瓶的使用方法中,下列操作不正确的是______________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加入至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为_________g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度________0.1mol/L(填“大于”、“小于”或“等于”)。
(4)根据计算得知,需用量筒取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所得溶液浓度______0.5mol/L(填“大于”、“小于”或“等于”)
【答案】(1). C (2). 烧杯和玻璃棒 (3). BCD (4). 2.0 (5). 小于 (6). 13.6mL (7). 15mL (8). 大于
【解析】
【分析】(1)配制溶液时,固体需用天平称量、液体需用量筒量取,然后放在烧杯内用玻璃棒搅拌溶解,冷却后转移入容量瓶,然后加水定容。
(2)A.使用容量瓶前,需检查是否漏水,以保证配制过程中溶质不损失;
B.容量瓶用水洗净后,不能用待配溶液洗涤;
C.配制溶液时,如果试样是固体,应先放在烧杯内溶解,冷却后转移定容;
D.配制溶液时,若试样是液体,应先放在烧杯内溶解,冷却后转移定容;
E.溶液定容完成后,盖好瓶塞,上下颠倒摇匀。
(3) 用托盘天平称取的质量为0.1mol/L ×0.5L×40g
/mol。在实验中其他操作均正确,若定容时仰视刻度线,则所配溶液的体积偏大。
(4)利用稀释定律,可计算出需用量筒量取质量分数为98%,密度为1.84g/cm3的浓硫酸的体积;选择量筒时,规格尽可能小,但需一次量完。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所取浓硫酸体积偏大。
【详解】(1)配制溶液时,固体用天平、液体用量筒,然后放在烧杯内用玻璃棒搅拌溶解,冷却后转移入容量瓶,然后加水定容。在图中所示仪器中,配制上述溶液肯定不需要的是C,除图中已有仪器外,配制上述溶液还需要的玻璃仪器为烧杯和玻璃棒。答案为:C;烧杯和玻璃棒;
(2)A.使用容量瓶前,需检查是否漏水,以保证配制过程中溶质不损失,A正确;
B.容量瓶用水洗净后,不能用待配溶液洗涤,B不正确;
C.配制溶液时,如果试样是固体,应先放在烧杯内溶解,冷却后转移定容,C不正确;
D.配制溶液时,若试样是液体,应先放在烧杯内溶解,冷却后转移定容,D不正确;
E.溶液定容完成后,盖好瓶塞,上下颠倒摇匀,E正确;
故选BCD。答案为:BCD;
(3)用托盘天平称取的质量为0.1mol/L ×0.5L×40g/mol=2.0g。在实验中其他操作均正确,若定容时仰视刻度线,则所配溶液的体积偏大,则所得溶液浓度小于0.1mol/L。答案为:2.0;小于;
(4)设所需浓硫酸的体积为V,利用稀释定律,0.5mol/L×0.5L= ,V=0.0136L=13.6mL;如果实验室有15mL、20mL、50mL量筒,应选用15mL量筒最好。在实验中其他操作均正确,若量取浓硫酸时仰视刻度线,则所取浓硫酸体积偏大,所得溶液浓度大于0.5mol/L。答案为:13.6mL;大于。
16.氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是氧化剂,________是氧化产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是_______(填序号)。
A.该反应是置换反应
B.反应中NH3被氧化为N2
C.在反应中体现了金属铜的还原性
D.在反应中每生成1 mol H2O转移1 mol电子
(3)在反应H2SO3+2H2S==3H2O+3S↓中被氧化的元素与被还原的元素的质量比______。
【答案】(1). NH3 (2). O2 (3). NO (4). O2 (5). B (6). 2:1
【解析】
【分析】(1)还原剂是含有化合价升高元素的反应物,氧化剂是含有化合价降低元素的反应物,氧化产物是含化合价升高元素的生成物,被还原的物质是含化合价降低元素的反应物。
(2)A.该反应中没有单质参加反应,不是置换反应;
B.反应中NH3中所含N元素化合价升高;
C.在反应中金属铜的价态降低;
D.在反应中每生成1 mol H2O转移2 mol电子。
(3)在反应H2SO3+2H2S==3H2O+3S↓中被氧化的元素与被还原的元素都是S,由化学计量数关系可确定质量关系。
【详解】(1)该反应中,NH3中N元素由-3价升高到0价,NH3是还原剂,O2中O元素由0价降到-2价,O2是氧化剂,NO中N元素化合价升高,NO是氧化产物,被还原的物质是O2。答案为:NH3;O2;NO;O2;
(2)A.该反应中没有单质参加反应,不是置换反应,A不合理;
B.反应中NH3中所含N元素化合价升高,NH3被氧化为N2,B合理;
C.在反应中金属铜的价态降低,体现了CuO的氧化性,C不合理;
D.在反应中3H2O——6e-,则每生成1 mol H2O转移2 mol电子,D不合理;
故选B。答案为:B;
(3)在反应H2SO3+2H2S==3H2O+3S↓中,H2S中的S被氧化,H2SO3中的S被还原,被氧化的元素与被还原的元素的质量比2:1。答案为:2:1。