- 331.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
吉林省白山市长白朝鲜族自治县实验中学2020-2021学年高一上学期第一次月考试卷
第I卷(选择题)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cu-64
一、选择题(每小题只有一个正确答案,每题2分,共50分)
1.下列实验所示的变化中,属于物理变化的是( )
A带火星的木条复燃 B对着干燥玻璃片呼气
C.木炭在O2中燃烧 D向澄清石灰水中通入CO2
2.下列说法不符合“改善环境质量,推动绿色发展”这一主题的是( )
A.垃圾分类处理 B.农田过量施用农药、化肥 C.工厂的废水经处理后再排放 D.购物时用布袋代替塑料袋
3.我国科学院院士张青莲教授主持测定了铟、铱铕等几种元素的相对原子质量新值,其中铟元素在元素周期表中的信息如图所示,则下列说法正确的是( )
A.铟元素原子的质子数为49 B.铟元素原子的中子数为49
C.铟元素属于非金属元素 D.钢元素原子的相对原子质量为114.8g
4.人类为了维持生命和健康,必须摄取食物。下列有关说法中正确的是( )
A.摄入过多的油脂容易引发肥胖和心脑血管疾病,因此我们不要吃油脂类食物
B在六大类营养素中,除了水以外,我们每天需要量最大的营养素是维生素
C.人体缺乏维生素A会引起夜盲症
D.缺锌会引起食欲不振,生长迟缓,发育不良,因此我们要大量补充葡萄糖酸锌
5.下列实验操作正确的是( )
A.倾倒液体 B取用固体粉末
C加热液体 D点燃酒精灯
6.奥司他韦(C16H28N2O4)可抑制流感病毒在人体内的传播,起到治疗流行性感冒的作用。下列对奥司他韦的说法正确的是( )
A.从分类角度看:属于无机物
B.从量的角度看:碳、氢元素的质量比为4:7
C.从组成角度看:含有氧元素,属于氧化物
D.从结构角度看:分子中碳、氢、氮、氧原子个数比为8:14:1:2
7.根据反应事例能推导影响化学反应的因素,以下推导中错误的是( )
选项
化学反应事实
影响化学反应的因素
A
通常木炭充分燃烧生成二氧化碳不充分燃烧生成一氧化碳
反应温度
B
铁能与硫酸铜溶液反应,银不能与硫酸铜溶液反应
反应物的性质
C
硫在氧气中比在空气中燃烧更剧烈
反应物的浓度
D
分别将等浓度的稀盐酸加入锌片和锌粉中,锌粉反应更剧烈
反应物的接触面积
8.硫酸镁在工农业以及医疗上有着广泛应用,其溶解度如下表所示。则下列说法正确的是( )
温度/℃
10
30
50
70
90
溶解度/g
27.7
39.3
49.0
54.1
51.1
A.硫酸镁的溶解度随温度升高而增大
B.10℃时,27.7g硫酸镁和72.3g水可配制成质量分数为27.7%的硫酸镁溶液
C.50℃时,149g硫酸镁饱和溶液中溶质和溶剂的质量比为49:100
D.70℃时的硫酸镁饱和溶液升温至90℃,溶液的溶质质量分数增大
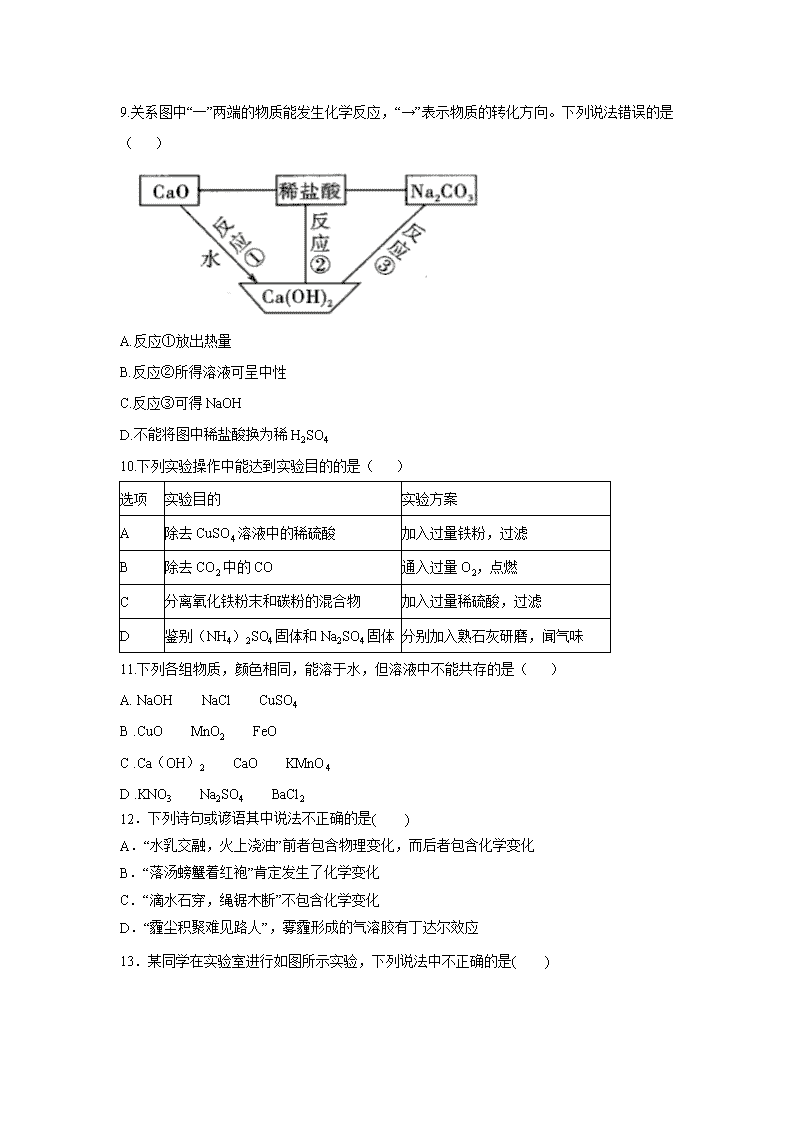
9.关系图中“一”两端的物质能发生化学反应,“→”表示物质的转化方向。下列说法错误的是( )
A.反应①放出热量
B.反应②所得溶液可呈中性
C.反应③可得NaOH
D.不能将图中稀盐酸换为稀H2SO4
10.下列实验操作中能达到实验目的的是( )
选项
实验目的
实验方案
A
除去CuSO4溶液中的稀硫酸
加入过量铁粉,过滤
B
除去CO2中的CO
通入过量O2,点燃
C
分离氧化铁粉末和碳粉的混合物
加入过量稀硫酸,过滤
D
鉴别(NH4)2SO4固体和Na2SO4固体
分别加入熟石灰研磨,闻气味
11.下列各组物质,颜色相同,能溶于水,但溶液中不能共存的是( )
A. NaOH NaCl CuSO4
B .CuO MnO2 FeO
C .Ca(OH)2 CaO KMnO4
D .KNO3 Na2SO4 BaCl2
12.下列诗句或谚语其中说法不正确的是( )
A.“水乳交融,火上浇油”前者包含物理变化,而后者包含化学变化
B.“落汤螃蟹着红袍”肯定发生了化学变化
C.“滴水石穿,绳锯木断”不包含化学变化
D.“霾尘积聚难见路人”,雾霾形成的气溶胶有丁达尔效应
13.某同学在实验室进行如图所示实验,下列说法中不正确的是( )
A.X中的浓溶液滴入沸水中可得到Z中液体
B.X中分散系能产生丁达尔效应
C.用过滤和渗析的方法,可将Z中液体分离提纯
D.Y中反应离子方程式:3CaCO3+2Fe3++3H2O=2Fe(OH)3(胶体)+3CO2↑+3Ca2+
14.酸式盐是盐的一种,可看作是多元酸中的氢离子未被完全中和所得到的盐,常见的有NaHCO3、NaHSO4、KH2PO4、K2HPO4等。已知 H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2,则下列说法正确的是( )
A.H3PO2属于二元酸 B.H3PO2属于三元酸
C.NaH2PO2属于酸式盐 D.NaH2PO2属于正盐
15.X、Y、Z、W各代表一种物质,若X+Y=Z+W,则X和Y的反应不可能是( )
A.盐和盐的反应 B.碱性氧化物和水的反应
C.酸与碱的反应 D.酸性氧化物和碱的反应
16.下列说法中正确的是( )
①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1nm到l00nm之间
A.3个 B.4个 C.5个 D.6个
17.在强碱性溶液里能大量共存,且溶液为无色透明的离子组是( )
A.K+、Fe2+、Cl-、 B.Na+、Cl-、、
C.Na+、Ca2+、、 D.Na+、、S2-、Cl-
18.下列说法中不正确的是( )
①不溶于水,其水溶液的导电能力极弱,所以是弱电解质
②的水溶液能导电,所以是电解质
③液氧不导电,所以液氧是非电解质
④硫酸氢钠电离出的阳离子有氢离子,所以硫酸氢钠是酸
⑤电解质放在水中一定能导电,非电解质放在水中一定不导电
A.①④ B.①④⑤ C.②③④ D.①②③④⑤
19.下列反应的离子方程式书写正确的是( )
A.用稀硫酸清洗铁锈(Fe2O3):Fe2O3+6H+=2Fe3++3H2O
B.铝片与硝酸汞溶液反应:Al+Hg2+=Al3++ Hg
C.硫酸铜溶液和氢氧化钡溶液混合:Ba2+ +SO42—=BaSO4↓
D.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
20.把各组中的气体通入溶液中,溶液的导电能力显著增强的是( )
A.CO2(g)通入NaOH溶液 B.CO2(g)通入石灰水
C.NH3(g)通入CH3COOH溶液 D.NH3(g)通入盐酸中
21.下列反应可用离子方程式“H++OH−=H2O”表示的是( )
A.NaHSO4溶液与Ba(OH)2溶液混合 B.NH4Cl溶液与Ca(OH) 2溶液混合
C.HNO3溶液与KOH溶液混合 D.Na2HPO4溶液与NaOH溶液混合
22.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A.Cu(OH)2和盐酸;Cu(OH)2和CH3COOH
B.BaCl2和NaHSO4;Ba(OH)2和H2SO4
C.NaHCO3和NaHSO4;Na2CO3和NaHSO4
D.NaHCO3(过量)和Ca(OH)2;Ca(HCO3)2和NaOH(过量)
23.用如图表示的一些物质或概念间的从属关系中不正确的是( )
X
Y
Z
A
氧化物
化合物
纯净物
B
盐
氯化钠
化合物
C
蔗糖
溶液
混合物
D
碱性氧化物
金属氧化物
氧化物
24.在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析不正确的是( )
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH–
C.c点,两溶液中含有相同量的OH–
D.a、d两点对应的溶液均显中性
25.下列反应,不能用离子方程式:Ca2++OH-+HCO3-=CaCO3↓+H2O表示的是( )
A.碳酸氢钠与足量的氢氧化钙 B.氢氧化钙与足量的碳酸氢钙
C.碳酸氢钙与足量的氢氧化钠 D.氢氧化钠与足量的碳酸氢钙
第II卷(非选择题)(共50分)
二、填空题
26.(10分)某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向 Ba(OH)2溶液中滴加盐酸,测定导电率的变化如图所示,回答下列问题:
(1)Ba(OH)2在水中以离子形式存在的实验证据是____________________________________。Ba(OH)2的电离方程式为 。
(2)A-B段,发生的离子反应是__________________________________________。
(3)B点恰好完全反应,此时溶液中存在的微粒有H2O、 。
(4)下列化学反应的实质与Ba(OH)2溶液与稀盐酸反应的实质相同的是__________。
A.Ba(OH)2和H2SO4 B.NaOH和H2SO4 C.Ba(OH)2与HNO3
27.(7分)人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内。当胃酸过多时就会出现“咯酸水”“烧心”“胃部隐隐作痛”等症状。目前市场上的抗酸药主要有①吸收性抗酸药,如NaHCO3等。②非吸收性抗酸药,如CaCO3、MgO、Al(OH)3等。
(1)上述所举抗酸药中有________个是电解质。
(2)写出NaHCO3在水溶液中的电离方程式:____________________________。
(3)CaCO3作抗酸药时发生反应的离子方程式为_______________________________。
(4)____________(填“可以”或“不可以”)服用BaCO3来治疗胃酸过多,理由是__________。
三、实验题
28.(8分)根据下列装置进行实验,请你参与并回答:
(1)填写标号仪器的名称:① ;② 。
(2)写出实验室用A制氧气的化学方程式: ;收集氧气的装置可选
(填字母序号)。
(3)实验室制取二氧化碳,可选用的发生装置是 (填字母序号);若用装置C收集二氧化碳气体,气体由 (填“a”或“b”)端进入;检验二氧化碳是否收满的方法是 。
29.(10分)(1)将饱和溶液滴入煮沸的蒸馏水中,继续加热至液体变为红褐色,得到的是__________;化学方程式为________________________________________________胶体与沉淀的本质区别在于___________________________________________。
(2)将(1)中得到的分散系装入U形管内,用石墨棒作电极,接通直流电源,通电一段时间后发现与电源负极相连的电极附近颜色__________,这个过程称为____________。
(3)将(1)中得到的分散系装入用鸡蛋内膜制成的袋子内,并将此袋子浸入盛水的烧杯中,此操作进行一段时间后,取一部分烧杯内的水溶液,向其中滴加溶液,________________(填实验现象);若取少量袋子内的液体加入试管中,逐滴滴加盐酸,______________________________________________________________(填实验现象)。
四、推断题
30.(5分)醋酸钙是常用的补钙剂。每年我国鸡蛋有上千万吨的产量,会产生数以万吨的废弃蛋壳(主要成分为CaCO3),如图所示是以废弃蛋壳作为原料回收膜并制备醋酸钙的一种工艺流程。
(1)鸡蛋壳的钙元素属于 (填“常量”或“微量”)元素。
(2)操作I的名称是 ,玻璃棒的作用 。
(3)写出煅烧蛋壳的化学反应方程式: _________________ 。
(4)膜分离时,盐酸要加入适量,不能过量的主要原因是
_______________________________ 。
31.(10分)A、B、C、D四种可溶性盐,其阳离子分别是Na+、Ba2+、Cu2+、Ag+中的某一种,阴离子分别是Cl-、SO42-、CO32-、NO3-中的某一种。现做以下实验:①将四种盐各取少量,分别溶于盛有5mL蒸馏水的4支试管中,只有B盐溶液呈蓝色。②分别向4支试管中加入2mL稀盐酸,发现A盐溶液中产生白色沉淀,C盐溶液中有较多气泡产生,而D盐溶液无明显现象。
(1)根据上述实验事实,推断这四种盐的化学式分别为:
A:______________;B:_______________;C:_____________;D:________________。
(2)写出下列反应的离子方程式:
①A+D→:_____________________________________________。
②B+D→:________________________________________________。
③C+HCl→气体:____________________________________________。
【参考答案】
1.B 2.B 3.A 4.C 5.B 6.D 7.A 8.C 9.D 10.D
11.D 12.C 13.B 14.D 15.B 16.A 17.B 18.D 19.A 20.C 21.C 22.D 23.B 24.C 25.C
26 (10分,每空2分)
(1)A点的导电率高 Ba(OH)2 = Ba2+ + 2OH-
(2) H+ + OH-= H2O (3) Ba2+、Cl- (4) BC
27 (7分) )(1) 4 (2) NaHCO3=Na++
(3) CaCO3+2H+=Ca2++H2O+CO2↑ (4) 不可以 Ba2+是重金属离子,对人体有害
28 (8分) (1)①试管;②长颈漏斗(2)2KMnO4=△=K2MnO4+MnO2+O2↑或2KClO3=△,MnO2= 2KCl+3O2↑ D或E (3)B a
把燃着的木条放在b导管口处,如果木条熄灭则集满
29 (10分)(1) 胶体 FeCl3+3H2O =Fe(OH)3(胶体)+3HCl
分散质粒子直径大小不同 (2) 变深 电泳
(3) 产生白色沉淀 先产生红褐色沉淀,后沉淀溶解得到棕黄色溶液
30(5分)(1)常量 (2)过滤 引流(3)
(4)防止消耗碳酸钙,减少醋酸钙的产量
31 (10分)(1)AgNO3 CuSO4 Na2CO3 BaCl2
(2)Ag++Cl-=AgCl↓ SO42-+Ba2+=BaSO4↓ CO32-+2H+=CO2↑+H2O