- 241.00 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
离子晶体
A篇 知识对点训练
知识点一 离子晶体
1.离子晶体不可能具有的性质是( )
A.较高的熔点 B.良好的导电性
C.溶于极性溶剂 D.坚硬而易粉碎
答案 B
解析 离子晶体是阴、阳离子通过离子键形成的晶体,无自由移动的离子,不能导电,在熔融状态或水溶液中能导电。
2.下列性质中,可以说明某晶体是离子晶体的是( )
A.具有较高的熔点
B.固态不导电,水溶液能导电
C.可溶于水
D.固态不导电,熔融状态能导电
答案 D
解析 A选项,原子晶体熔点也较高;B选项,有些分子晶体如HCl的水溶液也能导电;C选项,有些分子晶体也溶于水。
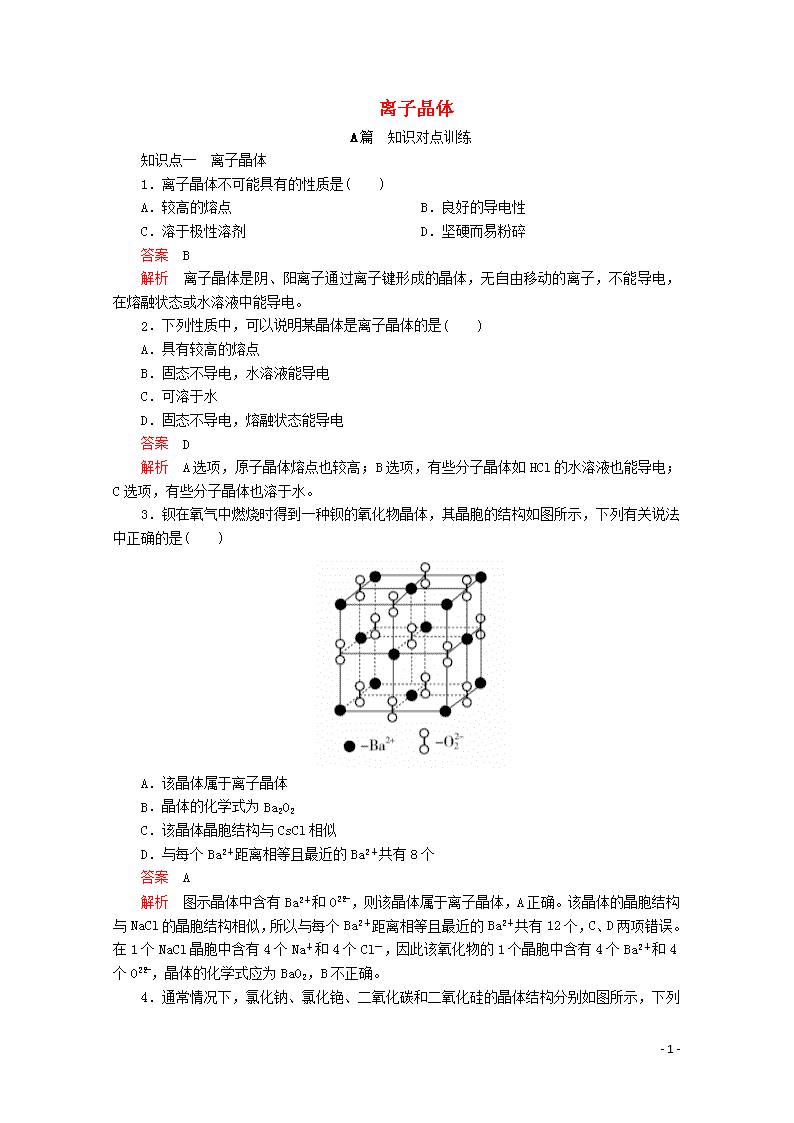
3.钡在氧气中燃烧时得到一种钡的氧化物晶体,其晶胞的结构如图所示,下列有关说法中正确的是( )
A.该晶体属于离子晶体
B.晶体的化学式为Ba2O2
C.该晶体晶胞结构与CsCl相似
D.与每个Ba2+距离相等且最近的Ba2+共有8个
答案 A
解析 图示晶体中含有Ba2+和O,则该晶体属于离子晶体,A正确。该晶体的晶胞结构与NaCl的晶胞结构相似,所以与每个Ba2+距离相等且最近的Ba2+共有12个,C、D两项错误。在1个NaCl晶胞中含有4个Na+和4个Cl-,因此该氧化物的1个晶胞中含有4个Ba2+和4个O,晶体的化学式应为BaO2,B不正确。
- 6 -
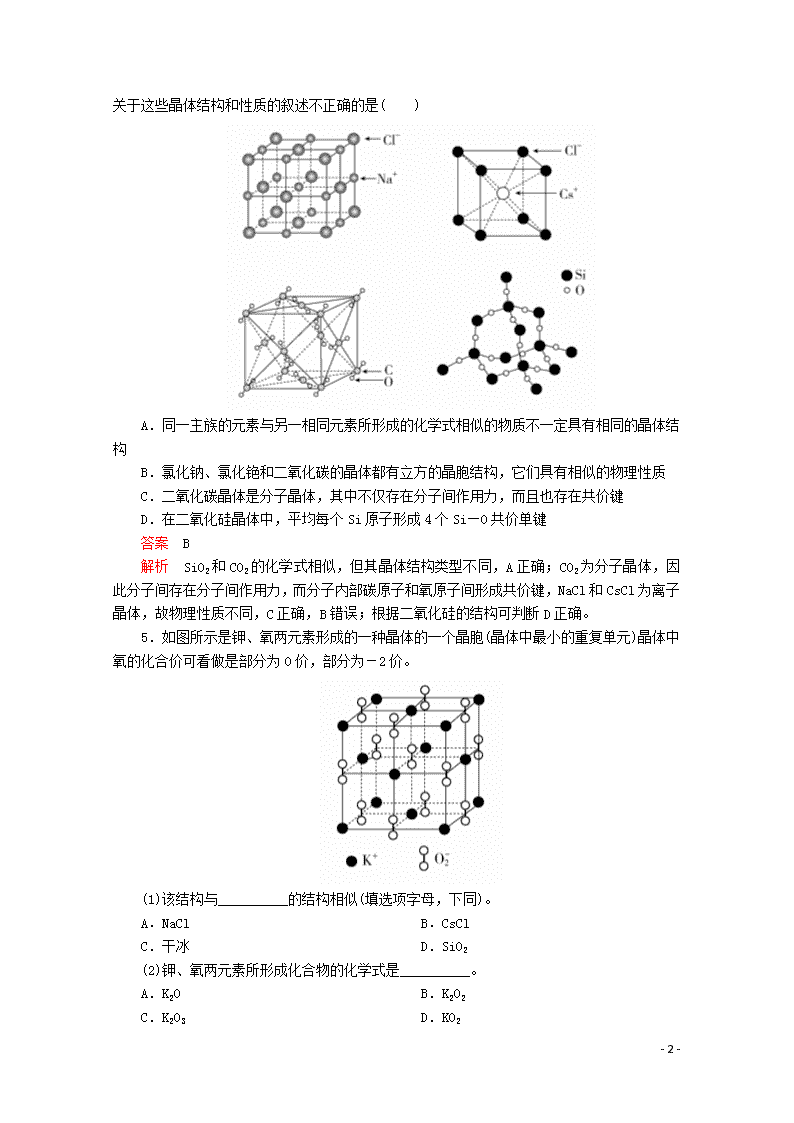
4.通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如图所示,下列关于这些晶体结构和性质的叙述不正确的是( )
A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B.氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键
答案 B
解析 SiO2和CO2的化学式相似,但其晶体结构类型不同,A正确;CO2为分子晶体,因此分子间存在分子间作用力,而分子内部碳原子和氧原子间形成共价键,NaCl和CsCl为离子晶体,故物理性质不同,C正确,B错误;根据二氧化硅的结构可判断D正确。
5.如图所示是钾、氧两元素形成的一种晶体的一个晶胞(晶体中最小的重复单元)晶体中氧的化合价可看做是部分为0价,部分为-2价。
(1)该结构与__________的结构相似(填选项字母,下同)。
A.NaCl B.CsCl
C.干冰 D.SiO2
(2)钾、氧两元素所形成化合物的化学式是__________。
A.K2O B.K2O2
C.K2O3 D.KO2
- 6 -
(3)下列对该晶体结构的描述正确的是__________。
A.晶体中与每个K+距离最近的K+有8个
B.晶体中每个K+周围有8个O,每个O周围有8个K+
C.每个O周围最近且等距离的K+所围成的空间构型为正八面体
D.晶体中,0价氧原子与-2价氧原子的数目比为3∶1
答案 (1)A (2)D (3)CD
解析 (1)该结构与NaCl晶体相似,相当于Na+被K+代替,Cl-被O代替。
(2)晶体中平均每个晶胞有K+:8×+6×=4个;有O:1+12×=4个,故其化学式为KO2。
(3)由图可看出,晶体中每个K+距离最近的K+有12个,每个K+周围有6个O,每个O周围有6个K+,每个O周围最近且等距离的K+所围成的空间构型为正八面体。设1 mol KO2中含有x mol 0价的氧原子,y mol-2价的氧原子,则有:x+y=2,2y=1,解得x=,y=,所以晶体中,0价氧原子与-2价氧原子的数目比为3∶1。
知识点二 晶格能
6.下列关于晶格能的说法中正确的是( )
A.晶格能指形成1 mol离子键所放出的能量
B.晶格能指破坏1 mol离子键所吸收的能量
C.晶格能指1 mol离子化合物中的阴、阳离子由相互远离的气态离子结合成离子晶体时所放出的能量
D.晶格能的大小与晶体的熔点、硬度都无关
答案 C
解析 晶格能影响离子晶体的稳定性、熔点等性质,D错误。
7.NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )
物质
①NaF
②NaI
③MgO
离子电荷数
1
1
2
离子间距离/10-10 m
2.31
3.18
2.10
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
答案 B
解析 NaF、NaI、MgO均为离子晶体,它们熔点高低由离子键强弱决定,而离子键的强弱与键长和离子电荷数有关,MgO中键长最短,离子电荷数最高,故离子键最强,NaF和NaI离子电荷数相等,但NaF的键长小于NaI,所以两者的离子键强弱:NaF>NaI。
8.下列热化学方程式中,能直接表示出氯化钠晶格能的是( )
A.Na+(g)+Cl-(g)―→NaCl(s) ΔH1
B.Na(s)+Cl(g)―→NaCl(s) ΔH2
C.2Na+(g)+2Cl-(g)―→2NaCl(s) ΔH3
D.Na(g)+Cl(g)―→NaCl(s) ΔH4
- 6 -
答案 A
解析 气态离子形成1 mol离子晶体释放的能量称为晶格能。
9.氧化钙在2973 K时熔化,而氯化钠在1074 K时熔化,两者的离子间距离和晶体结构类似,有关它们熔点差别较大的原因叙述不正确的是( )
A.氧化钙晶体中阴、阳离子所带的电荷数多
B.氧化钙的晶格能比氯化钠的晶格能大
C.氧化钙晶体的结构类型与氯化钠晶体的结构类型不同
D.在氧化钙与氯化钠的离子间距离类似的情况下,晶格能主要由阴、阳离子所带电荷的多少决定
答案 C
解析 CaO和NaCl都属于离子晶体,熔点的高低可根据晶格能的大小判断。晶格能的大小与离子所带电荷多少、离子间距离、晶体结构类型等因素有关。CaO和NaCl的离子间距离和晶体结构都类似,故晶格能主要由阴、阳离子所带电荷的多少决定。
10.下列有关离子晶体的数据大小比较不正确的是( )
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
答案 A
解析 Na+、Mg2+、Al3+半径越来越小,所带电荷越来越多,故熔点NaF<MgF2<AlF3。
B篇 综合提升训练
11.下列说法正确的是( )
A.离子晶体中可能含有共价键,但一定含有金属元素
B.分子晶体一定含有共价键
C.离子晶体中一定不存在非极性键
D.含有离子键的晶体一定是离子晶体
答案 D
解析 铵盐形成的晶体也是离子晶体,其中不含金属元素,故A错误;由稀有气体形成的分子晶体中只含范德华力而无共价键,故B错误;根据离子晶体的概念可知,只要含有离子键,形成的晶体就是离子晶体,但离子晶体中不一定只含有离子键,如Na2O2中含有非极性共价键,故C错误,D正确。
12.下面有关晶体的叙述中,不正确的是( )
A.金刚石为网状结构,由共价键形成的碳原子环中,最小的环上有6个碳原子
B.氯化钠晶体中,每个Na+周围紧邻且距离相等的Na+共有6个
C.氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D.干冰晶体中,每个CO2分子周围紧邻12个CO2分子
答案 B
解析 金刚石——每个碳原子与4个碳原子紧邻,由5个碳原子形成正四面体结构单元。由共价键构成的最小环状结构中有6个碳原子;NaCl——每个Na+紧邻6个Cl-,每个Cl-
- 6 -
紧邻6个Na+,每个Na+与12个Na+等距离相邻;CsCl——每个Cs+紧邻8个Cl-,每个Cl-紧邻8个Cs+,每个Cs+与6个Cs+等距离相邻;干冰——每个CO2分子紧邻12个CO2分子。
13.请回忆食盐晶体结构,已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体里Na+和Cl-的间距是 ( )
A. cm B. cm
C. cm D. cm
答案 B
解析 已知一个晶胞中有4个NaCl,且食盐晶体中Na+与Cl-的间距的2倍正好是晶胞的边长。设边长为a,故有×NA=4。解得a=,则= cm。
14.已知X、Y、Z为同一短周期的三种元素,其原子的部分电离能I(kJ·mol-1)如下表所示:
I
X
Y
Z
I1
496
738
577
I2
4562
1451
1817
I3
6912
7733
2754
I4
9540
10540
11578
(1)三种元素的电负性大小关系为_______________________________。
(2)写出Y原子的核外电子排布式__________,Y的第一电离能大于Z的第一电离能的原因为_______________________________________________。
(3)X晶体的堆积方式为__________(填字母序号)。
(4)NaCl、KCl、MgO、CaO晶体结构相似,晶体的晶格能数据如下表:
晶体
NaCl
KCl
CaO
MgO
晶格能(kJ·mol-1)
787
715
3401
3890
4种晶体的熔点由高到低的顺序是__________。
答案 (1)Z>Y>X (2)1s22s22p63s2
- 6 -
Y元素原子最外层s轨道上的电子处于全满状态 (3)A
(4)MgO>CaO>NaCl>KCl
解析 根据表中数据,对于X元素而言,I2为I1的10倍左右,说明X原子最外层只有一个电子,X是第ⅠA族元素。同理可知,Y是第ⅡA族元素,Z属于第ⅢA族元素,由于它们在同一周期,X、Y、Z分别为Na、Mg、Al,电负性大小关系为Z>Y>X。
- 6 -
相关文档
- 高考化学第一轮复习课件第3讲 晶2021-07-095页
- 2020届一轮复习人教全国版第39讲晶2021-07-0926页
- 2018届一轮复习人教版晶体结构与性2021-07-0920页
- 化学高考一轮复习课件:第13章 第3讲2021-07-0954页
- 2020版高考化学一轮复习晶体结构与2021-07-0913页
- 2019届一轮复习人教版晶体结构与性2021-07-0912页
- 2019届一轮复习人教版晶体结构与性2021-07-0912页
- 2019届一轮复习人教版晶体结构与性2021-07-097页
- 2018届一轮复习人教版晶体结构与性2021-07-0923页
- 2021届一轮复习人教版第38讲 晶体2021-07-098页