- 1.27 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 原子结构与性质
一、核外电子的运动特征
1.利用统计学的方法,用电子在原子核外空间某处出现机会的多少来描述
原子核外电子的运动状态。
2.对“电子云”图的认识
(1)“电子云”图是指
用小黑点的疏密来表示电子在核外空间单位体积内
出现机会多少
的一种图像。
(2)电子在核外空间一定范围内出现,好像带①
负
电荷的云雾笼罩在原
子核周围,人们形象地称之为“电子云”。
考点
清单
(3)在离核越近处,单位体积内电子出现的机会越多,“电子云”(小黑点表
示)的密度②
越大
;相反,在离核越远处,单位体积内电子出现的机会越
少,“电子云”的密度③
越小
。
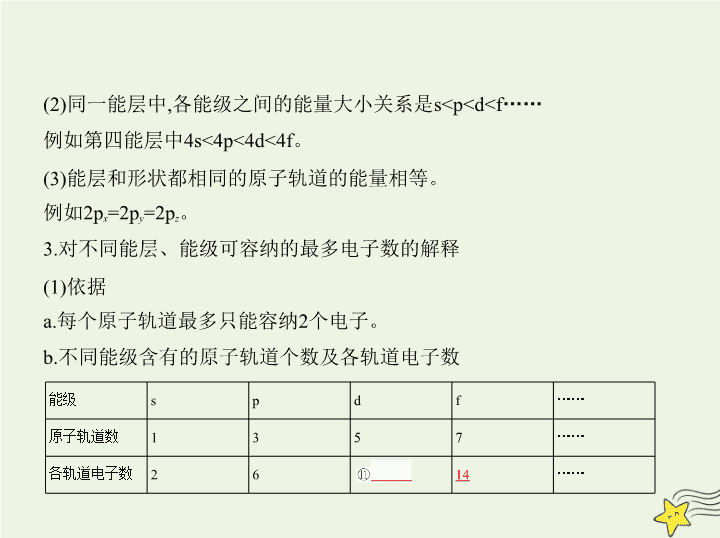
二、能层与能级
1.不同能层的能级组成
同一能层的能级总是从④
s
能级开始,能层的能级数等于该能层的序
数:第一能层只有⑤
1
个能级(1s),第二能层有⑥
2
个能级(2s和2p),
第三能层有⑦
3
个能级(3s、3p和3d),依次类推。其中s轨道形状为⑧
球形
,p轨道形状为⑨
哑铃形
。
2.不同能层中各能级之间的能量大小关系
(1)不同能层中同一能级,能层序数越大能量⑩
越高
。
例如1s<2s<3s
……
2p<3p<4p
……
(2)同一能层中,各能级之间的能量大小关系是sH
2
S,
HF>HCl,NH
3
>PH
3
。分
子内氢键使物质的
熔、沸点降低
影响分子的稳定性;共
价键键能越大,分子稳
定性越强
2.分子的性质
(1)分子的极性
分子构型与分子极性的关系:
极性分子:正电中心和负电中心不重合,结构不对称。
非极性分子:正电中心和负电中心重合,结构对称。
(2)分子的溶解性
a.“相似相溶”的规律:非极性溶质一般能溶于
非极性
溶剂,极性溶
质一般能溶于
极性溶剂
。若溶剂和溶质分子之间可以形成氢键,则
溶质的溶解度
增大
。
b.随着溶质分子中憎水基(比如烃基、卤素原子)的增多,溶质在水中的溶
解度减小。如甲醇、乙醇和水以任意比互溶,而戊醇在水中的溶解度明显
减小。
(3)分子的手性
a.手性异构:具有完全相同的组成和原子排列的一对分子,如同左手和右手
一样互为
镜像
,但在三维空间里
不能重叠
的现象。
b.手性分子:具有
手性异构体
的分子。
c.手性碳原子:在有机物分子中,连有
四个不同基团或原子
的碳原子。
注意
含有手性碳原子的分子不一定是手性分子。
(4)无机含氧酸分子的酸性
无机含氧酸的通式可写成(HO)
m
RO
n
,如果成酸元素R相同,则
n
值越大,R的
正电性越高,使R—O—H中O的电子向R偏移,在水分子的作用下越易电离
出H
+
,酸性越强,如酸性:HClO离子晶体>分子晶体,金属
晶体有高有低。
例题(2019山西太原定时训练,35)已知元素N、S、Cl可形成多种物质,在工
业生产上有着广泛的应用。请回答下列问题:
(1)Fe
3+
可与SCN
-
形成多种配离子,其中一种为[Fe(SCN)
6
]
3-
,该配离子中的
SCN
-
会使铁的剩余价电子压缩配对,则每个配离子中铁的单电子个数为
。
(2)Se与S是同族元素,请写出基态Se原子的核外电子排布式:
。N与S是不同族元素,请解释NH
3
在水中的溶解度比H
2
S大的原因:
。
(3)有一种共价化合物由1~9号元素中的部分元素组成,且与SCl
2
互为等电
子体,它的分子式为
。借助等电子原理可以分析出SCN
-
中σ键和π
键的个数比为
。
(4)已知S
4
的结构为
,其中S原子的杂化方式是
。N、P可分别形成多种三角锥形分子,已知NH
3
的键角大于PH
3
,原因
是
。
(5)离子晶体中阳离子和阴离子的半径比不同可形成不同的晶胞结构,如
表:
半径比
0.225~0.414
0.414~0.732
0.732~1
典型化学式
立方ZnS
NaCl
CsCl
晶胞
已知某离子晶体RA,其阴、阳离子半径分别为184 pm和74 pm,摩尔质
量为
M
g·mol
-1
,则阳离子配位数为
,晶体的密度为
g·cm
-3
。
(列出计算式,无需化简,设
N
A
为阿伏加德罗常数的值)
解题导引 (5)根据阳离子、阴离子半径的比值可确定晶体类型,结合均摊
法可确定晶胞中各原子数目,根据晶胞中等量关系
nM
=
ρV
可建立等量关系,
但需仔细观察晶体构型(立方ZnS型),明确几何关系:阴、阳离子半径之和
为体对角线长的1/4,体对角线长为晶胞边长的
倍,进而求出晶胞的体积,
代入上述等量关系中进行计算。
解析 (1)[Fe(SCN)
6
]
3-
中Fe为+3价,3d能级中单电子数为5,由于SCN
-
会使铁
的剩余价电子压缩配对,则铁的3d能级中5个电子形成2对电子,故剩余单电
子个数为1。(2)根据构造原理可知基态Se原子的核外电子排布式为
1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
4
或[Ar]3d
10
4s
2
4p
4
。NH
3
与H
2
O分子间能形成氢键,使
NH
3
在水中的溶解度较大;而H
2
S与H
2
O分子间不能形成氢键,故H
2
S在水中的溶解度较小。(3)根据等电子体的概念和判断方法可知,1~9号元素形成的共价
化合物中,与SCl
2
互为等电子体的是OF
2
。SCN
-
与CO
2
互为等电子体,CO
2
的
结构式为O
C
O,其中σ键和π键个数比为2∶2=1∶1,则SCN
-
中σ键和π键
的个数比也为1∶1。(4)由S
4
的结构可看出,有的S原子形成4个σ键且无
孤电子对,有的S原子形成2个σ键且含有2对孤电子对,则硫原子为sp
3
杂
化。NH
3
和PH
3
均是三角锥形结构,成键电子对都受一对孤电子对的斥力影
响,由于电负性:N>P>H,且原子半径:NPH
3
。(5)晶体RA中阳、阴离子半径比为74 pm
÷
184 pm
≈
0.402,该晶体的晶胞为立方ZnS型,根据晶胞图示可看出阴离子的
配位数为4,阳离子的配位数也为4。由均摊法可知该晶胞中含4个“RA”,
结合图示可看出阴、阳离子半径之和为体对角线长的1/4,且体对角线长为
晶胞边长的
倍,则晶胞的边长为
pm,设晶体密度为
ρ
g·cm
-3
,根
据
×
M
=[
×
10
-10
]
3
ρ
,求得
ρ
=
。
答案 (1)1
(2)[Ar]3d
10
4s
2
4p
4
或1s
2
2s
2
2p
6
3s
2
3p
6
3d
10
4s
2
4p
4
NH
3
分子与H
2
O分子之间可形
成氢键,而H
2
S分子与H
2
O分子之间不能形成氢键
(3)OF
2
1∶1
(4)sp
3
杂化 电负性:N>P>H,且氮原子半径小于磷原子半径,NH
3
分子中成
键电子对彼此相距更近,斥力更大(或电负性:N>P>H,NH
3
分子中氮原子上
的孤电子对比PH
3
分子中磷原子上的孤电子对离核更近,对成键电子对排
斥力更小)
(5)4
应用所学的原子核核外电子排布式、轨道杂化类型、空间构型、σ键、π
键、配位键、配体、配合物、等电子体、晶胞、电负性、氢键等知识,合
理分析推理,解决物质结构与性质类问题。
实践探究
例题(2019江苏苏州期末,21A)锂盐二氟草酸硼酸锂[LiBF
2
(C
2
O
4
)]是新型锂
离子电池的电解质,乙酸锰可用于制造离子电池的负极材料。合成方法如
下:
2H
2
C
2
O
4
+SiCl
4
+2LiBF
4
2LiBF
2
(C
2
O
4
)+SiF
4
+4HCl
4Mn(NO
3
)
2
·6H
2
O+26(CH
3
CO)
2
O
4(CH
3
COO)
3
Mn+8HNO
2
+3O
2
↑+
40CH
3
COOH
(1)Mn
3+
基态核外电子排布式为
。
(2)草酸(HOOCCOOH)分子中碳原子轨道的杂化类型是
,1 mol
草酸分子中含有σ键的数目为
。
(3)与SiF
4
互为等电子体的阴离子的化学式为
(写一个即可)。
(4)CH
3
COOH易溶于水,除了它是极性分子外,还因为
。
(5)锰的一种晶胞结构如图所示,锰晶体中每个锰原子距离最近的锰原子数
目为
。
解析 (2)双键中的碳原子轨道的杂化类型为sp
2
杂化,草酸(HOOCCOOH)
分子中的两个碳原子均为sp
2
杂化。1个草酸(HOOCCOOH)分子中:2个碳
原子之间形成1个σ键,4个氧原子分别和碳原子之间形成4个σ键,2个氢原
子和氧原子之间形成2个σ键,共有1+4+2=7个,故1 mol草酸分子中含有σ键
的数目为7 mol或7
×
6.02
×
10
23
个。
答案 (1)[Ar]3d
4
(2)sp
2
7 mol或7
×
6.02
×
10
23
(3)S
、P
等(合理即可)
(4)乙酸与水分子间可形成氢键
(5)12