- 84.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
4.2.1 铝与铝合金
1.近几年的研究显示,铝可以扰乱人体的代谢作用,长期地、缓慢地对人体的健康造成危害。你认为下列哪几种方法可以防治铝中毒(D)
①人们合理利用开发各种铝资源,从根本上减少铝的排放和流失
②有节制地使用铝制品,避免食物或者饮用水与铝制品的接触或沾染
③改良不合理的饮食习惯,尽量减少铝的入口途径,如丢开Al(OH)3药剂,改用胃动力药物
④利用现代科技手段设法消除或减轻铝毒危害,如改进水处理工艺
A.①③④ B.②④ C.②③④ D.全部
2.铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为“食品污染源之一”而加以控制。铝在下列使用场合须加以控制的是(A)
①制铝锭②制易拉罐③制电线电缆④制牙膏皮⑤用明矾[KAl(SO4)2·12H2O]净水⑥制炊具⑦用明矾和苏打作食物膨化剂
⑧用Al(OH)3制成药片治胃病⑨制防锈油漆
A.②④⑤⑥⑦⑧ B.②⑤⑥⑦⑨
C.①②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
3.在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应选用下列试剂中的(D)
A.石灰水 B.氢氧化钠溶液
C.硫酸 D.氨水
4.将铝粉投入某无色澄清溶液中产生H2,则下列离子组一定能在该溶液中大量存在的是(D)
A.H+、Mg2+、Al3+、ClO-
B.Na+、Al3+、Cl-、Ba2+
C.OH-、Al3+、Cl-、
D.Na+、Ba2+、Cl-、
5.下列说法不正确的是(C)
A.铝热反应属于置换反应
B.常温下,铝、铁在浓硝酸中能发生钝化
C.一定情况下,铝能与氧化镁发生反应
D.铝与稀硝酸反应,若还原产物为NO,则每反应1 mol Al能生成1 mol NO
3
6.等质量的两份铝分别与适量稀硫酸和NaOH溶液反应,若消耗两溶液的体积相等,则两溶液的物质的量浓度之比为(A)
A.3∶2 B.2∶3 C.2∶1 D.1∶2
7.将5.4 g Al投入200.0 mL 2.0 mol·L-1的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为(D)
A.HNO3溶液 B.Ba(OH)2溶液
C.H2SO4溶液 D.HCl溶液
8.称取两份铝粉,第一份加入足量的浓NaOH(aq),第二份加入足量的HCl(aq),如果放出等体积的气体(在同温同压下),则两份铝粉的质量之比为(D)
A.1∶2 B.1∶3 C.3∶2 D.1∶1
9.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH的物质的量之比为(C)
A.1∶1 B.2∶1 C.3∶1 D.1∶3
10.实验室制备Al(OH)3最好用(D)
A.Al2O3和稀盐酸B.Al2O3和水
C.Al2(SO4)3和KOHD.AlCl3和氨水
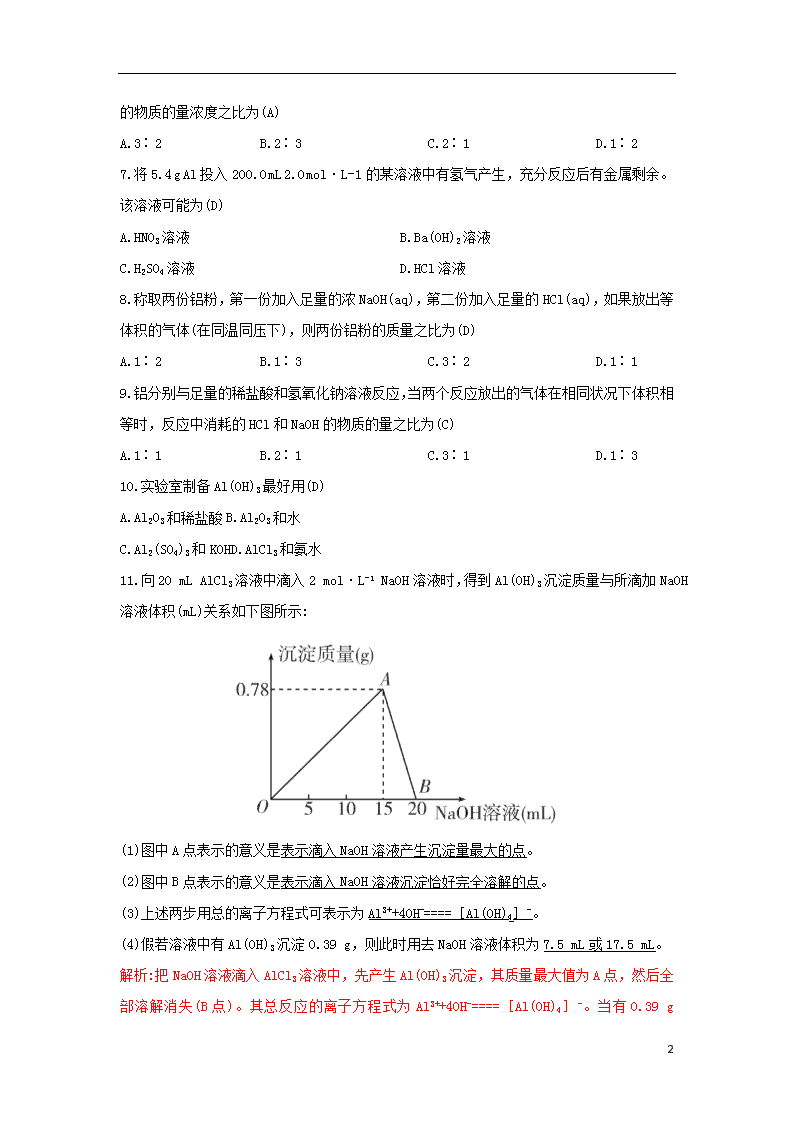
11.向20 mL AlCl3溶液中滴入2 mol·L-1 NaOH溶液时,得到Al(OH)3沉淀质量与所滴加NaOH溶液体积(mL)关系如下图所示:
(1)图中A点表示的意义是表示滴入NaOH溶液产生沉淀量最大的点。
(2)图中B点表示的意义是表示滴入NaOH溶液沉淀恰好完全溶解的点。
(3)上述两步用总的离子方程式可表示为Al3++4OH-====[Al(OH)4]-。
(4)假若溶液中有Al(OH)3沉淀0.39 g,则此时用去NaOH溶液体积为7.5 mL或17.5 mL。
解析:把NaOH溶液滴入AlCl3溶液中,先产生Al(OH)3沉淀,其质量最大值为A点,然后全部溶解消失(B点)。其总反应的离子方程式为Al3++4OH-====[Al(OH)4]-。当有0.39 g
3
Al(OH)3沉淀生成时,①AlCl3过量,加入NaOH使Al3+部分产生沉淀为0.39 g,通过Al3++3OH-====Al(OH)3↓可知用去NaOH溶液7.5 mL。②继续滴加NaOH溶液,Al3+全部参加反应生成Al(OH)3沉淀后又部分溶解,用去NaOH溶液17.5 mL。
12.某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
(1)溶液中一定含有的溶质是HCl、AlCl3、NH4Cl(填化学式)。
(2)溶液中一定不含有的溶质是MgCl2、Na2CO3(填化学式)。
(3)溶液中可能含有的溶质是氯化钾(填名称),判断该物质是否存在的实验方法是焰色反应,现象是透过蓝色钴玻璃观察,焰色为紫色。
(4)分别写出AB段、BC段发生反应的离子方程式:
①AB段为Al3++3OH-====Al(OH)3↓。
②BC段为NH+4+OH-====NH3·H2O。
解析:首先分析图像,找出图像中的转折点、斜线及水平线,结合题意可知OA段是NaOH溶液与HCl发生中和反应,加入过量NaOH溶液,沉淀全部溶解,说明无MgCl2,所以沉淀只有Al(OH)3,BC段是NaOH溶液与NH4Cl的反应,所以溶液中一定含有HCl、AlCl3、NH4Cl,一定无MgCl2;又因为AlCl3与Na2CO3不能大量共存,所以一定无Na2CO3;可能含KCl,鉴定钾元素可利用焰色反应。
3
相关文档
- 高中化学 第三章 第三节 第3课时 2021-08-066页
- 高中化学58个精讲4钠及其化合物的2021-08-0610页
- 高中化学选修3人教版同步练习及测2021-08-066页
- 高中化学同步练习 3_2 分子晶体与2021-08-067页
- 2018-2019学年吉林省东辽市普通高2021-08-068页
- 2020高中化学 每日一题之快乐暑假 2021-08-063页
- 2020高中化学 单元复习(提高)巩固练2021-08-067页
- 2019高中化学 第四章 生命中的基础2021-08-065页
- 高中化学 第四章 第一节 金属矿物2021-08-066页
- 高中化学 第四章 本章复习课课后作2021-08-065页