- 102.67 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时规范练14 原子结构与化学键
基础巩固
1.下列叙述正确的是( )
A.40K和40Ca原子中的质子数和中子数都相等
B.某元素的原子最外层只有一个电子,则它一定是金属元素
C.任何原子或离子的组成中都含有质子
D.同位素的不同核素的物理、化学性质完全相同
2.(2019甘肃武威第六中学高三考试)下列化学用语表示正确的是( )
A.中子数为20的氯原子:1735Cl
B.二氧化硅的分子式:SiO2
C.硫化氢的结构式:H—S—H
D.氯化铵的电子式:[H ··N·· H····HH]+Cl
3.下列叙述中正确的是( )
A.两种微粒,若核外电子排布完全相同,则其化学性质一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两原子如果核外电子排布相同,则一定属于同种元素
D.单核阴离子的核外电子排布一定与上一周期稀有气体元素原子的核外电子排布相同
4.(2019浙江台州一模)下列说法正确的是( )
A.MgF2中的两种离子核外电子排布相差一个电子层
B.石英和硫黄晶体熔化时克服相同类型的微粒间作用力
C.发生物理变化时物质中的化学键也可能被破坏
D.H2O和H2O2的稳定性不同是因为分子间作用力不同
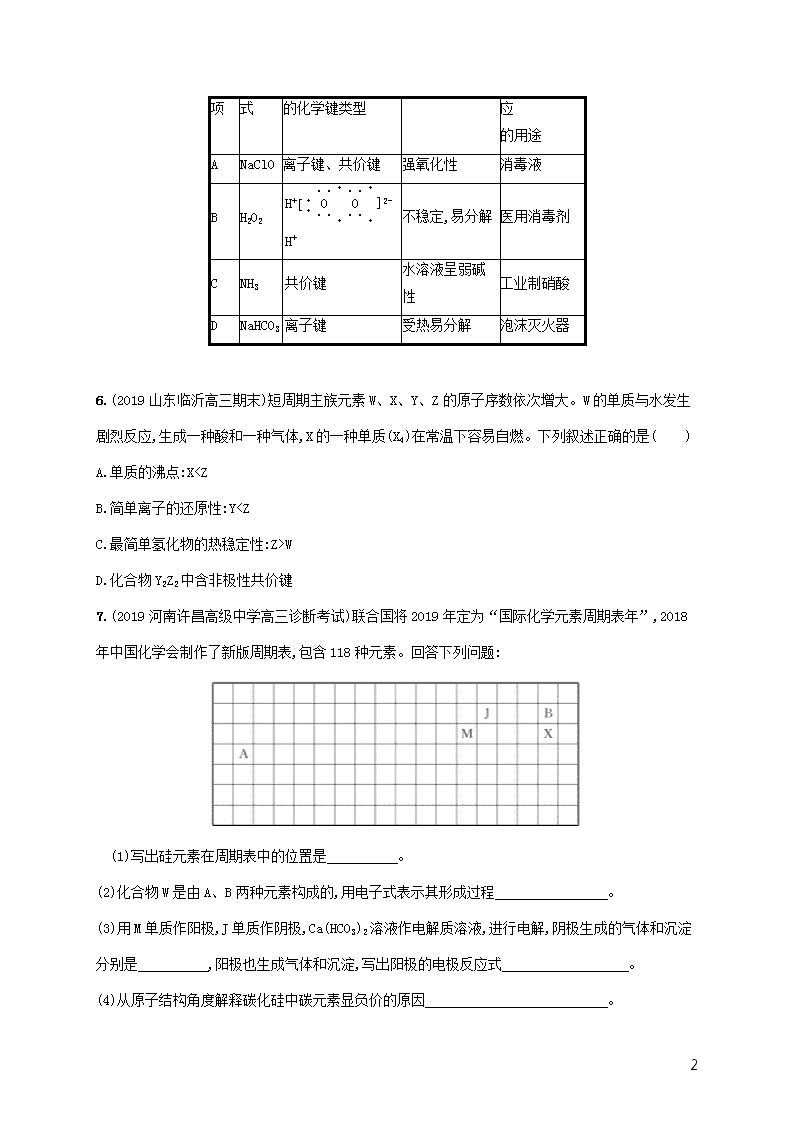
5.(2019山东师范大学附属中学高三模拟)下表中相关物质的信息都正确的一项是( )
选
化学
电子式或含有
物质的性质
与性质相对
11
项
式
的化学键类型
应
的用途
A
NaClO
离子键、共价键
强氧化性
消毒液
B
H2O2
H+[··O······O······]2-H+
不稳定,易分解
医用消毒剂
C
NH3
共价键
水溶液呈弱碱性
工业制硝酸
D
NaHCO3
离子键
受热易分解
泡沫灭火器
6.(2019山东临沂高三期末)短周期主族元素W、X、Y、Z的原子序数依次增大。W的单质与水发生剧烈反应,生成一种酸和一种气体,X的一种单质(X4)在常温下容易自燃。下列叙述正确的是( )
A.单质的沸点:XW
D.化合物Y2Z2中含非极性共价键
7.(2019河南许昌高级中学高三诊断考试)联合国将2019年定为“国际化学元素周期表年”,2018年中国化学会制作了新版周期表,包含118种元素。回答下列问题:
(1)写出硅元素在周期表中的位置是 。
(2)化合物W是由A、B两种元素构成的,用电子式表示其形成过程 。
(3)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解质溶液,进行电解,阴极生成的气体和沉淀分别是 ,阳极也生成气体和沉淀,写出阳极的电极反应式 。
(4)从原子结构角度解释碳化硅中碳元素显负价的原因 。
11
(5)第118号元素为Og(中文名是“”,ào),下列说法正确的是 。
a.Og是第七周期0族元素
b.Og原子的核外有118个电子
c.Og在同周期元素中非金属性最强
d.该元素中子数为179的核素符号是 118179Og
(6)已知X与Y是位于相邻周期的同主族元素。某温度下,X、Y的单质与H2化合生成气态氢化物的平衡常数分别为KX =9.7×1012、KY =5.6×107。Y是 (填元素符号),判断的理由是 。
能力提升
8.(2019上海同济中学月考)月球上的每百吨 23He聚变所释放出的能量相当于目前人类一年消耗的能量,地球上氦元素主要以 24He的形式存在。已知一个12C原子的质量为a g,一个 23He原子的质量为b g,NA为阿伏加德罗常数的值。下列说法正确的是( )
A.23He比 24He多一个中子
B.氦元素的近似相对原子质量为3.5
C.23He的相对原子质量为12ba
D.23He的摩尔质量为bNA
9.(2019福建厦门外国语学校高三月考)全氮类物质具有高密度、超高能量及爆炸产物无污染等优点。中国科学家成功合成全氮阴离子N5-,N5-是制备全氮类物质N5+N5-的重要中间体。下列说法不正确的是( )
A.全氮类物质属于绿色能源
B.每个N5+中含有35个质子
C.N5+N5-属于离子化合物
D.N5+N5-结构中含共价键和离子键
11
10.(2019湖南长沙第一中学高三月考)短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是( )
A.元素Y的单质在常温下能与浓硝酸发生反应
B.元素X与氢形成的原子比为1∶1的化合物有很多种
C.元素W、X的氯化物中,各原子均满足8电子的稳定结构
D.元素Z可与元素X形成共价化合物XZ2
11.(2019河北武邑中学高三期末)已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10个电子。它们之间转化关系如下图所示。下列说法正确的是( )
A.原子半径:Z>Y>X
B.稳定性:A>C
C.反应②和③均为吸热反应
D.X、Y、Z可以形成离子化合物
12.(2019福建永安三中)现有部分短周期元素的性质或原子结构如下表:
元素编号
元素性质或原子结构
T
最外层电子数是电子层数的两倍
X
最外层电子数是次外层电子数的2倍
Y
常温下单质为双原子分子,其氢化物水溶液呈碱性
Z
元素的最高正价是+7价
(1)元素X的一种核素可测定文物年代,该核素的原子核内有8个中子,则这种核素的符号是 。
11
(2)元素Y的单质的电子式为 ,元素Y和元素Z可形成一种各原子最外层均为8电子结构的化合物,该化合物的结构式为 。
(3)元素X与元素T相比,非金属性较强的是元素T,下列表述中不能证明这一事实的选项是 。
a.常温下元素X的单质和元素T的单质的熔、沸点不同
b.元素T的氢化物比元素X的氢化物稳定
c.元素X和元素T的单质都能在氧气中燃烧
d.元素T最高价氧化物对应水化物的酸性比元素X最高价氧化物对应水化物的酸性强
e.Na2XO3溶液呈碱性,Na2TO4溶液呈中性
(4)探寻物质的性质差异是学习化学的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中,化学性质明显不同于其他三种酸的是 (用化学式表示)。
13.(2019福建宁德高三质量检测)多硫化物是含多硫离子(Sx2-)的化合物,可用作废水处理剂、硫化剂等。回答下列问题:
(1)多硫化钠(Na2S5)可由H2S与Na2S在一定条件下反应制得,该反应的还原产物为 ,Na2S5中含有的化学键类型是 。
(2)多硫化物MS4溶液在碱性条件下可高效处理高浓度含CN-的电镀废水,CN-被氧化成毒性较小的SCN-,S42-转化为S2-。
①M的离子与S2-具有相同的核外电子排布,则M在周期表中的位置是 。
②CN-的电子式为 。
③处理废水的离子方程式为 。
(3)过硫化铵[(NH4)2S2]可用作硫化试剂,为探究其性质,某研究小组进行如下实验:取含1.00 g(NH4)2S2的溶液加入足量稀硫酸酸化,得到0.32 g淡黄色不溶物A和氢化物B。
①A是 ,生成的B在标准状况的体积为 mL。
②利用(NN4)2S2溶液中的活性硫能将硫锡矿中的难溶物硫化亚锡(Ⅱ)(SnS)氧化成硫代锡(Ⅳ)酸铵[(NH4)2SnS3]而溶解,写出该反应的离子方程式 。
11
拓展深化
14.(2019黑龙江哈尔滨师范大学附中高三期中)A、B、C、D、E是位于短周期的主族元素。已知A、B、C、E在同一周期,在该周期元素中,A的原子半径最大,B的离子半径最小; A与B质子数之和是D质子数的3倍;Cm-、E (m-1)-具有相同的电子层结构;热稳定HmD>HmC。依据上述信息用相应的化学用语回答下列问题:
(1)Hm Dm的电子式为 。
(2)Cm-、E(m-1)-的还原性强弱顺序为 (用离子符号表示),能证明其还原性强弱的离子方程式为 。
(3)B单质与A的最高价氧化物对应水化物在溶液中反应的化学方程式为 。
(4)常温下,将CDm通入Hm C溶液中,有C单质析出,写出该过程的化学方程式:
(5)在A、B、C、E单质中,符合下列转化关系的是 (填元素符号)。
单质化合物1化合物2最高价氧化物对应的水化物
课时规范练14 原子结构与化学键
1.C 40K的质子数是19,中子数是21,40Ca的质子数是20,中子数是20,A项错误;原子最外层只有一个电子的元素不一定是金属元素,如氢元素是非金属元素,B项错误;原子是由原子核和核外电子构成的,原子核由质子和中子(个别原子中不含中子)构成,原子变成离子时变化的是核外电子数,但核内质子数不变,所以任何原子或离子的组成中都含有质子,C项正确;互为同位素的不同核素的核外电子数相同,电子层排布相同,所以化学性质相同,但物理性质不同,D项错误。
2.C 中子数为20的氯原子的质量数为37,可表示为 1737Cl,A错误;二氧化硅中无分子存在,SiO2是其化学式,B错误;硫化氢分子含有2对共用电子对,结构式为H—S—H,C正确;氯化铵是离子化合物。Cl-的电子式错误,正确的应该是[H ··N·· H····HH]+[ ··Cl······]-,D错误。
11
3.C 两种微粒,若核外电子排布完全相同,则化学性质不一定相同,如Na+和O2-,A错误;由单原子形成的离子,不一定具有稀有气体元素原子核外电子排布,如H+,B错误;原子中核外电子数=核内质子数,元素是具有相同质子数的同一类原子,所以两原子核外电子排布相同,则一定属于同一种元素,C正确;单核阴离子的核外电子排布与同一周期稀有气体原子核外电子排布相同,主族金属元素阳离子的核外电子排布一定与上一周期稀有气体原子核外电子排布相同,D错误。
4.C Mg2+、F-均为10电子离子,则离子核外电子排布相同,故A错误;石英为原子晶体,通过硅原子与氧原子形成共价键,熔化时克服的是共价键;硫黄是分子晶体,熔化时克服的是分子间作用力,故B错误;离子化合物的溶解是物理变化,破坏了离子键,则发生物理变化时物质中的化学键也可能被破坏,故C正确;H2O和H2O2两种物质分子中微粒间作用力不完全相同,H2O分子中只有H—O键,H2O2中有H—O键和O—O键,所以稳定性不相同,但稳定性与分子间作用力无关,故D错误。
5.A NaClO中钠离子和次氯酸根离子之间存在离子键、O、Cl原子之间存在共价键,次氯酸钠具有强氧化性而使蛋白质变性,所以可以作消毒剂,A正确;H2O2是共价化合物,只存在共价键,电子式为H··O······O······H,B错误;氨气分子中只含共价键,氨气溶于水生成一水合氨,一水合氨电离生成氢氧根离子而使其水溶液呈弱碱性,在工业上NH3用于制取硝酸,是利用其还原性,与水溶液的碱性无关,C错误;碳酸氢钠是强碱弱酸酸式盐,与Al2(SO4)3中的铝离子发生相互促进的水解反应而生成二氧化碳,可用于泡沫灭火器灭火,与NaHCO3的稳定性强弱无关,D错误。
6.D W的单质与水发生剧烈反应,生成一种酸和一种气体,则W为F,X的一种单质(X4)在常温下容易自燃,则X为P,四种元素为短周期主族元素,且原子序数依次增大,因此Y为S、Z为Cl。X单质状态为固态,Z的单质为气体,因此单质的沸点:X>Z,故A错误;Cl的非金属性强于S,简单离子的还原性S2->Cl-,故B错误;非金属性越强,其气态氢化物的稳定性越强,F的非金属性强于Cl,则最简单氢化物的热稳定性HF>HCl,故C错误;化合物S2Cl2的结构式为Cl—S—S—Cl,含有非极性键,属于共价化合物,故D正确。
7.答案:(1) 第三周期ⅣA族
(2)
(3)H2和CaCO3 Al-3e-+3HCO3-Al(OH)3 + 3CO2↑
11
(4)C、Si位于同一主族,从上到下随核电荷数递增,原子半径逐渐增大,原子核吸引电子的能力逐渐减弱,C、Si之间形成的共用电子对偏向C,所以碳元素显负价
(5)ab (6) Br KX>KY,说明X更易与H2发生化合反应,根据单质与氢气生成氢化物越容易,其非金属性越强可知,非金属性X>Y,而同主族元素从上到下,非金属性逐渐减弱,故Y为Br
解析:(1)硅的质子数为14,在元素周期表中的位置是第三周期ⅣA族。
(2)根据元素在周期表中的位置可知A为Ca、B为F,则化合物W是CaF2,CaF2是离子化合物,其形成过程为:。
(3)以Al作阳极,C作阴极,电解Ca(HCO3)2溶液,阴极上发生的电极反应式为2H2O+2e-2OH-+H2↑,生成的OH-与Ca2+、HCO3-反应生成CaCO3和水,故阴极生成的气体和沉淀分别是H2和CaCO3;阳极上Al失电子生成的Al3+与溶液中的HCO3-发生相互促进的双水解反应,故阳极的电极反应式为Al-3e-+3HCO3-Al(OH)3+3CO2↑。
(4)C、Si位于同一主族,从上到下随核电荷数递增,原子半径逐渐增大,原子核吸引电子的能力逐渐减弱,C、Si之间形成的共用电子对偏向C,所以碳元素显负价。
(5)第六周期的0族元素的原子序数是86,第七周期所容纳的元素种数为32,则第七周期0族元素的原子序数为118,故Og元素位于元素周期表中第七周期0族,a正确;Og原子的质子数为118,根据电中性原子中质子数=核外电子数可知,Og原子的核外有118个电子,b正确;0族元素性质稳定,不易得到电子,故同周期中非金属最强的应为117号元素,c错误;Og元素中子数为179的核素符号应为 118297Og,d错误。
(6)由X在元素周期表中的位置可知,X为Cl,而KX>KY,说明X更易与H2发生化合反应,根据单质与氢气生成氢化物越容易,其非金属性越强可知,非金属性X>Y,而同主族从上到下,元素非金属性逐渐减弱,故Y为Br。
8.C 23He比 24He少一个中子,A错误;不能确定核素的原子百分含量,因此不能计算氦元素的近似相对原子质量,B错误;一个原子的真实质量与一个 162C原子质量的112的比值是该核素的相对原子质量,因此 23He的相对原子质量为12ba,C正确;23He的摩尔质量为bNAg·mol-1,D错误。
11
9.C 全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,属于绿色能源,A正确;每个N5+中含有5×7=35个质子,B正确;该物质由氮元素组成,属于单质,不是化合物,故C错误;N5+和N5-之间是离子键,N5+和N5-离子内都是非极性共价键,D正确。
10.C 因X原子的最外层电子数是内层电子数的2倍,则X是碳元素,Y是地壳中含量最丰富的金属元素,Y为铝元素,Z原子的最外层电子数是其电子层数的2倍,Z是短周期元素,且W、X、Y和Z的原子序数依次增大,则Z为硫元素,W是制备一种高效电池的重要材料,则W是锂元素。元素Y为Al,常温下能与浓硝酸发生钝化反应,故A正确;元素X与氢形成的化合物有C2H2、C6H6等,故B正确;W、X的氯化物分别为LiCl和CCl4,则Li+的最外层只有两个电子,不满足8电子的稳定结构,故C错误;元素Z可与元素X形成共价化合物CS2,故D正确。
11.C 短周期元素中形成的10个电子的化合物主要有CH4、NH3、H2O、HF等几种,根据图中的转化关系可以推出X、Y、Z分别为H、C、O三种元素,甲、乙、丙分别为氢气、碳、氧气,A、B、C、D分别为CH4、CO2、H2O、CO。H、C、O三种元素原子半径:C>O>H,A不正确;氧元素的非金属性强于碳,所以稳定性H2O>CH4,B不正确;反应②碳和二氧化碳在高温下生成一氧化碳的反应是吸热反应,反应③水蒸气和碳在高温下反应生成氢气和一氧化碳是吸热反应,所以C正确;H、C、O三种非金属元素只能形成共价化合物,不能形成离子化合物,D不正确。
12.答案:(1) 614C (2)··N︙︙N·· (3)ac (4)H2CO3
解析:(1)元素X为C,其有一种核素可测定文物年代,其原子核内有8个中子,则这种核素的符号是 614C。
(2)元素Y的单质N2的电子式为 ··N︙︙N··,元素Y和元素Z可形成一种各原子最外层均为8电子结构的化合物,该化合物为NCl3,其结构式为。
11
(3)常温下元素X的单质和元素T的单质的熔、沸点不同,单质熔、沸点高低与元素非金属性强弱无关,故a不能证明;元素的非金属性越强,其气态氢化物越稳定,元素T的氢化物比元素X的氢化物稳定,则T的非金属性强于X,故b能证明;元素X和元素T的单质都能在氧气中燃烧,无法比较其得电子的难易,故c不能证明;最高价氧化物对应水化物的酸性越强,元素的非金属性越强,元素T最高价氧化物对应水化物的酸性比元素X最高价氧化物对应水化物的酸性强,说明元素的非金属性硫更强,故a能证明;Na2XO3溶液呈碱性,Na2TO4溶液呈中性,说明碳酸酸性比硫酸弱,则碳的非金属性弱于硫,故e能证明。
(4)T、X、Y、Z四种元素的最高价氧化物对应的水化物中,化学性质明显不同于其他三种酸的是H2CO3,碳酸是弱酸,其余都是强酸。
13.答案:(1)H2 离子键、共价键 (2)①第四周期ⅡA族
②[··C︙︙N··]- ③S42-+3CN-S2-+3SCN- (3)①S(或硫) 224 ②S22-+SnSSnS32-
解析:(1)H2S与Na2S在一定条件下反应生成多硫化钠(Na2S5)和氢气,根据氧化还原反应原理可知,反应的化学方程式为4H2S+Na2SNa2S5+4H2↑,其中氢元素由+1价变为0价被还原生成氢气,故该反应的还原产物为H2。活泼金属元素与活泼非金属元素易形成离子键,非金属元素之间易形成共价键,可见Na2S5中钠离子与S52-之间存在离子键,S原子之间存在共价键,故含有的化学键类型是离子键和共价键。
(2)①M的离子与S2-具有相同的核外电子排布,均为18电子结构,则M的离子为钙离子,钙元素在周期表中的位置是第四周期ⅡA族。②CN-中碳原子和氮原子均达8电子结构,故其电子式为[··C︙︙N··]-。③处理废水是S42-与CN-反应生成S2-和SCN-,反应的离子方程式为S42-+3CN-S2-+3SCN-。
(3)过硫化铵[(NH4)2S2]与稀硫酸反应生成淡黄色不溶物(硫)、氢化物(硫化氢)和硫酸铵,发生反应的化学方程式为(NH4)2S2+H2SO4(NH4)2SO4+S↓+H2S↑。①A是S(或硫),生成的氢化物B的物质的量n(H2S)=n(S)=0.32g32g·mol-1=0.01mol,在标准状况的体积为0.01mol×22.4L·mol-1=0.224L=224mL。②利用(NN4)2S2溶液中的活性硫能将硫锡矿中的难溶物硫化亚锡(Ⅱ)(SnS)氧化成硫代锡(Ⅳ)酸铵[(NH4)2SnS3]而溶解,反应的离子方程式为S22-+SnSSnS32-。
14.答案:(1)H··O······O······H (2)S2->Cl- Cl2+S2-S↓+2Cl-
(3)2Al+2NaOH+2H2O2NaAlO2+3H2↑ (4)SO2+2H2S3S↓+2H2O (5)Na和S
解析:已知A、B、C、E在同一周期且属于短周期,所属周期只能是第二或第三周期,又因为热稳定性HmD>Hm
11
C,从氢化物化学式可知D和C属于同一族,且D的非金属性强,D的原子序数小,因此D处于第二周期,A、B、C、E处于第三周期。因为A的原子半径在同周期中最大,所以A是钠元素,又因B的离子半径在同周期中最小,故B是铝元素,则D的原子序数=11+133=8,D是氧元素,C是硫元素。从C、E离子的形式[Cm-、E(m-1)-]可以看出,E最外层比C的最外层多1个电子,所以E是氯元素。
(1)因为D是氧元素,则HmDm是H2O2,H2O2分子中相邻原子间都以共价键结合,其电子式为H··O······O······H。
(2)Cm-、E(m-1)-分别是S2-、Cl-,元素的非金属越强,原子核对外层电子吸引力越强,所以阴离子的还原性就越弱,已知非金属性Cl>S,所以还原性Cl-
相关文档
- 2021高考化学一轮复习课时规范练72021-08-068页
- 2020版高考化学复习课时规范练 (222021-08-067页
- 2021高考化学一轮复习课时规范练82021-08-068页
- 2021高考化学一轮复习课时规范练232021-08-068页
- 2020版高考化学复习课时规范练 (5)2021-08-068页
- 2020版高考化学复习课时规范练 (3)2021-08-067页
- 2021高考化学一轮复习课时规范练152021-08-068页
- 2021高考化学一轮复习课时规范练322021-08-069页
- 广东省2021版高考化学一轮复习课时2021-08-069页
- 广东省2021版高考化学一轮复习课时2021-08-069页