- 445.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
影响化学反应速率的因素
【学习目标】
1、了解活化能的含义及其对化学反应速率的影响;
2、通过实验探究浓度、压强、温度和催化剂对化学反应速率的影响,认识其一般规律;
3、认识化学反应速率的调控在生活、生产和科学研究领域中的重要作用。
【要点梳理】
要点一、影响化学反应速率的因素
参加反应的物质的性质和反应的历程,是决定化学反应速率的主要因素。
对于同一化学反应,外界条件不同,反应速率也不同,其中重要的外界条件为浓度、压强、温度、催化剂等。有效碰撞理论能较好地解释浓度、压强、温度、催化剂等外界条件对化学反应速率的影响。
1、浓度对化学反应速率的影响
①重要结论:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
②理论解释:在其他条件不变时,对某一反应来说,活化分子在反应物分子中所占的百分数是一定的。增大反应物的浓度→活化分子数增多→有效碰撞次数增多→化学反应速率增大。因此,增大反应物的浓度可以增大化学反应速率。
③几点注意:
a.对于纯液体或固体物质,可认为其浓度为“常数”,它们的量的改变不会影响化学反应速率。
b.固体反应物颗粒的大小能影响化学反应速率。固体颗粒越小,其表面积越大,与其他反应物的接触面积越大,有效碰撞次数越多,所以能增大化学反应速率。
2、压强对化学反应速率的影响
①重要结论:对于有气体参加的化学反应来说,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
②理论解释:在其他条件不变时,增大压强,就是增大了反应物浓度→单位体积内活化分子数增多→有效碰撞次数增多→化学反应速率增大。因此,增大压强,可以增大化学反应速率。
③几点注意:
a.在讨论压强对反应速率的影响时,应区分引起压强改变的原因。对于气体反应体系,有以下几种情况:
Ⅰ.恒温时:增加压强体积缩小浓度增大反应速率增大
Ⅱ.恒容时:充入气体反应物总压增大浓度增大反应速率增大
充入“惰性气体”后总压强增大,各反应物质浓度不变,反应速率不变
Ⅲ.恒压时:充入“惰性气体”体积增大各反应物浓度减小反应速率减小
b.由于压强的变化对固体、液体或溶液的体积影响很小,因而对它们浓度改变的影响也很小,可以认为改变压强对它们的反应速率无影响。
3、温度对化学反应速率的影响
①重要结论:当其他条件不变时,升高温度,可以增大化学反应速率;降低温度,可以减小化学反应速率。
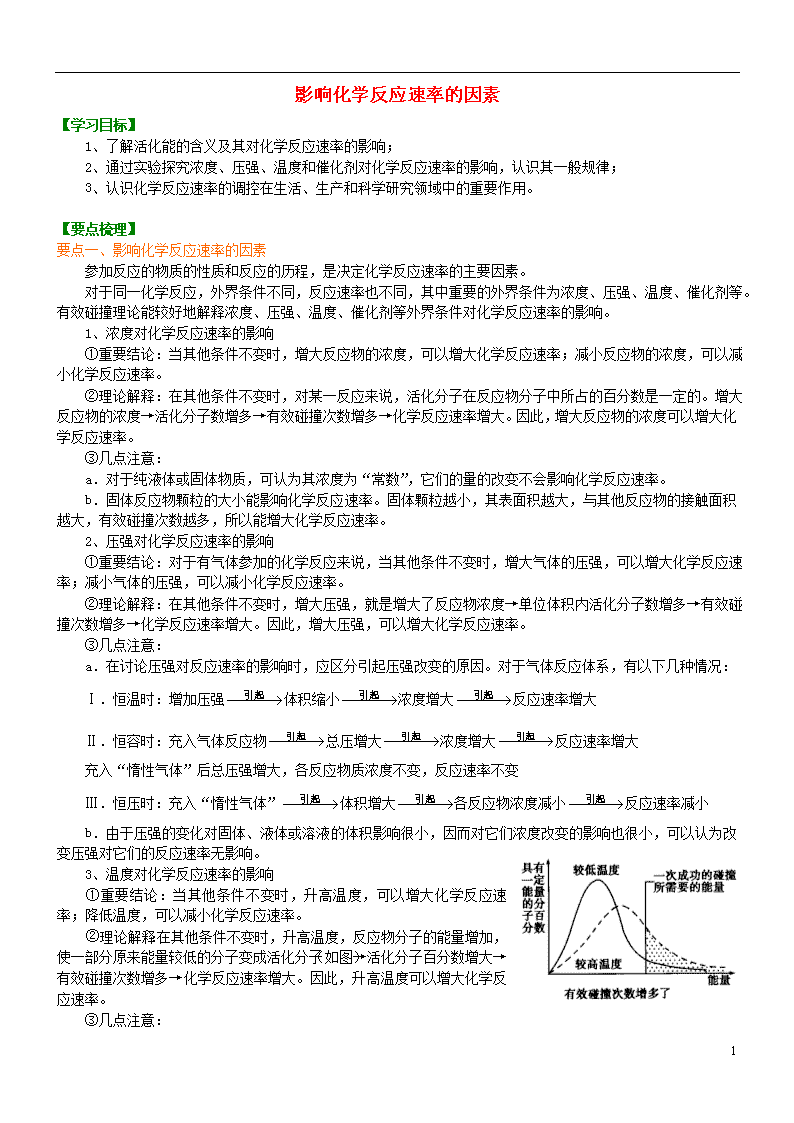
②理论解释:在其他条件不变时,升高温度,反应物分子的能量增加,使一部分原来能量较低的分子变成活化分子(如图)→活化分子百分数增大→有效碰撞次数增多→化学反应速率增大。因此,升高温度可以增大化学反应速率。
③几点注意:
7
a.实验测得:温度每升高10℃,化学反应速率通常增大到原来的2~4倍。
b.上述结论,对吸热反应和放热反应均适用。
c.一般地,温度对化学反应速率的影响比浓度、压强对化学反应速率的影响要大,也更易于控制,是实验室最常用的增大化学反应速率的方法。
4、催化剂对化学反应速率的影响
①重要结论:催化剂能够改变化学反应速率。能加快化学反应速率的催化剂叫正催化剂,能减慢化学反应速率的催化剂叫负催化剂。在实际应用中,如不特别说明,凡是说催化剂都是指正催化剂。
②理论解释:使用催化剂一降低反应所需的活化能(如图)→更多的反应物分子成为活化分子→大大增大单位体积内的活化分子百分数→成倍地增大化学反应速率。
③几点注意:
a.使用催化剂能同等程度地改变(加快或减慢)正逆化学反应速率。
b.约85%的化学反应需要使用催化剂,在使用催化剂时应防止催化剂中毒。
5、影响化学反应速率的其他外界条件
影响化学反应速率的外界条件除浓度、压强、温度、催化剂外,还有很多其他因素,如光辐射、放射线辐射、超声波、电弧、激光、强磁场、反应物颗粒大小、溶剂等。总之,向反应体系输入能量,都有可能改变化学反应速率。
要点二、外界条件对化学反应速率的影响规律
条件变化
活化分子的量的变化
速率变化
浓度
增大
单位体积内总数目增多,百分数不变
增大
减小
单位体积内总数目减小,百分数不变
减小
压强
增大
单位体积内总数目增多,百分数不变
增大
减小
单位体积内总数目减小,百分数不变
减小
温度
升高
百分数增大,单位体积内总数目增多
增大
降低
百分数减小,单位体积内总数目减少
减小
催化剂
使用
百分数剧增,单位体积内总数目剧增
剧增
撤去
百分数剧减,单位体积内总数目剧减
剧减
其他
光、电磁波、超声波、反应物颗粒的大小、溶剂等
有影响
【巧记】加快化学反应速率的方法记忆口诀:
要想反应速率快,升温加压增浓度;催化增大表面积,反应也可加速度。
要点三、外界条件对可逆反应中正逆反应速率的影响
对于可逆反应来说,由反应物生成生成物的反应速率叫正反应速率;同时还进行着生成物之间相互反应生成反应物的逆反应,由生成物生成反应物的反应速率叫逆反应速率。用单位时间内反应物浓度的减小或生成物浓度的增大来表示正反应速率;用单位时间内反应物浓度的增大或生成物浓度的减小来表示逆反应速率。如:
N2+3H22NH3(正反应放热)
各种外界条件对上述反应v正、v逆的影响分别是:
1、增大反应物(N2或H2)浓度,v正增大,v逆随之增大;增大生成物(NH3)浓度,v逆增大,v正也随之增大;减小反应物(N2或H2)浓度,v正减小,v逆随之减小;减小生成物(NH3)浓度,v逆减小,v正也随之减小。
2、升高温度,v正和v逆均增大,放热反应方向的速率v正不如吸热反应方向的速率v逆增大的倍数大;同理,降低温度,放热方向的v正减小的倍数小,吸热方向的v逆减小的倍数大。
3、增大压强,v正和v逆均增大,但v正(气体分子数由多到少的方向)增大得多,v逆
7
(气体分子数由少到多的方向)增大得少;减小压强,v正和v逆均减小,且v逆(气体分子数由少到多的方向)减小得少,v正(气体分子数由多到少的方向)减小得多。
对于反应前后气体分子数相同的反应,加压时,v正和v逆同等倍数地增大;减压时,v正和v逆等倍数地减小。
4、催化剂对可逆反应速率的影响是同等倍数地增大或减小。
对于一个可逆反应,当v正>v逆时,反应向正反应方向进行,即反应的总速率v=v正-v逆;当v逆>v正时,反应向逆反应方向进行,即反应的总速率v= v逆-v正。
要点四、有关化学反应速率的图像
化学反应速率图像是将化学反应速率变化的情况在直角坐标系中以图的形式表达的结果,是化学反应速率变化规律的反映。在认识和应用化学反应速率图像时,要立足于化学反应方程式,应用化学反应速率变化的规律,分析直角坐标系及其图像的含义。
1、图像类型
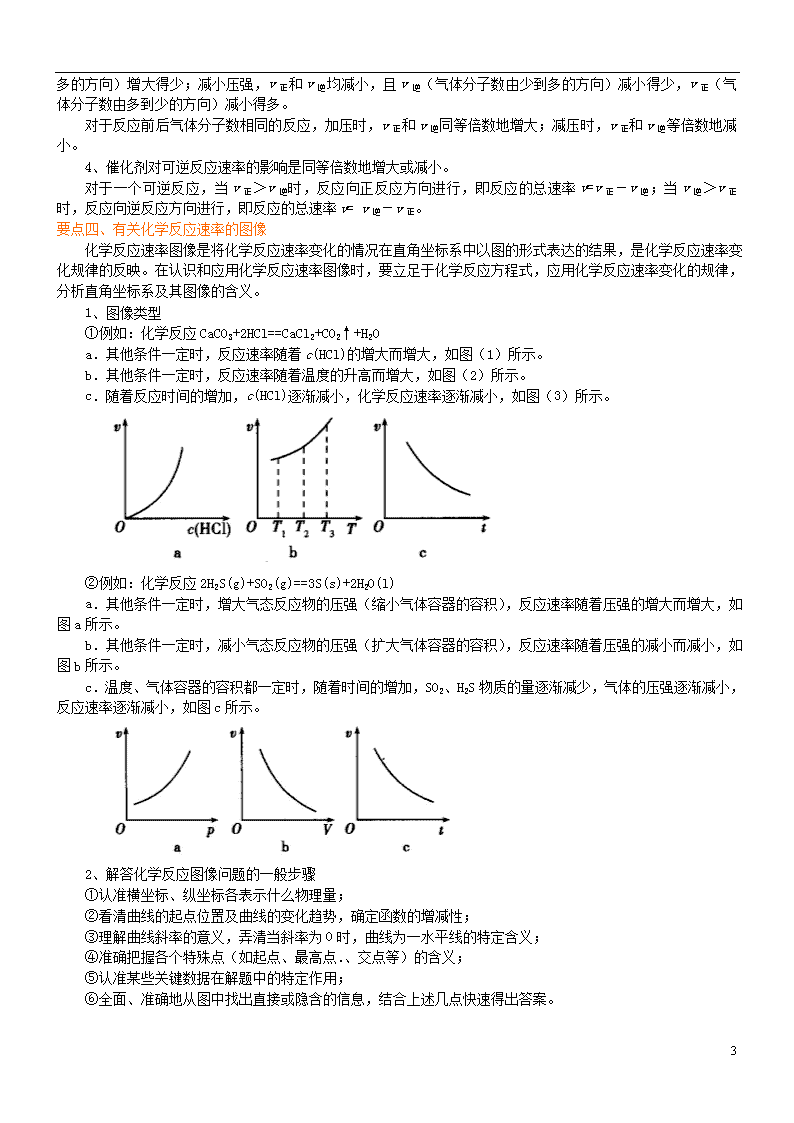
①例如:化学反应CaCO3+2HCl==CaCl2+CO2↑+H2O
a.其他条件一定时,反应速率随着c(HCl)的增大而增大,如图(1)所示。
b.其他条件一定时,反应速率随着温度的升高而增大,如图(2)所示。
c.随着反应时间的增加,c(HCl)逐渐减小,化学反应速率逐渐减小,如图(3)所示。
②例如:化学反应2H2S(g)+SO2(g)==3S(s)+2H2O(l)
a.其他条件一定时,增大气态反应物的压强(缩小气体容器的容积),反应速率随着压强的增大而增大,如图a所示。
b.其他条件一定时,减小气态反应物的压强(扩大气体容器的容积),反应速率随着压强的减小而减小,如图b所示。
c.温度、气体容器的容积都一定时,随着时间的增加,SO2、H2S物质的量逐渐减少,气体的压强逐渐减小,反应速率逐渐减小,如图c所示。
2、解答化学反应图像问题的一般步骤
①认准横坐标、纵坐标各表示什么物理量;
②看清曲线的起点位置及曲线的变化趋势,确定函数的增减性;
③理解曲线斜率的意义,弄清当斜率为0时,曲线为一水平线的特定含义;
④准确把握各个特殊点(如起点、最高点.、交点等)的含义;
⑤认准某些关键数据在解题中的特定作用;
⑥全面、准确地从图中找出直接或隐含的信息,结合上述几点快速得出答案。
7
【典型例题】
类型一、浓度和压强对化学反应速率的影响
例题1 反应C(s)+H2O(g)CO(g)+H2(g)在一容积可变的密闭容器中进行,则下列反应条件的改变对反应速率几乎无影响的是( )
A.增加C的量 B.将容器的容积缩小一半
C.保持容积不变,充入N2 D.保持压强不变,充入N2
【思路点拨】本题考查影响化学反应速率的因素中的浓度以及压强因素。需要注意的是,对于固体物质,一般不考虑其浓度变化,所以,通常认为加入固体物质不影响反应速率;另外还需要注意充入与反应无关类的气体时的影响。
【答案】AC
【解析】C为固态反应物,增加其用量对反应速率几乎没有影响;容器容积缩小一半相当于压强增大一倍,气体混合物的浓度增大,正、逆反应速率均增大;若保持容积不变,充入N2,体系总压强增大,但反应混合物的浓度并未改变,反应速率基本不变;若保持压强不变,充入N2,使容器容积增大,反应混合物的浓度将同等程度变小,正、逆反应速率均减小。
【总结升华】解答影响速率因素类的题目时,首先要明确有哪些因素会影响到反应速率,其次要明确这些因素是如何影响速率的,只要准确、牢固把握这些知识,才能快速解答此类题目。
举一反三:
【变式1】在一定温度下,A、B能在溶液中发生反应生成C和D:A+B==C+D。
a.将0.2 mol/L A溶液和0.2 moL/L B溶液各20 mL混合;
b.将0.5 mol/L A溶液和0.5 moL/L B溶液各50 mL混合;
c.将1 mol/L A溶液和l mol/L B溶液各10 mL混合,同时倒入30 mL蒸馏水;
d.将1 moL/L A溶液20 mL和1.2 mol/L B溶液60 mL混合。
反应开始时,反应速率由大到小的顺序是________。
【答案】d>b>c>a
【解析】本题需先把每种情况下混合溶液中A、B的起始浓度求出来,然后根据其浓度大小来比较化学反应速率的大小。
混合后各物质的起始浓度(mol/L)为:
a
b
c
d
A
0.1
0.25
0.2
0.25
B
0.1
0.25
0.2
0.9
混合后浓度最大的是d,其次是b,最小的是a,所以反应开始时,反应速率由大到小的顺序为d>b>c>a。
类型二、温度和催化剂对反应速率的影响
例题2 20℃时,将0.10 mol/L Na2S2O3溶液10 mL和0.10 mol/L H2SO4溶液10 mL混合,2 min后溶液中明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那么50℃时,同样的反应要明显出现浑浊,所需的时间是( )
A.40 s B.15 s C.48 s D.20 s
【思路点拨】本题考查温度对化学反应速率的影响。但本题不是简单分析速率的变化,而且明确速率变化的倍数关系,需要同学们结合所学的数学知识解答。
【答案】B
【解析】设原来的反应速率为v,温度从20℃升高到50℃,共升高了3个10℃,所以50℃时的反应速率为23v。反应速率越大,则反应出现浑浊所需的时间越短。所以50℃时,此反应出现浑浊所需的时间为:2 min×=0.25 min=15 s。
7
【总结升华】在影响化学反应速率的各因素中,温度的变化在决定反应速率的变化时起较大影响。并且很多化学反应也是通过改变温度来调节化学反应速率的。
例题3 下列说法正确的是( )
A.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使有效碰撞次数增多
B.有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大
C.升高温度能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数
D.催化剂能增大单位体积内活化分子的百分数,从而成倍地增大反应速率
【思路点拨】本题综合考查影响化学反应速率的因素。需要结合教材前言部分的内容,即活化分子、活化能等。
【答案】CD
【解析】浓度和压强的变化改变了单位体积内的分子总数,活化分子的百分数不变,单位体积内活化分子的数目发生变化,从而化学反应速率改变;温度和催化剂改变了活化分子的百分数,单位体积内的分子总数不变,单位体积内活化分子的数目发生变化,从而化学反应速率改变。
【总结升华】本题中所涉及的各种影响因素,都属于最本质的知识点,避开了常规考查,学生通过对这些选项的分析可以更好的掌握影响化学反应速率的主要外界因素。
举一反三:
【变式1】在一定温度时,N2与H2反应过程中能量变化的曲线如图所示。则下列叙述正确的是( )
A.该反应的热化学方程式为:N2+3H32NH3+92 kJ
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应放出的热量增多
D.加入催化剂可增大正反应速率,降低逆反应速率
【答案】B
【解析】A项没有标明各物质的状态,反应热的表示形式也有错误;C项加催化剂不影响化学反应的反应热;D项加入催化剂即可增大正反应速率,也可增大逆反应速率。
【变式2】在一定条件下,若单独改变可逆反应N2+3H22NH3(正反应放热)的下列条件后,则相关的叙述错误的是( )
A.加入催化剂,v正、v逆都发生变化,且变化的倍数相等
B.增大压强,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
C.降低温度,v正、v逆都减小,且v正减小的倍数大于v逆减小的倍数
D.加入氩气,v正、v逆都增大,且v正增大的倍数大于v逆增大的倍数
【答案】CD
【解析】催化剂能同等倍数地改变正、逆反应速率;增大压强,v正、v逆都增大,但气体化学计量数之和较大的一侧增大的倍数大于气体化学计量数之和较小的一侧增大的倍数;降低温度,v正、v逆都减小,但吸热方向减小的倍数大于放热方向减小的倍数,如本题中应是v逆减小的倍数大于v正减小的倍数;加入氩气,若是恒温、恒容,则v正、v逆均不变,若是恒温、恒压,则相当于减小原体系的压强,v正、v逆均减小。
类型三、化学反应速率的图像
例题4 向含有H2SO4的H2O2溶液中滴加定量的KMnO4溶液,反应开始时,溶液中Mn2+的浓度c将随时间的变化而变化。某学生在做实验前认为,Mn2+的浓度c与时间的关系如图①
7
所示,做完实验后得到的结果如图②所示。请回答下列问题:
(1)写出H2O2与KMnO4溶液反应的化学方程式。
(2)Oa段的意义。
(3)ab段的意义及ab段很陡的原因。
(4)bc段的意义。
【思路点拨】本题是考查影响化学反应速率的“浓度-时间”类的图像题,注意在本题中除了考虑浓度对速率的影响之外,还需要注意催化剂的影响。
【答案】(1)5H2O2+2KMnO4+3H2SO4==K2SO4+2MnSO4+8H2O+5O2↑。
(2)Oa段说明反应非常慢,溶液中c(Mn2+)随时间变化很小。
(3)ab段说明反应非常快,c(Mn2+)迅速增大,表明Mn2+达到一定浓度时,对上述反应起到了催化作用。
(4)bc段说明反应趋于完全,溶液中c(Mn2+)为定值。
【解析】ab段斜率最大,说明化学反应速率最大,其原因应为Mn2+浓度增大充当了该反应的催化剂。
【总结升华】解答图像类题目时,注意认清纵坐标、横坐标的含义以及图像的各个拐点的形成原因,再运用所学的知识用化学用语解释题目中的问题。
例题5 将m g块状碳酸钙与足量盐酸反应,固体反应物损失的质量随时间的变化关系曲线如图中实线所示,在相同条件下,将n g(m>n)粉末状碳酸钙与同浓度的盐酸反应,则相应的关系曲线(图中虚线所示)表示正确的是( )
【答案】C
【解析】粉末状碳酸钙比块状碳酸钙与同浓度的盐酸反应速率快,即单位时间内损失的CaCO3的质量大,由此可排除A、B项。由于m>n,且粉末状CaCO3的消耗速率大于块状CaCO3的消耗速率,故当粉末状CaCO3完全消耗时,块状CaCO3仍有剩余,故只有C项符合题意。
举一反三:
【高清课堂:化学反应的调频师-化学反应的影响速率】
【变式1】把除去氧化膜的镁条放入盛有一定浓度的稀盐酸的试管中,发现H2的生成速率v随时间t的变化关系曲线如图所示。其中O~t1段影响速率变化的主要因素是________;t1~t2段影响速率变化的主要因素是________。
【答案】此反应是放热反应,放出的热能使温度升高,所以反应速率加快。随着反应的进行,c(H+)减小,反应速率逐渐减慢
【解析】根据影响化学反应速率的因素可知,镁与盐酸反应时,反应物的性质已定,应从外因考虑,又知压强不变且无催化剂,因而,影响此反应速率的主要因素是盐酸的浓度和反应的温度。
在整个反应过程中,O~t1反应速率由慢到快,这是因为此反应是放热反应,放出的热能使反应体系温度升高,这段时间内温度对反应速率的影响起决定作用。反应使c(H+)减小,当c(H+)减小到一定程度后浓度对反应速率的影响占优势,所以t1~t2反应速率由快到慢。
【变式2】 一定条件下可逆反应X(s)+Y(g)W(g)+Z(g)(正反应是放热反应),在一体积不变的容器中反应达到平衡后,改变反应条件、反应速率(v)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是( )
A.增加了X的物质的量 B.降低了温度
7
C.增大了压强 D.增加了Y的物质的量
【答案】D
【解析】X是固体物质,其浓度可视为常数,增加X的物质的量,反应速率不变化,A错。降低温度时,v(正)与v(逆)都减小,B错。增大压强时,v(正)和v(逆)会同时增大,但v(逆)增大的程度大于v(正)增大的程度,C错。增加反应物Y的物质的量,v(正)会突然增大,而v(逆)在原平衡的基础上逐渐增大,D正确。
【变式3】把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间关系可用如图所示的曲线来表示,请回答下列问题:
(1)曲线O→a段不产生氢气的原因是________,有关的化学方程式为________。
(2)曲线a→c段,产生氢气的速率逐渐增大的主要原因是________________。
(3)曲线由c以后,产生氢气的速率逐渐减小的主要原因是________________。
【答案】(1)久置的铝片表面覆有一层氧化铝薄膜 Al2O3+3H2SO4==Al2(SO4)3+3H2O
(2)该反应是放热反应,温度升高,化学反应速率增大
(3)硫酸的浓度减小,化学反应速率逐渐减小
【解析】(1)在空气中久置的铝片表面有一层氧化铝薄膜,因此硫酸首先和氧化铝反应,不产生氢气;(2)a→c段,虽然硫酸的浓度减小,但该反应是放热反应,体系温度升高,故化学反应速率增大;(3)曲线由c以后,硫酸的浓度逐渐减小,成为影响化学反应速率的主要因素,因此化学反应速率逐渐减小。
7
相关文档
- 【推荐】第06周 影响化学反应速率2021-08-0612页
- 2020高中化学 影响化学反应速率的2021-08-064页
- 化学第二章化学反应速率和化学平衡2021-08-065页
- 2020高中化学 影响化学反应速率的2021-08-065页
- 高中化学 2_2《影响化学反应速率的2021-07-0948页
- 高考化学第一轮复习课件第1讲 化2021-07-095页
- 2020_2021学年高中化学第二章化学2021-07-088页
- 2020届浙江学考一轮复习考点精讲通2021-07-085页
- 高中化学第二章化学反应速率和化学2021-07-082页
- 2020-2021学年化学苏教版选修4课时2021-07-084页