- 226.00 KB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019-2020学年四川省凉山州高一上学期第三次月考化学试卷
化学试题
满分:100 分 考试时间:90 分钟
同温同压下 X 与 Y 两气体的密度之比为 n∶m
等质量气体 X 与 Y 所含分子数之比为 n∶m D.同温同压下,等体积的 X 与 Y 质量比为 m∶n
6.若阿伏加德罗常数的数值用 NA 表示,下列说法正确的是( )
A.1.6gNH — 离子所含质子数为 N
答题前填写好自己的姓名、班级、考号等信息
请将答案正确填写在答题卡上
可能用到的相对原子质量:H:1 O:16 Na:23 Al:27 C:12 N:14 S:32 Cu:64 Ba:137 Cl:35.5 K:39
第 I 卷(选择题)
一、选择题(共 16 小题,每小题 3 分,满分 48 分,每小题只有一个选项符合题目要求)
我们日常生活中出现了“加碘食盐”、“增铁酱油”、“富硒茶叶”和“含氟牙膏”等商品。这里的碘、铁、硒、氟应理解为( )
A.元素 B.单质 C.分子 D.氧化物
下列变化不涉及氧化还原反应的是( )
A.食物的腐败 B.金属的冶炼 C.铁质菜刀生锈 D.钟乳石的形成3.下列说法正确的是( )
物质的相对分子质量就是该物质的摩尔质量
两个等容容器,一个盛一氧化氮,另一个盛 N2、H2 混合气,同温同压下两容器内气体分子总数一定相同,原子总数也相同
将 98gH2SO4 溶于 500mL 水中所得到溶液中硫酸的物质的量浓度为 2mol/L D.发生化学反应时失电子越多的金属原子,还原能力越强
分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A.既有单质参加又有单质生成的反应一定是氧化还原反应B.含有不同种元素的纯净物叫做化合物
C.导电能力强的一定是强电解质,难溶于水的一定是弱电解质 D.碱性氧化物一定是金属氧化物,酸性氧化物一定是非金属氧化物
标准状况下,m g 气体 X 和 n g 气体 Y 所含分子数相同,以下说法错误的是( )
A.X 与 Y 两气体的相对分子质量之比为 m∶n
B.常温常压下,200g8.5%的 H2O2 溶液中含氧原子数为 NA
C.7.8gNa2O2 晶体中所含离子总数为 0.4NA
D.在反应 KIO3+6HI=KI+3I2+3H2O 中,每生成 3molI2 转移的电子数为 5NA 7.下列离子在指定溶液中一定大量共存的是( )
4 3
A.加入铝粉能产生氢气的溶液:NH +、HCO -、K+、Br-
B.c(KNO3)=1.0mol/L 溶液中:H+、Fe2+、Cl-、SO 2- C.能使酚酞变红的溶液中:Na+、Cl-、Cu2+、NO - D.c(H+)=0.1mol/L 溶液中:Cl-、Al3+、NH +、Na+ 8.下列离子方程式正确的是( )
4 4 3
A.向明矾溶液中逐滴滴入 Ba(OH)2 溶液,至沉淀质量最大时反应为: 2Al3++3SO 2﹣+3Ba2++6OH﹣═3BaSO ↓+2Al(OH) ↓
B.氯化铁溶液腐蚀铜电路板:Cu+Fe3+═Fe2+ +Cu2+
2 2 2
2 2 2 2
已知:2Br﹣+Cl =2Cl﹣+Br ,Br +2Fe2+=2Fe3++2Br﹣,向含 0.2molFeBr 的溶液中通入标准状况下 3.36LCl 时,发生的反应为:4Fe2++2Br﹣+3Cl ═4Fe3++Br +6Cl﹣
4 2 4 2 4
向 NaHSO 中滴入 Ba(OH) 溶液至恰好显中性:H++SO 2﹣+Ba2++OH﹣═H O+BaSO ↓
通过海水晾晒可以得到粗盐,粗盐除还有 NaCl 外,还含有 MgCl2、 CaCl2、 Na2SO4 以及泥沙等杂质。以下是某兴趣小组制备精盐的实验方案,各步操作流程如下。下列说法正确的是( )
A.实验过程中②、④步骤互换,对实验结果不影响B.实验过程中步骤④的目的是仅除去溶液中的 Ca2+
实验过程中步骤⑦中的蒸发所用到的仪器是酒精灯、玻璃棒、烧杯、铁架台(带铁圈)
实验过程中①、⑤步骤的操作分别是溶解、过滤
科学家开发出一种低成本光伏材料—蜂窝状石墨烯。
一定条件
D.H C O 与酸性 KMnO 溶液反应的离子方程式为:5H C O +2MnO -+6H+=2Mn2++10CO ↑+8H O
2 2 4 4 2 2 4 4 2 2
将含 amol 金属钠和 bmol 金属铝的合金投入 mg 足量水中,完全溶解,无金属剩余所得溶液密度为
dg•cm﹣3,下列相关计算式子中错误的是( )
生产原理是 Na2O+2CO
列说法不正确的是( )
Na2CO3+C(石墨烯),然后除去 Na2CO3,即可制得蜂窝状石墨烯。下
NaOH 的物质的量:(a﹣b)mol
100bd
NaAlO2 的物质的量浓度:
22a+24b+mmol/L
该生产石墨烯的反应属于氧化还原反应
石墨烯与金刚石互为同素异形体
标况下生成 H2 的体积:22.4(a+3b)
L2
Na2O 属于碱性氧化物,CO 属于酸性氧化物,Na2CO3 属于盐
自然界中钠元素以化合态形式存在
工业上常用 NaHSO3 处理含 Cr2O7 的废液,反应的离子方程式为:
2 7 3 4 2
5H++Cr O 2-+3HSO -=2Cr3++3SO 2-+4H O 下列判断错误的是( )
A.氧化产物是 SO 2- B.氧化剂与还原剂的物质的量之比是 1:3
2 7 2 7
C.Cr O 2-表现了氧化性 D.还原 1molCr O 2-,电子转移 3mol
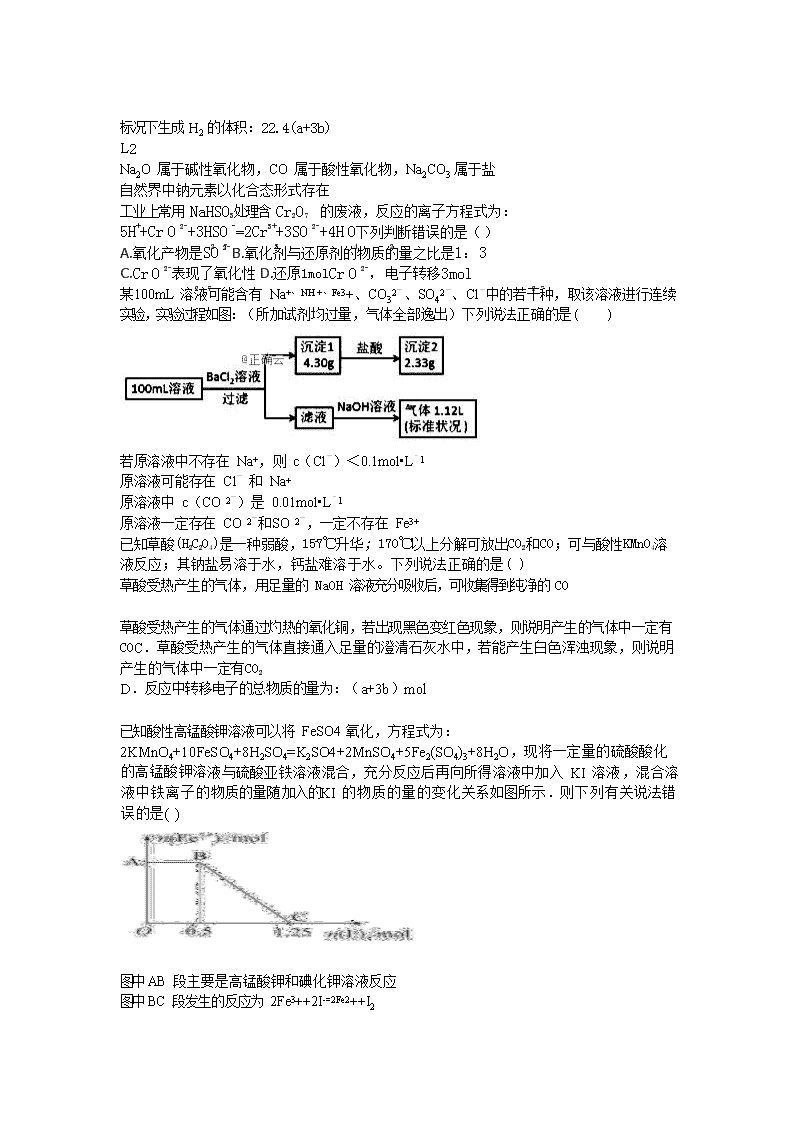
某 100mL 溶液可能含有 Na+、NH +、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是( )
若原溶液中不存在 Na+,则 c(Cl-)<0.1mol•L﹣1
原溶液可能存在 Cl- 和 Na+
原溶液中 c(CO 2-)是 0.01mol•L﹣1
3 4
原溶液一定存在 CO 2-和 SO 2-,一定不存在 Fe3+
已知草酸(H2C2O4)是一种弱酸,157℃升华,170℃以上分解可放出 CO2 和 CO;可与酸性 KMnO4 溶液反应;其钠盐易溶于水,钙盐难溶于水。下列说法正确的是( )
草酸受热产生的气体,用足量的 NaOH 溶液充分吸收后,可收集得到纯净的 CO
草酸受热产生的气体通过灼热的氧化铜,若出现黑色变红色现象,则说明产生的气体中一定有 CO C.草酸受热产生的气体直接通入足量的澄清石灰水中,若能产生白色浑浊现象,则说明产生的气体中一定有 CO2
D.反应中转移电子的总物质的量为:(a+3b)mol
已知酸性高锰酸钾溶液可以将 FeSO4 氧化,方程式为:
2KMnO4+10FeSO4+8H2SO4=K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入 KI 溶液,混合溶液中铁离子的物质的量随加入的 KI 的物质的量的变化关系如图所示.则下列有关说法错误的是( )
图中 AB 段主要是高锰酸钾和碘化钾溶液反应
图中 BC 段发生的反应为 2Fe3++2I-=2Fe2++I2
根据 OC 段的数据可知开始加入的硫酸亚铁的物质的量为 1.25mol
根据 OC 段的数据可知开始加入的高锰酸钾的物质的量为 0.25mol
取一定质量的均匀固体混合物 Cu、CuO 和 Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少 3.20 g,另一份中加入 500mL 稀硝酸(铜元素全部转化成 Cu(NO3)2,其还原产物为 NO),固体恰好完全溶解,且同时收集到标准状况下 NO 气体 4.48L,则所用硝酸的物质的量浓度为( )
A.2.0 mol/L B.2.4 mol/L C.1.2 mol/L D.1.0mol/L
第 II 卷(非选择题 共 5 个小题,满分 52 分)
17.(7 分)“生活无处不化学”,请你回答下列问题。
食盐不慎洒落在天然气的火焰上,观察到现象是 ,该变化称为 反应。
沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是 。(3)使用“84”消毒液(含NaClO )时,按一定比例与水混合,并在空气中浸泡一段时间,使NaClO 与H2O 及空气中的CO2 充分 反应,目的是得到杀菌消毒效果更好的 (填物质名称),将该反
1ClO + 1CO + 1H O=
+
-
应的离子方程式补充完整 2 2
18.(10 分)现有下列十种物质:①乙醇②铝③CaO④CO2 ⑤氯化氢⑥Ba(OH)2 ⑦红褐色氢氧化铁液体⑧氨水⑨稀硝酸⑩ 硫酸铁
按物质的分类方法填写表格的空白处:
分类标准
氧化物
电解质
属于该类的物质
②
⑧ ⑨
⑦
上述十种物质中有两种物质之间可发生离子反应:H++OH-=H O,该离子反应对应的化学方程式为 。
⑩在水中的电离方程式为 ,20g⑩溶于水配成 250mL 溶液,所含阴离子的粒子数为 ,阳离子-的物质的量浓度为
少量的④通入⑥的溶液中反应的离子方程式为
19.(11 分)KClO3 和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯,其变化可表述为
KClO3+ HCl(浓)= KCl+ ClO2↑+ Cl2↑+ H2O
请配平上述化学方程式并用双线桥表示出电子转移情况。
该反应中还原产物与氧化产物的物质的量之比为
若该反应有 490gKClO3 参加反应,则被氧化的 HCl 的质量为
若该反应的产生 2.24L(标准状况)ClO2,则转移的电子数目为
某地生产的食盐中含有少量的剧毒氰化钠 NaCN,用 ClO2
可以除去其中的氰化钠,从而得到纯净的食盐,同时产生两种无毒的气体。写出该反应的化学方程式 20.(11 分)从铝土矿(主要成分为 Al2O3,还有少量杂质)中提取铝的工艺流程及步骤如下:
试回答下列问题:
试剂 X 为 ;反应①的化学方程式为 。
操作 I 、操作 II 均为 (填操作名称)。反应①②③④中属于氧化还原反应的是 (填数字序号)。
反应②的离子方程式为 。
金属铝与氧化铁的混合物在高温下会发生剧烈的反应,该反应的化学方程式为 (5) 反应④制取金属铝,若有 0.6mol 电子发生发生转移,理论上能得到金属铝的质量是 g。21.(13 分)为探究 Na 与 CO2 反应产物,某化学兴趣小组按下图装置进行实验。
已知:CO + 2Ag ( NH3) 2OH=2Ag↓+( NH4 ) 2CO3 +2NH3
回答下列问题:
写出 A 中反应的离子方程式 。
仪器 X 的名称是 ,B 中的溶液为 。
先称量硬质玻璃管的质量为 m1 g ,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是 m2 g 。再进行下列实验操作,其正确顺序是 (填标号);
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭 K1 和 K2 d.打开 K1 和 K2,通入 CO2 至 E 中出现浑浊
e.称量硬质玻璃管 f.冷却到室温
重复上述操作步骤,直至硬质玻璃管恒重,称得质量为 m3 g 。加热硬质玻璃管一段时间,观察到以下现象
① 钠块表面变黑,熔融成金属小球;
② 继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;③ F 中试管内壁有银白物质产生。产生上述②现象的原因是 。
探究固体产物中元素 Na 的存在形式
假设一:只有 Na2CO3;假设二:只有 Na2O ;假设三:Na2O 和 Na2CO3 均有完成下列实验设计,验证上述假设:
步骤
操作
结论
1
将硬质玻璃管中的固体产物溶于水后过滤
假设一成立
2
往步骤 1 所得滤液中
3
根据上述实验现象及下表实验数据,写出 Na 与 CO2 反应的总化学方程式
。
m1
m2
m3
66.7g
69.0g
72.1g
化学试题答案
第 I 卷(选择题)
选择题(共 16 小题,每小题 3 分,满分 48 分,每小题只有一个选项符合题目要求)
1、A 2、D 3、B 4、B 5、B 6、D 7、D 8、C 9、D 10、C 11、D 12、D 13、D 14、B 15、C 16、B
第 II 卷(非选择题 共 5 个小题,满分 52 分)
17、(1)黄色火焰 焰色 (2)3Fe+4H2O(g) Fe3O4+4H2
(3)次氯酸 ClO-+CO2+H2O=HClO+HCO -
18、(1)金属单质 溶液 胶体 ③④ ③⑤⑥⑩
(2) Ba(OH)2 +2HNO3 =Ba(NO)2 +2H2O
2 4 3 4 A
(3) Fe (SO ) =2Fe3++ 3SO 2- 0.15N 0.4 mol/L
2 2
(4) CO +Ba2++2OH-=BaCO3↓+ H O
19、(1)
(2)2:1 (3)146g (4)0.1NA 或 6.02×1022
(5)2NaCN+2ClO2=2NaCl+2CO2+N2
20、(1)NaOH 溶液 Al2O3+2NaOH=2NaAlO2+H2O
B. 过滤 ④
2 2 2 3 3
C. AlO -+CO (足)+2H O=Al(OH) ↓+HCO -
D. 2Al+Fe2O3 Al2O3+2Fe
(5)5.4
21、(1) CaCO + 2H+ = Ca2+ + CO ↑ + H O
(2)长颈漏斗 饱和 NaHCO3 溶液
(3)d a b f c e
1. 钠的焰色反应为黄色,钠与二氧化碳反应有碳单质生成
1. 加入足量 BaCl2(或 CaCl2 、Ba(NO3)2、Ca(NO3)2)溶液 滴入酚酞试液 (或紫色石蕊试液或用广泛 pH 试纸检测溶液 pH)
2. 6Na + 5CO2 3Na2CO3 + C + CO