- 171.50 KB
- 2021-08-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
学业分层测评(十九) 富集在海水中的元素——氯
(建议用时:45分钟)
[学业达标]
1.氯气可用于消灭田鼠,可将氯气用软管通入田鼠洞中,这是利用了氯气下列性质中的( )
①黄绿色 ②密度比空气大
③有毒 ④易液化 ⑤溶于水
A.①② B.②③
C.①②③ D.③④⑤
【解析】 将氯气通入到田鼠洞中起灭鼠作用,一方面是利用其密度比空气大得多,可沉在洞里,另一方面氯气有毒。
【答案】 B
2.下列关于Cl2用途的说法正确的是( )
A.Cl2有毒,不能用来给自来水消毒
B.饮用Cl2消毒的自来水不会对人体有任何伤害
C.Cl2是一种重要的化工原料
D.用Cl2与金属钠反应制取NaCl
【解析】 任何事物都有两面性,Cl2有毒但可作消毒剂,用Cl2对自来水消毒时,Cl2会与水中的有机物反应,生成对人体有害的有机氯化物。NaCl主要是从海水中提取的,而不用Na和Cl2反应制备。
【答案】 C
3.用自来水养金鱼时,将水注入鱼缸以前需把水放在阳光下暴晒一段时间,目的是( )
A.起到杀菌作用 B.使水中次氯酸分解
C.提高水的温度 D.增加水中氧气的含量
【解析】 自来水中的次氯酸有强氧化性,易导致金鱼死亡,经暴晒可使自来水中的次氯酸分解。
【答案】 B
4.自来水是用Cl2杀菌消毒的,不法商贩用自来水冒充纯净水出售,为辨真伪,可用下列哪一种试剂鉴别( )
A.酚酞溶液 B.FeCl3溶液
C.AgNO3溶液 D.NaOH溶液
【解析】 自来水用Cl2消毒,自来水中含有Cl-,可用AgNO3溶液鉴别。
【答案】 C
6
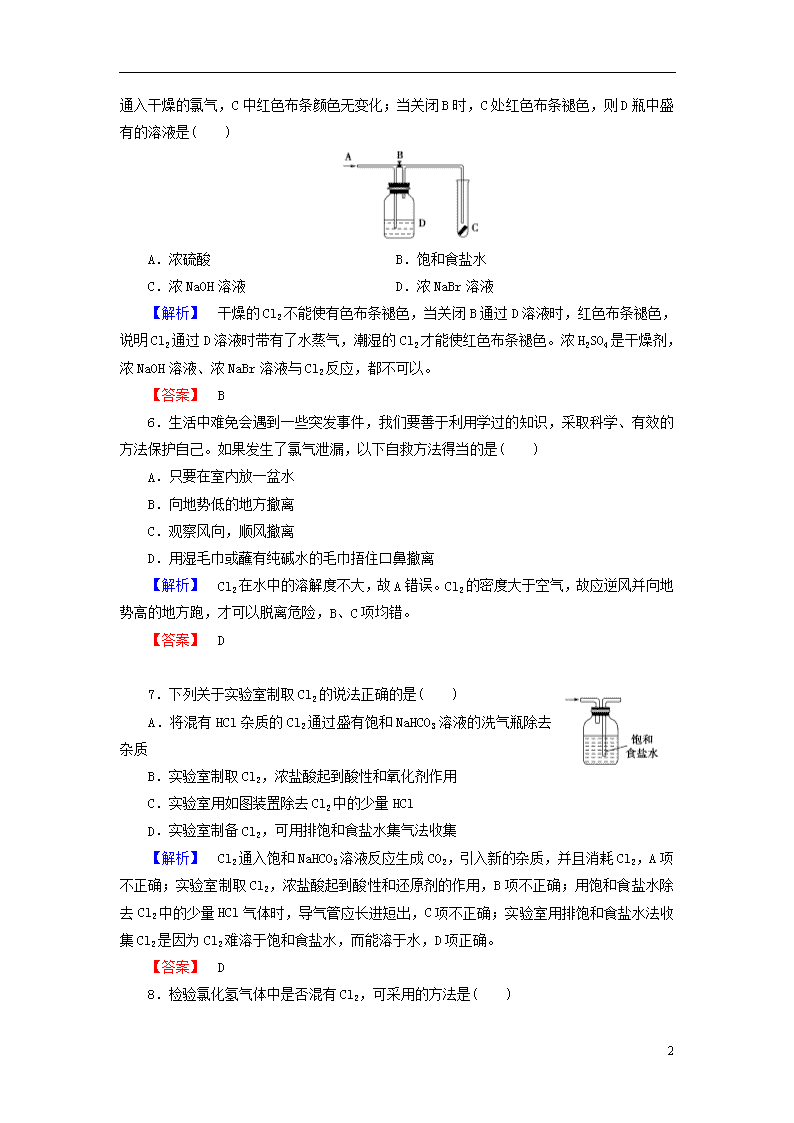
5.如图是一种检验某气体化学性质的实验装置,图中B为开关,若先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色,则D瓶中盛有的溶液是( )
A.浓硫酸 B.饱和食盐水
C.浓NaOH溶液 D.浓NaBr溶液
【解析】 干燥的Cl2不能使有色布条褪色,当关闭B通过D溶液时,红色布条褪色,说明Cl2通过D溶液时带有了水蒸气,潮湿的Cl2才能使红色布条褪色。浓H2SO4是干燥剂,浓NaOH溶液、浓NaBr溶液与Cl2反应,都不可以。
【答案】 B
6.生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水
B.向地势低的地方撤离
C.观察风向,顺风撤离
D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
【解析】 Cl2在水中的溶解度不大,故A错误。Cl2的密度大于空气,故应逆风并向地势高的地方跑,才可以脱离危险,B、C项均错。
【答案】 D
7.下列关于实验室制取Cl2的说法正确的是( )
A.将混有HCl杂质的Cl2通过盛有饱和NaHCO3溶液的洗气瓶除去杂质
B.实验室制取Cl2,浓盐酸起到酸性和氧化剂作用
C.实验室用如图装置除去Cl2中的少量HCl
D.实验室制备Cl2,可用排饱和食盐水集气法收集
【解析】 Cl2通入饱和NaHCO3溶液反应生成CO2,引入新的杂质,并且消耗Cl2,A项不正确;实验室制取Cl2,浓盐酸起到酸性和还原剂的作用,B项不正确;用饱和食盐水除去Cl2中的少量HCl气体时,导气管应长进短出,C项不正确;实验室用排饱和食盐水法收集Cl2是因为Cl2难溶于饱和食盐水,而能溶于水,D项正确。
【答案】 D
8.检验氯化氢气体中是否混有Cl2,可采用的方法是( )
6
A.用干燥的蓝色石蕊试纸
B.用干燥有色布条
C.将气体通入硝酸银溶液
D.用湿润的淀粉-KI试纸
【解析】 HClO具有漂白性,而Cl2不具有,若干燥环境下,Cl2不能转变为HClO,因而无漂白性,无法与HCl气体区分,气体通入AgNO3溶液都产生白色沉淀,因为Cl2与H2O反应也产生Cl-。Cl2与KI反应产生I2,淀粉遇I2变蓝,可以与HCl区分。
【答案】 D
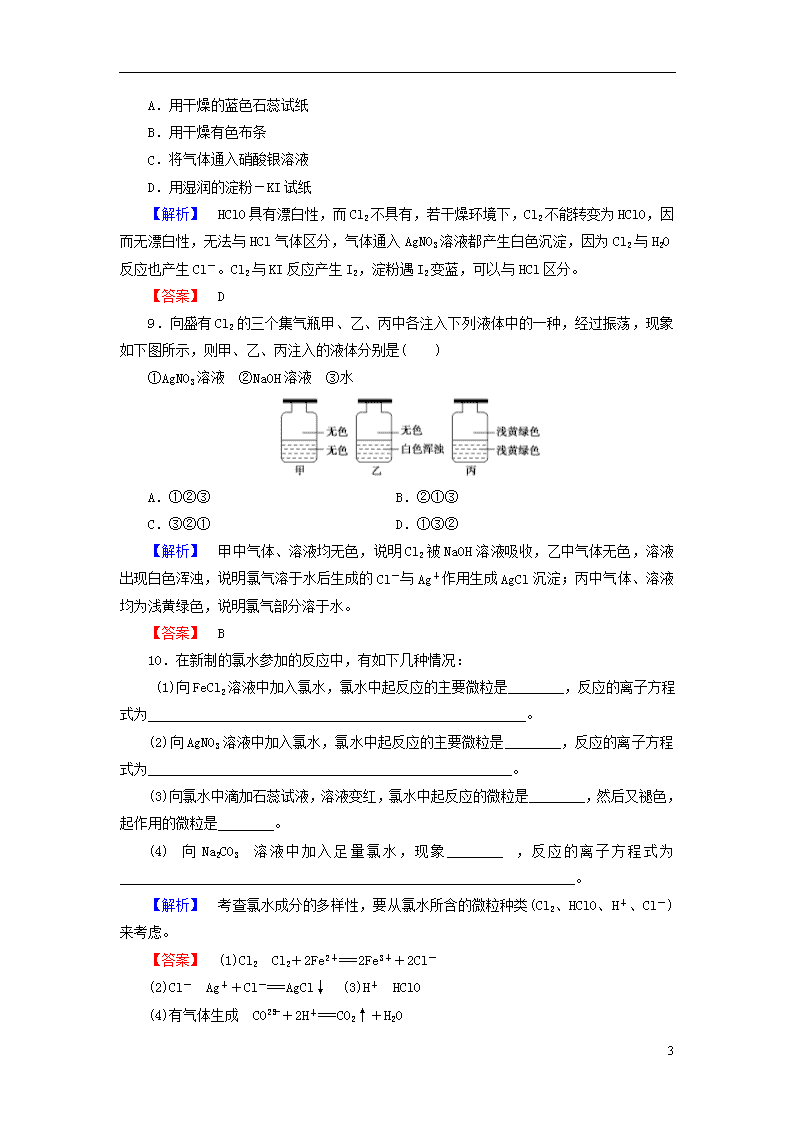
9.向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙注入的液体分别是( )
①AgNO3溶液 ②NaOH溶液 ③水
A.①②③ B.②①③
C.③②① D.①③②
【解析】 甲中气体、溶液均无色,说明Cl2被NaOH溶液吸收,乙中气体无色,溶液出现白色浑浊,说明氯气溶于水后生成的Cl-与Ag+作用生成AgCl沉淀;丙中气体、溶液均为浅黄绿色,说明氯气部分溶于水。
【答案】 B
10.在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2溶液中加入氯水,氯水中起反应的主要微粒是________,反应的离子方程式为______________________________________________________。
(2)向AgNO3溶液中加入氯水,氯水中起反应的主要微粒是________,反应的离子方程式为____________________________________________________。
(3)向氯水中滴加石蕊试液,溶液变红,氯水中起反应的微粒是________,然后又褪色,起作用的微粒是________。
(4)向Na2CO3溶液中加入足量氯水,现象________,反应的离子方程式为_________________________________________________________________。
【解析】 考查氯水成分的多样性,要从氯水所含的微粒种类(Cl2、HClO、H+、Cl-)来考虑。
【答案】 (1)Cl2 Cl2+2Fe2+===2Fe3++2Cl-
(2)Cl- Ag++Cl-===AgCl↓ (3)H+ HClO
(4)有气体生成 CO+2H+===CO2↑+H2O
6
11.实验室中常用MnO2氧化浓盐酸的方法制取氯气,实验装置如图所示:
(1)圆底烧瓶中发生反应的离子方程式是_____________________________
_______________________________________________________________。
(2)如果将过量二氧化锰与20 mL 12 mol·L-1的盐酸混合加热,充分反应后生成的氯气明显少于0.06 mol。其主要原因有①____________________________;
②____________________________________________________________。
(3)为了提高浓盐酸的利用率,你对实验的建议是______________________
______________________________________________________________。
(4)实验结束清洗仪器时,为了减少烧瓶中残留氯气对环境的污染,可以向烧瓶中加入的溶液是________,有关的离子方程式是_______________________
_______________________________________。
【解析】 题中所给盐酸中HCl的物质的量是0.24 mol,但由于盐酸受热易挥发,且随反应的不断进行,盐酸浓度越来越小,变为稀盐酸后不再与MnO2反应,所以产生的Cl2的物质的量小于0.06 mol。
【答案】 (1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O
(2)①加热使HCl大量挥发
②盐酸变稀后不再发生反应
(3)将浓盐酸慢慢滴下;加热用小火
(4)NaOH溶液
Cl2+2OH-===Cl-+ClO-+H2O;
H++OH-===H2O
12.有一包白色固体,它可能是KCl、K2CO3、KNO3中的一种或几种,进行下列实验:
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀;
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成。
根据上述现象判断:
(1)白色固体一定含有的成分是________,可能含有的成分是________;
(2)请写出上述实验中有关反应的离子方程式:_______________________
_____________________________________________________________
6
【解析】 由②产生白色沉淀知,可能含有K2CO3和KCl中的一种或两种;由③沉淀量减少且有气泡生成知,一定含有K2CO3;根据沉淀不完全消失可知,一定含有KCl。
【答案】 (1)KCl和K2CO3 KNO3
(2)Ag++Cl-===AgCl↓,2Ag++CO===Ag2CO3↓,Ag2CO3+2H+===2Ag++H2O+CO2↑
[能力提升]
13.为预防“H1N1”甲型流感,可用“84”消毒液(NaClO溶液)消毒,下列说法中正确的是( )
A.NaClO溶液的消毒原理是HClO具有强氧化性
B.1 mol Cl2与足量NaOH溶液反应转移2 mol电子
C.NaClO溶液的漂白原理与Na2O2、活性炭相同
D. “84”消毒液与“洁厕灵”(盐酸)共同使用,可达到既清洁又消毒的双重效果
【解析】 1 mol Cl2与足量NaOH溶液反应转移 1 mol 电子,B错;活性炭的漂白原理是吸附色素后得无色物质,而NaClO、Na2O2的漂白原理是强氧化性,C错;D中会发生反应Cl-+ClO-+2H+===Cl2↑+H2O,生成了有毒气体,D错。
【答案】 A
14.实验室制备氯气的化学方程式是MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑。下列关于实验室制氯气的说法中错误的是( )
A.还原剂是HCl,氧化剂是MnO2
B.每生成1 mol Cl2,转移电子2 mol
C.每消耗1 mol MnO2,起还原作用的HCl为4 mol
D.生成的氯气中含有水蒸气和HCl
【解析】 在MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O中,MnO2是氧化剂,HCl是还原剂,每生成1 mol Cl2转移2 mol电子,但在参加反应的4 mol HCl中,只有2 mol被氧化,即起还原作用的HCl为2 mol;由于反应加热,因此生成的氯气中含有水蒸气和HCl气体。
【答案】 C
15.某研究小组制备消毒液(主要成分为NaClO)设计了图示装置,并查阅到下列资料:在加热情况下卤素单质和碱液发生反应3X2+6OH-5X-+XO+3H2O。回答下列问题:
6
(1)装置中的试管内发生反应的离子方程式为_______________________________________________________________
______________________________________________________________。
(2)装置中能否省去饱和NaCl溶液的洗气瓶?________,理由是______________________________________________________________。
(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是______________________________________________________________。
(4)装置中能否省去盛冰水的烧杯?________,理由是_______________________________________________________________。
【解析】 装置产生的Cl2在冰水冷却下和NaOH发生反应制得消毒液。运用该装置必须通过饱和NaCl溶液除去HCl,否则将生成NaCl,降低NaClO的纯度;但干燥装置可以省略,因为少量水蒸气不会影响反应;冷却装置不可省略,因为氯气和水的反应是放热反应,温度升高,引起副反应:3Cl2+6OH-5Cl-+ClO+3H2O。
【答案】 (1)Cl2+2OH-===Cl-+ClO-+H2O
(2)否 氯气中混有的HCl气体进入试管中也会和氢氧化钠溶液反应,降低NaClO的产量和纯度
(3)能 少量水蒸气进入试管中不影响反应
(4)否 氯气和水的反应是放热反应,反应时温度升高,会引起副反应,生成NaClO3
6
相关文档
- 2020高中化学第二章烃和卤代烃第三2021-08-077页
- 高中化学58个精讲24氨、铵盐2021-08-075页
- 2020年高中化学 第04章 电化学基础2021-08-0713页
- 高中化学(人教版,选修4) 第四章电化学2021-08-076页
- 2020高中化学 第三章 自然界中的元2021-08-074页
- 高中化学教案新人教版选修1 合理选2021-08-073页
- 2019-2020学年高中化学课时作业3原2021-08-077页
- 2019-2020学年高中化学课时作业9化2021-08-0710页
- 高中化学人教版必修2(练习)第1章重难2021-08-074页
- 2020版高中化学 专题5 溶液中的离2021-08-0711页