- 932.00 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 化学能转化为电能
一、原电池工作原理
1.实验探究
实验步骤
解释或说明
锌与稀硫酸发生置换反应产生氢气,而铜则不能
锌与稀硫酸反应,但氢气在铜片上产生,导线中有电流
锌与稀硫酸反应产生氢气,但导线中无电流
乙醇是非电解质,与锌、铜都不反应
2.原电池的概念
原电池是将化学能转化为电能的装置;
原电池的反应本质是氧化还原反应。
3.原电池的构成条件
理论上,自发的氧化还原反应均可构成原电池。
具体条件是:(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)。
(2)溶液:两电极均插入电解质溶液中。
(3)导线:两电极用导线相连,形成闭合回路。
4.原电池的工作原理
(1)分析下图并填空
15
原电池总反应式:Zn+2H+===Zn2++H2↑。
(2)能量转化:化学能转变为电能。
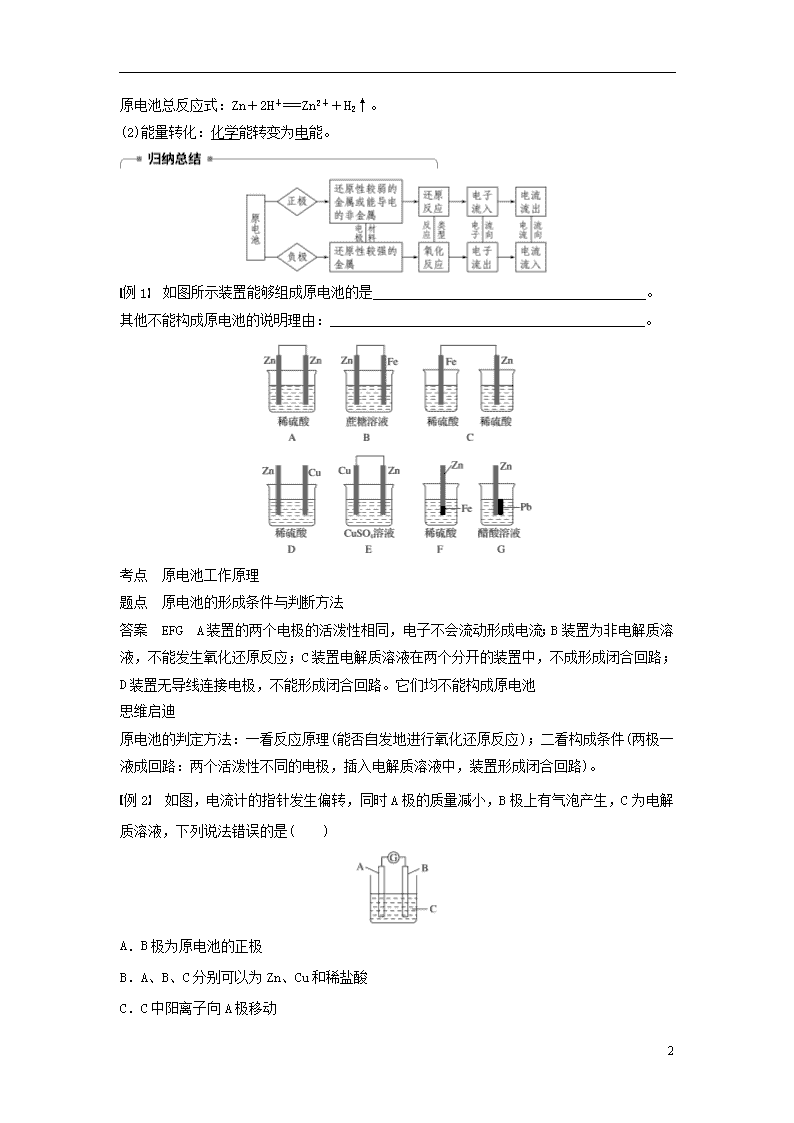
例1 如图所示装置能够组成原电池的是_______________________________________。
其他不能构成原电池的说明理由:_____________________________________________。
考点 原电池工作原理
题点 原电池的形成条件与判断方法
答案 EFG A装置的两个电极的活泼性相同,电子不会流动形成电流;B装置为非电解质溶液,不能发生氧化还原反应;C装置电解质溶液在两个分开的装置中,不成形成闭合回路;D装置无导线连接电极,不能形成闭合回路。它们均不能构成原电池
思维启迪
原电池的判定方法:一看反应原理(能否自发地进行氧化还原反应);二看构成条件(两极一液成回路:两个活泼性不同的电极,插入电解质溶液中,装置形成闭合回路)。
例2 如图,电流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C分别可以为Zn、Cu和稀盐酸
C.C中阳离子向A极移动
15
D.A极发生氧化反应
答案 C
解析 原电池中,负极金属失去电子,发生氧化反应溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。
二、原电池原理的应用
1.钢铁的电化学腐蚀
(1)电化学腐蚀
金属跟电解质溶液接触,发生原电池反应,比较活泼的金属失去电子而被氧化的腐蚀。
(2)钢铁的电化学腐蚀
电解质溶液
钢铁表面水膜中含有H+和OH-,还溶有O2等气体
电极
负极
材料:Fe,电极反应:Fe-2e-===Fe2+
正极
材料:C,电极反应:O2+4e-+2H2O===4OH-
总反应
2Fe+O2+2H2O===2Fe(OH)2,进一步被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,Fe(OH)3易分解生成铁锈(Fe2O3·xH2O)
2.金属活动性强弱的判断
由A、B、C、D四种金属按下表中装置进行实验
装置
现象
二价金属A不断溶解
C的质量增加
A上有气体产生
(1)装置甲中负极的电极反应式是A-2e-===A2+。
(2)装置乙中正极的电极反应式是Cu2++2e-===Cu。
(3)四种金属活动性由强到弱的顺序是D>A>B>C。
原电池工作原理的应用
(1)比较金属活动性
原电池中,作负极的金属活动性一般比作正极的金属活动性强。
(2)改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
15
(3)设计原电池
如:把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe作负极,铜(或石墨)作正极,FeCl3溶液作电解质溶液。
(4)保护金属设备
如:船体是钢铁材料,在海水中易被腐蚀,在船体外壳焊接上比铁活泼的金属(如Zn),则构成以Zn、Fe为电极的原电池,Zn被消耗掉而Fe得到保护。
例3 (2018·台州月考)在一块表面无锈的铁片上滴食盐水,放置一段时间后看到铁片上有铁锈出现。铁片腐蚀过程中发生的总化学方程式:2Fe+2H2O+O2===2Fe(OH)2,Fe(OH)2进一步被氧气氧化为Fe(OH)3,再在一定条件下脱水生成铁锈,其原理如图。下列说法正确的是( )
A.铁片发生还原反应而被腐蚀
B.铁片腐蚀最严重区域应该是生锈最多的区域
C.铁片腐蚀中负极发生的电极反应:
2H2O+O2+4e-===4OH-
D.铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀
答案 D
解析 铁作负极,发生失电子的氧化反应,选项A错误;铁片负极腐蚀最严重,由于离子的移动,在正极区域生成铁锈最多,选项B错误;铁作负极,发生失电子的氧化反应,即Fe-2e-===Fe2+,选项C错误;D项,铁片里的铁和碳与食盐水形成无数微小原电池,发生了电化学腐蚀,铁作负极,碳作正极,选项D正确。
例4 某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项
正极
负极
电解质溶液
A
Cu
Zn
HCl
B
Zn
Cu
CuSO4
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnCl2
考点 原电池原理的应用
题点 设计原电池
答案 C
15
解析 将Zn+Cu2+===Zn2++Cu拆开两个半反应:
氧化反应(负极反应):Zn-2e-===Zn2+。
还原反应(正极反应):Cu2++2e-===Cu。
则电池的负极是Zn,正极是比锌不活泼的金属或导电的非金属,电解质溶液中含Cu2+。
方法技巧——设计原电池的方法
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
原电池是把化学能转化为电能的装置。其工作原理是
1.判断正误(正确的打“√”,错误的打“×”)
(1)电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源( )
(2)NaOH+HCl===NaCl+H2O是放热反应,可以设计成原电池( )
(3)原电池中的阳离子由负极区向正极区移动( )
(4)在Zn|稀硫酸|Cu原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌( )
(5)把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快( )
考点 原电池工作原理
题点 原电池的综合应用
答案 (1)√ (2)× (3)√ (4)× (5)√
2.如图为某兴趣小组制作的番茄电池,下列说法正确的是( )
15
A.电子由铜通过导线流向锌
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌通过导线流向铜
考点 原电池工原理
题点 原电池工作原理
答案 C
解析 A项,铜作正极,锌作负极,因此电子由锌流向铜,故错误;B项,该装置将化学能转化为电能,故错误;C项,锌作负极失去电子,发生氧化反应,故正确;D项,电子与电流的方向相反,因此电流由铜极流向锌极,故错误。
3.在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2 ④Fe(OH)3失水形成Fe2O3·xH2O ⑤杂质碳被氧化
A.①② B.②③④
C.①②③④ D.①②③④⑤
答案 C
解析 本题考查钢铁的电化学腐蚀。在腐蚀过程中,负极Fe-2e-===Fe2+,正极O2或H+得电子,Fe2+与OH-结合生成Fe(OH)2,Fe(OH)2被氧化生成Fe(OH)3,Fe(OH)3失水形成铁锈。
4.下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是( )
A.①②③④ B.④②①③
C.③①②④ D.②①③④
考点 原电池原理的应用
题点 金属腐蚀快慢的比较
答案 B
解析 ③中的锌作负极,腐蚀速率最快;④中的锌与外界不接触,腐蚀速率最慢;②中的锌作正极,腐蚀速率比①中的锌要慢;因此腐蚀速率由慢到快的顺序为④②①③,故B正确。
15
5.在铜锌原电池中(如下图),以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为______________________________。
锌片上观察到的现象为_______________________________;铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式_________________________;
铜片上观察到的现象为___________________________________________________,原电池总反应的离子方程式为__________________________________________________________。
考点 原电池工作原理
题点 常考多变的锌铜原电池
答案 负 氧化 Zn-2e-===Zn2+ 锌片溶解 正 还原 Cu2++2e-===Cu 铜极变粗 Zn+Cu2+===Zn2++Cu
解析 CuSO4为电解质溶液时,铜锌原电池的负极为锌,电极反应式为Zn-2e-===Zn2+,所以锌片不断溶解,正极为铜,电极反应式为Cu2++2e-===Cu,所以铜极不断变粗,原电池总反应式为Zn+Cu2+===Zn2++Cu。
[对点训练]
题组一 化学能转化为电能
1.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
考点 能源与构成原电池的条件
题点 原电池的形成条件与判断
答案 D
15
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。对图示各个装置进行观察,发现只有D不能形成闭合回路,因此不能形成原电池。
2.下列关于原电池的叙述,正确的是( )
A.构成原电池的正极和负极材料必须是两种活泼性不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
考点 原电池工作原理和正负极的判断
题点 原电池构成和原理的理解
答案 B
解析 构成原电池的正极和负极可以是两种活泼性不同的金属,也可以是导电的非金属(如石墨棒)和金属,A错误;原电池是将化学能转变为电能的装置,B正确;在原电池中,负极上发生失去电子的氧化反应,正极上发生得到电子的还原反应,所以电子从负极沿导线流向正极,C错误;原电池放电时,电子从负极沿导线流向正极,则电流的方向是从正极到负极,D错误。
3.(2017·湖北部分重点中学期末联考)某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
实验记录
①Cu为正极,Zn为负极;
②Zn质量减少,Cu质量增加;
③SO向Cu极移动;
④电子流向:由Zn经导线流入Cu片;
⑤Zn电极发生还原反应;
⑥正极反应式:Cu2++2e-===Cu。
A.②③④ B.①②④⑥
C.①②④⑤ D.②③⑤⑥
考点 原电池工作原理和正负极的判断
题点 原电池工作原理
答案 B
解析 ①Zn比Cu活泼,Zn为负极,Cu为正极,故正确;②铜为正极,发生反应:Cu2++2e-===
15
Cu,铜极质量增大,故正确;③原电池工作时,阴离子向负极移动,故错误;④电子由负极流向正极,即电子由Zn电极流向Cu电极,故正确;⑤Zn电极发生氧化反应,故错误;⑥正极发生还原反应,电极反应方程式为Cu2++2e-===Cu,故正确。综上所述,B正确。
4.人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断氧化银是( )
A.负极,被氧化 B.正极,被还原
C.负极,被还原 D.正极,被氧化
考点 原电池工作原理和正负极的判断
题点 正、负极的判断
答案 B
解析 电池的电极反应式:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,从中可以看出锌的化合价升高,所以锌为负极,被氧化,而氧化银中的银化合价降低,故氧化银为正极,被还原,故B符合题意。
5.(2017·武汉高一检测)如图将锌片和铜片用导线连接后放入稀硫酸中,发生原电池反应,下列叙述错误的是( )
A.溶液的pH增大
B.溶液中的Zn2+浓度增大
C.溶液中的SO浓度增大
D.溶液的密度增大
考点 原电池的工作原理和正负极的判断
题点 常考多变的锌铜原电池
答案 C
解析 A项,氢离子浓度降低,溶液的pH增大,正确;B项,锌不断溶解,溶液中的Zn2+浓度增大,正确;C项,由于在反应过程中溶液中SO没有参加反应,所以溶液中c(SO)不变,错误;D项,原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,正确。
6.如图所示装置,电流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
15
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
考点 原电池工作原理和正负极的判断
题点 多角度判断正、负极
答案 D
解析 A极逐渐变粗,说明A极为原电池的正极,溶液中的金属阳离子得到电子后在A极上析出;B极逐渐变细,说明B极为原电池的负极,失去电子后变成离子进入溶液中。A和B两项中的反应为Zn+H2SO4===ZnSO4+H2↑,则A项A极变细,B项A极不变;C和D两项中的反应为Fe+2AgNO3===2Ag+Fe(NO3)2,其中C项A极变细,D项A极变粗。
题组二 原电池工作原理的应用
7.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:
则四种金属的活泼性由强到弱的顺序为( )
A.Z>Y>X>W B.Z>X>Y>W
C.Z>Y>W>X D.Y>Z>X>W
考点 原电池工作原理的应用
题点 比较金属活泼性的强弱
答案 A
15
8.(2018·南宁六中5月考试)下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2H2+O22H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.CH4+2O2CO2+2H2O
考点 原电池原理的应用
题点 能否设计原电池的化学反应分析
答案 C
解析 只有属于氧化还原反应,才能用于设计原电池;A、B、D属于氧化还原反应,均可以设计为原电池。C不属于氧化还原反应,不能设计成原电池,C正确。
9.(2018·北京四中4月月考)为将反应2Al+6H+===2Al3++3H2↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去了氧化膜)( )
考点 原电池原理的应用
题点 原电池的设计
答案 B
解析 A项为原电池,铝为负极,但总反应为2Al+2OH-+2H2O===2AlO+3H2↑,不符合;C项为原电池,但硝酸是氧化性酸,则总反应为Al+4H++NO===Al3++NO↑+2H2O,不符合;D项装置中有外接电源,不属于原电池,不符合。
10.小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中SO向Cu片移动
15
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1∶32时,Zn片减轻的质量相等
考点 原电池原理的应用
题点 原电池工作原理的探究
答案 B
解析 Zn、Cu直接接触就能构成闭合回路而形成原电池,Cu片上可看到有气泡产生,A项正确;SO带负电荷,应该向负极Zn片移动,B项错误;由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C项正确;假设图2中正极产生2 g H2,则转移2 mol电子,消耗负极65 g Zn,而图3中正极析出64 g Cu,也转移2 mol电子,消耗负极65 g Zn,故Zn片减轻的质量相等,D项正确。
题组三 钢铁的电化学腐蚀
11.(2018·深圳高一期末)下图实验为研究金属腐蚀的实验。下列相关说法正确的是( )
A.该实验研究的是金属的吸氧腐蚀
B.铁表面的反应为Fe-3e-===Fe3+
C.红色首先在食盐水滴的中心出现
D.食盐水中有气泡逸出
考点 原电池原理的应用
题点 钢铁的电化学腐蚀
答案 A
解析 A项,食盐水显中性,因此该实验属于钢铁的吸氧腐蚀,正确;B项,负极上发生的电极反应式为Fe-2e-===Fe2+,错误;C项,食盐水滴周围液体少,氧气量多,所以红色首先在食盐水滴的周围出现,错误;D项,正极上发生的电极反应式为O2+2H2O+4e-===4OH-,所以食盐水中没有气泡逸出,错误,答案选A。
12.(2018·毕节市段考)关于金属材料的锈蚀说法不一,其中没有科学道理的是( )
A.金属接触水和空气锈蚀加快
B.改变金属的内部结构形成合金能抵御金属锈蚀
C.金属表面刷油漆可以抵御金属锈蚀
D.不断擦去铝表面的锈能抵御铝的继续锈蚀
考点 原电池原理的应用
题点 金属的电化学腐蚀与防护
答案 D
15
解析 A项,金属接触水和空气锈蚀加快,正确;B项,铁中掺入铬和镍等金属改变内部结构,制成不锈钢可以防腐蚀,所以改变金属的内部结构能抵御金属锈蚀,正确;C项,金属防锈的措施之一是在金属表面刷油漆,正确;D项,不断擦去铝表面的锈,使得内部金属暴露出来,加快了铝的腐蚀而不是抵御铝的继续锈蚀,错误。
[综合强化]
13.(2018·余姚期中)目前,市场上有多种“热敷袋”出售,有一次性的,有可以重复使用的。某一化学研究性学习小组在研究了某种“热敷袋”的构造后,决定自己制造一个一次性“热敷袋”,制造过程如下:①称取15 g小颗粒状活性炭,40 g还原铁粉,5 g细木屑,都放在一只烧杯中,再加入15 mL 15%食盐水,用玻璃棒搅拌均匀。②用大头针在小塑料袋上扎几十个针眼(袋的两层同时扎穿),把烧杯里的混合物全部加入小塑料袋中,封上袋口,再放入大塑料袋中,封上袋口,可长期保存。③使用时将大塑料袋袋口打开,反复搓揉小塑料袋5~8 min,能感觉温度明显上升。回答下列问题:
(1)该一次性“热敷袋”利用了________原理。
(2)使用时将大塑料袋袋口打开的原因是让氧气进入反应,写出其电极反应式________________________________________________________________________;
炭粉的作用是__________________________________________________________。
(3)将使用过的“热敷袋”打开,发现有大量棕红色粉末生成,该物质主要成分是________,写出生成该物质的化学反应方程式:
①________________________________________________________________________;
②________________________________________________________________________。
答案 (1)原电池
(2)O2+2H2O+4e-===4OH- 作原电池正极,加快铁的腐蚀
(3)铁锈(或Fe2O3)
①4Fe(OH)2+2H2O+O2===4Fe(OH)3
②2Fe(OH)3===Fe2O3+3H2O
解析 (1)铁、碳和氯化钠溶液能自发进行氧化还原反应而构成原电池,所以热敷袋利用原电池原理。
(2)与氧气接触,发生金属的吸氧腐蚀,正极反应为O2+2H2O+4e-===4OH-,其中炭粉的作用是作原电池正极,加快铁的腐蚀。
(3)铁发生吸氧腐蚀后最终产物红棕色粉末为铁锈,其成分为氧化铁(Fe2O3);发生反应的化学方程式为4Fe(OH)2+2H2O+O2===4Fe(OH)3,2Fe(OH)3===Fe2O3+3H2O。
14.(2017·咸宁高一检测)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
15
(1)该电池的负极材料是________,发生________反应(填“氧化”或“还原”),电解质溶液是____________。
(2)正极上出现的现象是________________________________________________。
(3)若导线上转移电子1 mol,则生成银______ g。
考点 原电池原理的应用
题点 原电池的设计
答案 (1)Cu 氧化 AgNO3溶液
(2)碳棒上出现银白色物质
(3)108
解析 (1)根据电池的总反应,可知负极一般是失电子的物质,所以负极材料应该是铜,发生氧化反应,电解质溶液是一种可溶性的银盐溶液,所以是AgNO3溶液。(2)正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。(3)当导线上转移1 mol电子的时候,正极上会析出1 mol银单质,所以正极上生成的银的质量是108 g。
15.某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号
电极材料
电解质溶液
电流计指针偏转方向
1
Al、Mg
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨)
稀盐酸
偏向石墨
4
Al、Mg
氢氧化钠溶液
偏向Mg
5
Al、Zn
浓硝酸
偏向Al
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“是”或“否”)?____________。
(2)由实验3完成下列填空:
①铝为________极,电极反应式:_________________________________________;
②石墨为________极,电极反应式:________________________________________;
③电池总反应式:______________________________________________。
(3)实验4中铝作负极还是正极?________,理由是_______________________________
________________________________________________________________________。
写出铝电极的电极反应式:______________________________________________。
(4)解释实验5中电流计指针偏向铝的原因:______________________________________
________________________________________________________________________
15
________________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:____________________。
考点 原电池工作原理和正负极的判断
题点 多角度判断正、负极
答案 (1)否 (2)①负 2Al-6e-===2Al3+
②正 6H++6e-===3H2↑ ③2Al+6HCl===2AlCl3+3H2↑
(3)负极 在NaOH溶液中,活动性:Al>Mg Al-3e-+4OH-===AlO+2H2O
(4)Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中,活动性:Zn>Al,Al是原电池的正极
(5)①另一个电极材料的活动性;②电解质溶液
解析 在稀盐酸中的活动性:Mg>Al>Cu。由实验1和2可知,原电池中电流计指针是偏向正极。在实验3中电流计指针偏向石墨,由上述规律可知,Al是负极,石墨是正极,化学反应是Al失去电子被氧化为Al3+,盐酸中的H+得到电子被还原为H2。在NaOH溶液中活动性:Al>Mg,则Al是负极,Mg是正极。Al在浓硝酸中发生钝化,Zn在浓硝酸中被氧化,即在浓硝酸中活动性:Zn>Al,Zn是负极,Al是正极,所以在实验5中电流计指针偏向铝。
15
相关文档
- 2020高中化学 第14天 有关气体的相2021-08-233页
- 2020版高中化学 第四章 非金属及其2021-08-236页
- 化学卷·2019届湖北省宜昌市示范高2021-08-239页
- 2020版高中化学 第1章 原子结构与2021-08-236页
- 2019-2020版高中化学(人教版 选修3)2021-08-238页
- 高中化学人教版全套教师用书选修32021-08-2391页
- 2020高中化学 原子结构(提高)知识讲2021-08-238页
- 2020高中化学 电解原理(提高)知识讲2021-08-235页
- 高中化学人教版选修四(课件)第四章 2021-08-2345页
- 2020新教材高中化学第1章原子结构2021-08-234页