- 309.81 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微题型37 化学工艺流程题(二)——核心反应与条件的控制
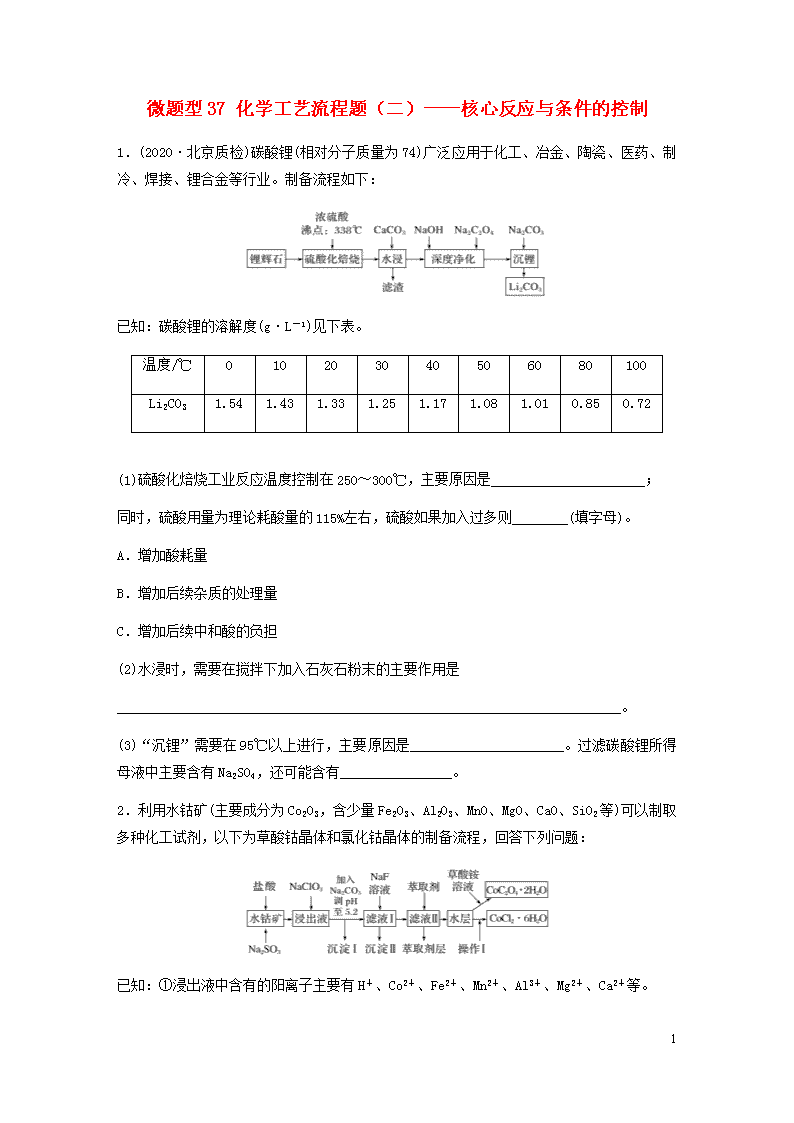
1.(2020·北京质检)碳酸锂(相对分子质量为74)广泛应用于化工、冶金、陶瓷、医药、制冷、焊接、锂合金等行业。制备流程如下:
已知:碳酸锂的溶解度(g·L-1)见下表。
温度/℃
0
10
20
30
40
50
60
80
100
Li2CO3
1.54
1.43
1.33
1.25
1.17
1.08
1.01
0.85
0.72
(1)硫酸化焙烧工业反应温度控制在250~300℃,主要原因是______________________;
同时,硫酸用量为理论耗酸量的115%左右,硫酸如果加入过多则________(填字母)。
A.增加酸耗量
B.增加后续杂质的处理量
C.增加后续中和酸的负担
(2)水浸时,需要在搅拌下加入石灰石粉末的主要作用是
________________________________________________________________________。
(3)“沉锂”需要在95℃以上进行,主要原因是______________________。过滤碳酸锂所得母液中主要含有Na2SO4,还可能含有________________。
2.利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
7
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
开始
沉淀
2.7
7.6
7.6
4.0
7.7
完全
沉淀
3.7
9.6
9.2
5.2
9.8
(1)浸出过程中Co2O3发生反应的离子方程式为______________________________________
________________________________________________________________________。
(2)加入NaClO3的作用是___________________________________________________。
(3)加入Na2CO3调pH至5.2,目的是______________;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为________________。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,________、________、过滤、洗涤、减压烘干等过程。
3.(2019·长春实验中学模拟)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大变化。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是________(填字母)。
a.Feb.FeOc.Fe3O4d.Fe2O3
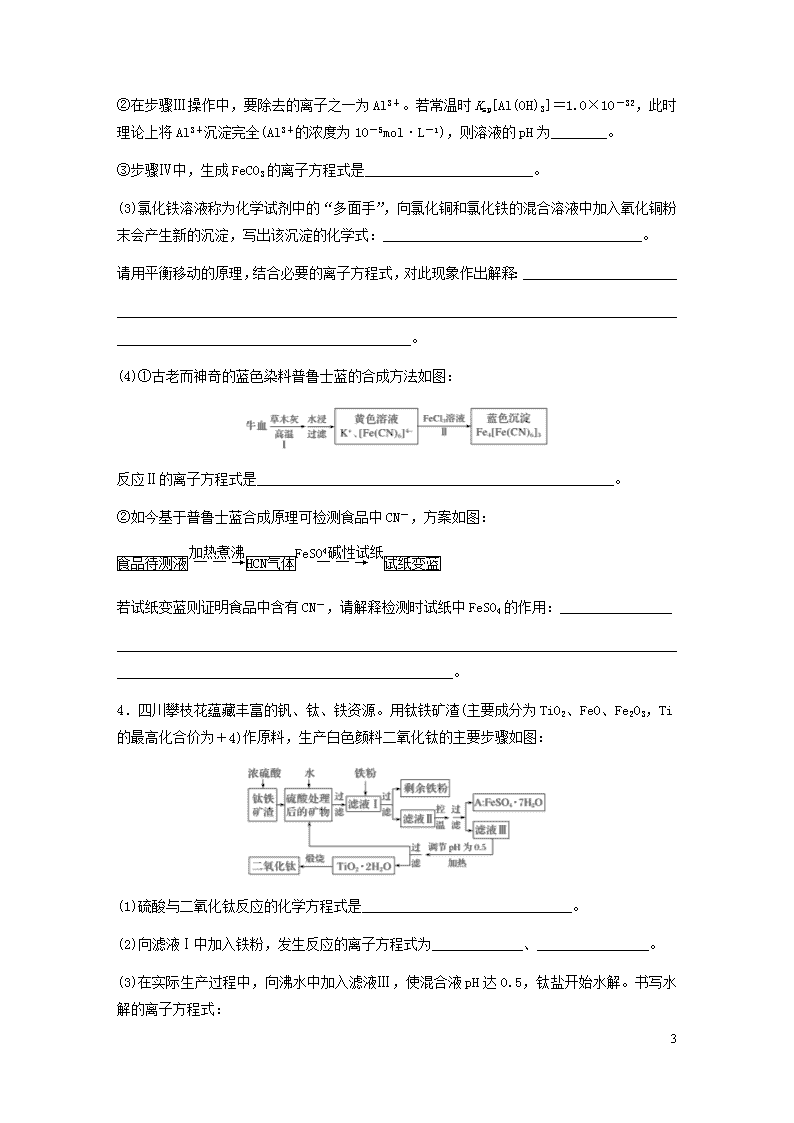
(2)硫酸渣的主要化学成分为SiO2约45%、Fe2O3约40%、Al2O3约10%、MgO约5%。用该废渣制取药用材料——红氧化铁的工艺流程如图(部分操作和条件略):
①在步骤Ⅰ中产生的气体可能有________。
7
②在步骤Ⅲ操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全(Al3+的浓度为10-5mol·L-1),则溶液的pH为________。
③步骤Ⅳ中,生成FeCO3的离子方程式是________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式:_____________________________________。
请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______________________
__________________________________________________________________________________________________________________________。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如图:
反应Ⅱ的离子方程式是___________________________________________________。
②如今基于普鲁士蓝合成原理可检测食品中CN-,方案如图:
若试纸变蓝则证明食品中含有CN-,请解释检测时试纸中FeSO4的作用:________________
________________________________________________________________________________________________________________________________。
4.四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的主要步骤如图:
(1)硫酸与二氧化钛反应的化学方程式是______________________________。
(2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为_____________、________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。书写水解的离子方程式:
7
________________________________________________________________________。
(4)水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:____________________
________________________________________________________________________。
(5)过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、____________________(填化学式),减少废物排放。
(6)A可用于生产红色颜料(Fe2O3),其实验方法是:
a.5.56akgA(摩尔质量为278g·mol-1)溶于水中,加入适量氢氧化钾溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;
b.再向红褐色胶体中加入33.36bkgA和1.12ckg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;
c.过滤后,沉淀经高温灼烧得红色颜料。
若所得滤液中溶液只有硫酸钾和硫酸铁,则理论上可生产红色颜料________kg。
5.(2019·银川月考)铁红(Fe2O3)和钛白粉(TiO2)均为重要的墙面装修颜料。一种利用钛铁矿(主要成分为FeTiO3,还含有少量Fe2O3)联合生产铁红和钛白粉的工艺流程如图所示。
回答下列问题:
(1)FeSO4溶液与NH4HCO3溶液的反应温度应控制在35℃以下,其原因是________________________________________________________________________
________________________________________________________________________,
该反应的离子方程式是___________________________________________________。
(2)TiO2+转化为TiO(OH)2需要加热,加热的目的是_________________________________,该反应的离子方程式为__________________________________________________。
(3)常温时,在生成的FeCO3达到沉淀溶解平衡的溶液中,测得溶液中c(CO)=3.0×10-6
7
mol·L-1,pH为8.5,则所得的FeCO3中是否含Fe(OH)2?(列式计算)
{已知Ksp(FeCO3)=3.0×10-11,Ksp[Fe(OH)2]=8.0×10-16}
7
答案精析
1.(1)温度低于250℃,反应速率较慢;温度高于300℃,硫酸挥发较多 ABC (2)除去多余的硫酸,同时调整pH,除去大部分杂质
(3)温度越高,碳酸锂溶解度越小,可以增加产率 Na2CO3、Li2CO3
解析 (1)若温度过低,反应速率慢,若温度过高,则浓H2SO4沸腾,挥发较多。(2)加入CaCO3一是和多余的H2SO4反应,二是调节pH除去大部分杂质。(3)由表格中数据可知,温度越高,Li2CO3溶解度越小,故沉锂在95℃以上进行可增加产率。过滤后的母液中除含Na2SO4外还可能有Na2CO3、Li2CO3。
2.(1)Co2O3+SO+4H+===2Co2++SO+2H2O (2)将Fe2+氧化为Fe3+,便于后面调节pH时生成Fe(OH)3沉淀而除去
(3)使Fe3+和Al3+沉淀完全 CaF2和MgF2 (4)蒸发浓缩 冷却结晶
3.(1)c (2)①CO、SO2 ②5 ③Fe2++2HCO===FeCO3↓+CO2↑+H2O (3)Fe(OH)3 Fe3++3H2OFe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀 (4)①3[Fe(CN)6]4-+4Fe3+===Fe4[Fe(CN)6]3↓ ②碱性条件下,Fe2+与CN-结合生成[Fe(CN)6]4-,Fe2+被空气中O2氧化生成Fe3+,[Fe(CN)6]4-与Fe3+反应生成普鲁士蓝使试纸显蓝色
解析 (2)①由分析可知,“焙烧”中产生的气体可能有CO、SO2等;②常温时Ksp[Al(OH)3]=1.0×10-32,理论上将Al3+沉淀完全时,c(OH-)===10-9mol·L-1,则c(H+)==10-5mol·L-1,pH=5;③生成FeCO3的离子方程式是Fe2++2HCO===FeCO3↓+CO2↑+H2O。(3)因为Fe3+会水解产生H+:Fe3++3H2OFe(OH)3+3H+,加入CuO与H+反应生成Cu2+和H2O,降低了H+浓度,使得水解平衡正向移动,生成Fe(OH)3沉淀。
4.(1)TiO2+2H2SO4===Ti(SO4)2+2H2O(或TiO2+H2SO4===TiOSO4+H2O) (2)2Fe3++Fe===3Fe2+ Fe+2H+===H2↑+Fe2+ (3)Ti4++4H2OTiO2·2H2O+4H+ (或TiO2++3H2OTiO2·2H2O+2H+) (4)加水促进钛盐水解,加热促进钛盐水解,降低H+浓度促进钛盐水解 (5)H2O、FeSO4、H2SO4 (6)(1.60a+3.20b+1.60c)
解析 (2)浓硫酸有强氧化性,加入钛铁矿渣中能生成Fe3+,加入铁粉,发生Fe+2Fe3+===3Fe2+;铁粉还可以与溶液中过量的H+反应,离子方程式为Fe+2H+===Fe2++H2↑。(3)钛盐水解的离子方程式:Ti4++4H2OTiO2·2H2O+4H+或TiO2++3H2OTiO2·2H2O+2H
7
+。(4)影响钛盐水解的因素有浓度、温度等,高温水蒸气使水解平衡移动的作用是加水、加热、降低H+浓度均可促进钛盐水解。(5)根据该工艺流程知滤液Ⅲ的主要成分为大量的钛盐、溶解的硫酸亚铁、少量的硫酸(混合液pH达0.5)等,钛盐水解后过滤分离出水合二氧化钛,得到的滤液中含有未水解的钛盐及FeSO4、H2SO4、H2O等。(6)依题意A与适量氢氧化钾溶液恰好完全反应,FeSO4+2KOH===K2SO4+Fe(OH)2↓,根据开始加入A为20amol,可知加入KOH为40amol;后来又加入120bmol的A和20cmol的铁,由K2SO4、FeSO4、Fe2(SO4)3、Fe2O3等化学式的定量组成和守恒思想分别可求得以下各量:利用K+守恒,n(KOH)=2n(K2SO4),可知K2SO4物质的量为20amol;利用SO守恒,n(FeSO4)=n(K2SO4)+3n[Fe2(SO4)3],可知Fe2(SO4)3物质的量为(20a+120b-20a)mol×=40bmol;利用Fe原子守恒,n(FeSO4)+n(Fe)=2n[Fe2(SO4)3]+2n(Fe2O3),可知n(Fe2O3)=(20a+120b+20c-40b×2) mol×=(10a+20b+10c)mol,计算得m(Fe2O3)=(1.60a+3.20b+1.60c)kg。
5.(1)减少NH4HCO3分解、减少Fe2+水解 Fe2++2HCO===FeCO3↓+CO2↑+H2O (2)促进TiO2+水解,加快反应速率 TiO2++2H2O△,TiO(OH)2↓+2H+ (3)Ksp(FeCO3)=c(Fe2+)·c(CO),故c(Fe2+)==1.0×10-5mol·L-1,pH=8.5,则c(OH-)=10-5.5mol·L-1,故c(Fe2+)·c2(OH-)=10-16
相关文档
- 2018-2019学年新疆生产建设兵团第2021-08-2312页
- 高二化学教案【专题八】化学中的“2021-08-235页
- 高中化学教案新人教版必修2 元素周2021-08-232页
- 化学卷·2018届广东省揭阳市揭西县2021-08-2323页
- 2021新高考化学鲁科版一轮复习突破2021-08-236页
- 2021版化学名师讲练大一轮复习鲁科2021-08-235页
- 四川省威远中学2020届高三上学期第2021-08-2319页
- 化学卷·2019届湖南省衡阳县五中高2021-08-235页
- 2017-2018学年吉林省长春外国语学2021-08-2314页
- 北京市中国人民大学附属中学2019-22021-08-2321页