- 193.50 KB
- 2021-08-23 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
训练3 电解原理
[基础过关]
一、电解池的电极名称的判断
1. 关于原电池、电解池的电极名称,下列说法错误的是 ( )
A.原电池中失去电子的一极为负极
B.电解池中与直流电源负极相连的一极为阴极
C.原电池中相对活泼的一极为正极
D.电解池中发生氧化反应的一极为阳极
2. 电解池中,阳极的电极材料一定 ( )
A.发生氧化反应 B.与电源正极相连
C.是铂电极 D.得电子
3. 若某装置发生如下反应:Cu+2H+===Cu2++H2↑,关于该装置的有关说法正确的是
( )
A.该装置一定为原电池
B.该装置为电解池
C.若为原电池,Cu为正极
D.电解质溶液可能是硝酸溶液
二、电极反应式、电解方程式的书写
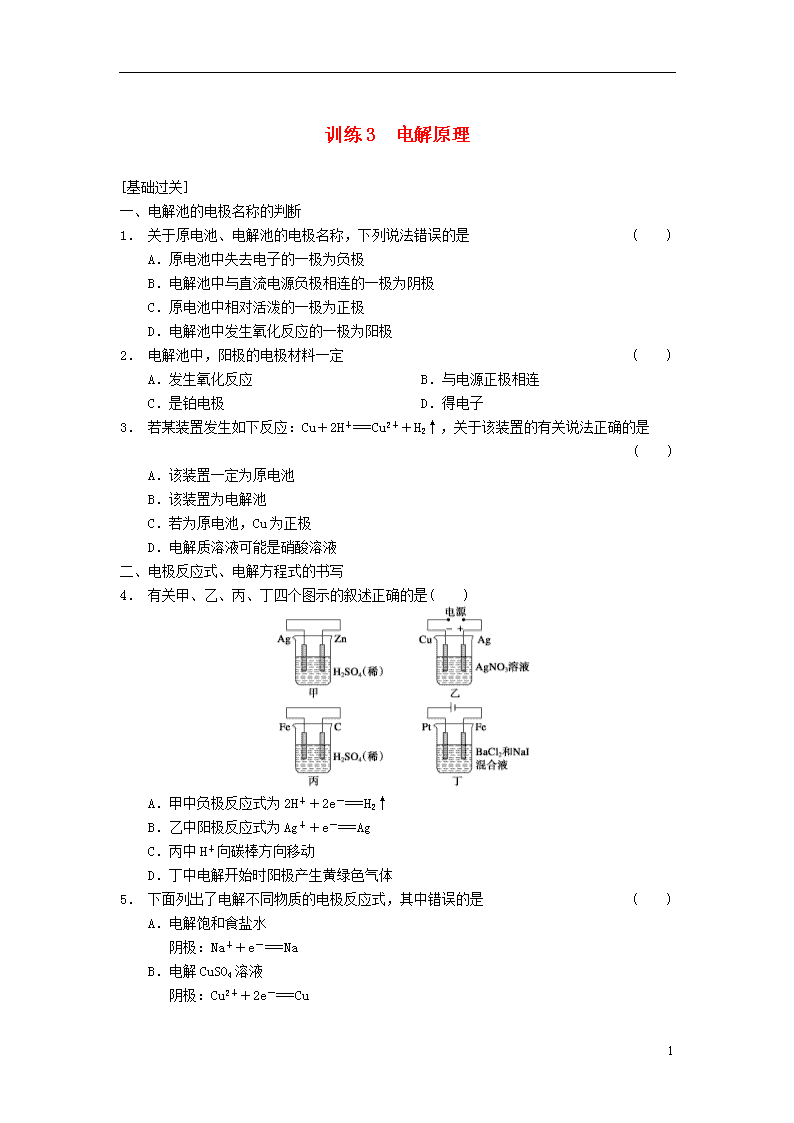
4. 有关甲、乙、丙、丁四个图示的叙述正确的是( )
A.甲中负极反应式为2H++2e-===H2↑
B.乙中阳极反应式为Ag++e-===Ag
C.丙中H+向碳棒方向移动
D.丁中电解开始时阳极产生黄绿色气体
5. 下面列出了电解不同物质的电极反应式,其中错误的是 ( )
A.电解饱和食盐水
阴极:Na++e-===Na
B.电解CuSO4溶液
阴极:Cu2++2e-===Cu
5
C.电解熔融NaCl
阴极:Na++e-===Na
D.电解NaOH溶液
阳极:4OH--4e-===2H2O+O2↑
6. 用惰性电极电解物质的量浓度相同、体积比为1∶3的CuSO4和NaCl的混合溶液,可能发生的反应有 ( )
①2Cu2++2H2O2Cu+4H++O2↑
②Cu2++2Cl-Cu+Cl2↑
③2Cl-+2H+H2↑+Cl2↑
④2H2O2H2↑+O2↑
A.①②③ B.①②④ C.②③④ D.②④
三、酸、碱、盐溶液的电解规律
7. 用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中正确的有 ( )
①该溶液的pH可能增大;②该溶液的pH可能减小;
③该溶液的pH可能不变;④该溶液的浓度可能增大;
⑤该溶液的浓度可能不变;⑥该溶液的浓度可能减小
A.①②③ B.①②③④
C.①②③④⑤ D.全部
8. Cu2O是一种半导体材料,基于绿色化学理论设计的制取Cu2O的电解池示意图如下,电解总反应为2Cu+H2OCu2O+H2↑。下列说法正确的是 ( )
A.石墨电极上产生氢气
B.铜电极发生还原反应
C.铜电极接直流电源的负极
D.当有0.1 mol电子转移时,有0.1 mol Cu2O生成
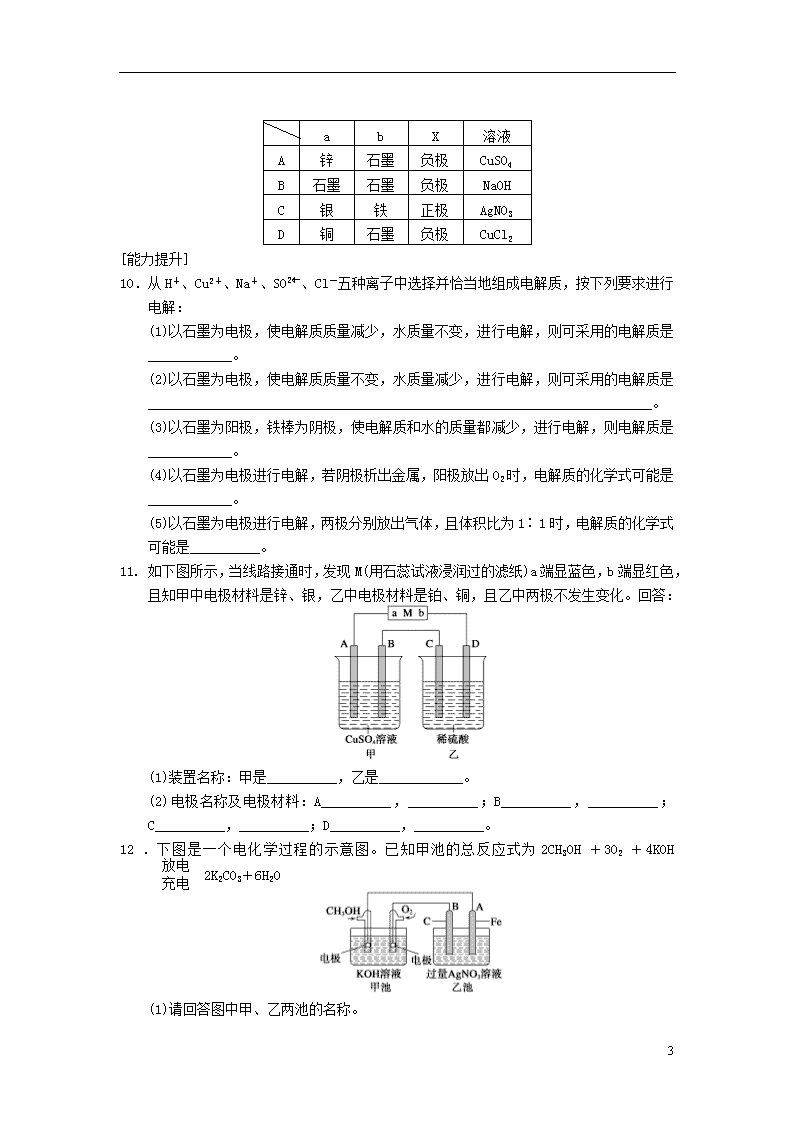
9. 下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的( )
5
a
b
X
溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
[能力提升]
10.从H+、Cu2+、Na+、SO、Cl-五种离子中选择并恰当地组成电解质,按下列要求进行电解:
(1)以石墨为电极,使电解质质量减少,水质量不变,进行电解,则可采用的电解质是____________。
(2)以石墨为电极,使电解质质量不变,水质量减少,进行电解,则可采用的电解质是________________________________________________________________________。
(3)以石墨为阳极,铁棒为阴极,使电解质和水的质量都减少,进行电解,则电解质是____________。
(4)以石墨为电极进行电解,若阴极析出金属,阳极放出O2时,电解质的化学式可能是____________。
(5)以石墨为电极进行电解,两极分别放出气体,且体积比为1∶1时,电解质的化学式可能是__________。
11. 如下图所示,当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂、铜,且乙中两极不发生变化。回答:
(1)装置名称:甲是__________,乙是____________。
(2)电极名称及电极材料:A__________,__________;B__________,__________;C__________,__________;D__________,__________。
12.下图是一个电化学过程的示意图。已知甲池的总反应式为2CH3OH+3O2+4KOH2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。
5
甲池是__________装置,乙池是__________装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是__________,B(石墨)电极的名称是____________。
(3)写出电极反应式:通入O2的电极的电极反应式是
________________________________________________________________________。
A(Fe)电极的电极反应式为__________________________________________________。
(4)乙池中反应的化学方程式为______________________________________________
________________________________________________________________________。
13.下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到 336 mL (标准状态)气体。回答:
(1)直流电源中,M为__________极。
(2)Pt电极上生成的物质是______,其质量为______g。
(3)电源输出的电子,其物质的量与电极b、c、d分别生成的物质的物质的量之比为2∶______∶______∶________________________________________________________________________。
(4)AgNO3溶液的浓度________(填“增大”、“减小”或“不变”,下同),AgNO3溶液的pH______,硫酸的浓度__________,硫酸的pH________。
(5)若硫酸的质量分数由5.00%变为5.02%,则原有5.00%的硫酸________g。
[拓展探究]
14.高氯酸铵(AP)受高温和猛烈撞击能引起爆炸,可用作火箭推进剂。目前制备高氯酸铵的流程如下:
―→混合物AHClOHClO3HClO4NH4ClO4
(1)写出Cl2和NaOH溶液反应的离子方程式:_________________________________
________________________________________________________________________。
(2)将HClO3加入到电解槽中,电解产生H2和O3,产生H2的电极名称为__________,写出产生O3的电极反应式:________________________________________________。
(3)O3与ClO反应生成ClO,O3与ClO反应中氧化剂与还原剂的物质的量之比为__________。
5
答案
1.C 2.B 3.B 4.C 5.A 6.D 7.C 8.A 9.A
10.(1)HCl、CuCl2 (2)H2SO4、Na2SO4、NaHSO4
(3)CuSO4、NaCl (4)CuSO4 (5)HCl、NaCl
11.(1)原电池 电解池
(2)负极 Zn 正极 Ag 阳极 Pt 阴极 Cu
12.(1)原电池 电解池 (2)负极 阳极
(3)O2+4e-+2H2O===4OH-
4Ag++4e-===4Ag
(4)4AgNO3+2H2O4Ag+O2↑+4HNO3
13.(1)正 (2)Ag 2.16 (3)2 1
(4)不变 不变 增大 减小 (5)45.18
14.(1)Cl2+2OH-===Cl-+ClO-+H2O
(2)阴极 6OH--6e-===O3↑+3H2O
(3)1∶3
5
相关文档
- 2020年高中化学 第四章 电化学基础2021-08-236页
- 2020高中化学 电解原理(提高)知识讲2021-08-235页
- 2020高中化学 电解原理的应用(提高)2021-08-235页
- 【推荐】专题4-3-1+电解原理(测)-2012021-08-067页
- 2020高中化学 电解原理(提高)巩固练2021-08-065页
- 2018届二轮复习电解原理及其应用课2021-08-0675页
- 2020高中化学 电解原理的应用(基础)2021-08-066页
- 高中化学选修4课件_19电解原理的应2021-08-0644页
- 2020高中化学 电解原理的应用(提高)2021-08-066页
- 2019-2020学年高二化学人教版选修42021-08-067页